Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Tecnología Química
versión On-line ISSN 2224-6185
RTQ vol.31 no.2 Santiago de Cuba may.-ago. 2011
ARTÍCULO ORIGINAL
ESCALADO DE LA REACCIÓN DE BIOSÍNTESIS DE FRUCTOOLIGOSACÁRIDOS, A PARTIR DE SACAROSA, EN BIORREACTORES TIPO TANQUE AGITADO
CLIMATE CHANGE OF BIOSINTHESIS REACTION FRACTOOLIGOSACÁRIDOS, FROM SACAROSE, IN BIORRACTORS TYPE SHAKED TANK
MSc. Enrique R. Pérez-CruzI, MSc. Duniesky Martínez-GarcíaI, Lic. Alina Sobrino-LegónI, Dr. Iván Rodriguez-RicoII, Dr. Lázaro HernándezIII
I: Centro de Ingeniería Genética y Biotecnología, Sancti Spíritus, Cuba. enrique.perez@cigb.edu.cu
II: Departamento de Ingeniería Química, Universidad Central de las Villas, Cuba
III: Centro de Ingeniería Genética y Biotecnología, Habana, Cuba
RESUMEN
En este trabajo se estudió el escalado de la reacción de síntesis de fructooligosacáridos a partir de la sacarosa, catalizada por un biocatalizador conformado por células recombinantes vivas de Pichia pastoris inmovilizadas en alginato de calcio, en un biorreactor tipo tanque agitado de 5 L de capacidad y dotado de un impelente con aspas en forma de hélices. Se analizaron las consecuencias del escalado de 5 a 50 L de la reacción de biocatálisis aplicando el método del Principio de similitud e identificando los criterios de igual velocidad en la punta del impulsor (ND) e igual potencia volumétrica (P/V) como los más adecuando. También se corroboró prácticamente la validez de la aplicación del criterio de escalado igual ND al alcanzar rendimientos de 1-kestosa de 322 g/L en el modelo 5 L y 320 g/L en el prototipo de 50 L.
Palabras claves: escalado, fructooligosacáridos, biorreactores.
ABSTRACT
In this paper we studied the scale-up of the synthesis of fructooligosaccharides from sucrose, catalyzed by a biocatalyst consisting of living cells of Pichia pastoris recombinant immobilized in calcium alginate, in a stirred tank bioreactor type 5-L capacity and equipped with an impeller of blades on a propeller. We analyzed the impact of scale-up from 5 to 50 L of bio-catalysis reaction using the method of the principle of similarity and identifying the criteria of equal tip speed of impeller (ND) and the same volumetric power (P/V) as the most suitable. Also confirmed the validity of practically applying the criterion of scale-up as ND to achieve yields of 1-kestose from 322 g/L in model 5-L, 320 g/L in the prototype of 50 L.
Keywords: scale-up, fructooligosaccharides, bioreactor.
INTRODUCCIÓN
Los fructooligosacáridos (FOS), son carbohidratos naturales formados por 1 a 9 residuos de fructosa enlazados a una molécula de sacarosa por enlaces 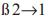 . Su consumo ha recibido un particular interés debido a sus excelentes propiedades biológicas y funcionales como prebiótico. Los FOS son hipocalóricos, edulcorantes no criogénicos, estimulan de forma selectiva el crecimiento de Bifidobacterios y Lactobaciluslo que contribuye a la prevención del cáncer de colon y la reducción de los niveles de colesterol, fosfolípidos y triglicéridos en suero [14,18].
. Su consumo ha recibido un particular interés debido a sus excelentes propiedades biológicas y funcionales como prebiótico. Los FOS son hipocalóricos, edulcorantes no criogénicos, estimulan de forma selectiva el crecimiento de Bifidobacterios y Lactobaciluslo que contribuye a la prevención del cáncer de colon y la reducción de los niveles de colesterol, fosfolípidos y triglicéridos en suero [14,18].
Los FOS que se comercializan son obtenidos por dos vías: hidrólisis de la inulina vegetal [6,18] y por síntesis enzimática a partir de la sacarosa empleando como biocatalizadores micelios del los hongo Asperigillus niger o Aereobasidium popullans inmovilizados en alginato de calcio [3,10,18]. Durante la síntesis de FOS mediada por biocatalizadores de origen fungoso se produce una mezcla de carbohidratos donde los fructooligosacáridos constituyen más de 55 % de total compuestos por un 25 % 1-kestosa (GF3), 25 % de nistosa (GF4) y 5 % de fructosilnistosa (GF5) [17,18], siendo la 1-kestosa el de mayor valor comercial [15].
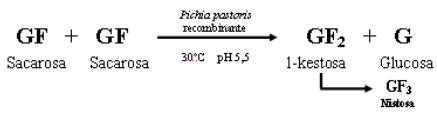
La obtención de fructooligosacáridos con una composición de 1-kestosa de más de 50 % se logró al utilizar un biocatalizador de células recombinantes de Pichia pastoris, que expresan una fructosiltransferasa vegetal, inmovilizadas en alginato calcio [12]. La reacción de síntesis se realizó a una concentración de 600 g/L de sacarosa en tampón acetato de sodio 0,1M pH 5,5, temperatura de 30 ºC. La representación esquemática de dicha reacción se muestra en la figura 1.
Fig. 1 Representación esquemática de la reacción de síntesis FOS, catalizada por células de
Pichia pastorisrecombinante inmovilizadasalginato de calcio.
La producción de FOS a escala piloto o industrial siguiendo la reacción descrita en la figura 1 requiere adicionalmente la consideración de parámetros operacionales en dependencia del tipo de biorreactor a utilizar. De ahí que este trabajo tuvo como objetivo realizar el escalado de la reacción de biocatálisis a un biorreactor tipo tanque agitado, ya existente, de 50 L de volumen efectivo de trabajo a partir de determinar las condiciones operacionales en un biorreactor modelo con similares características geométricas y 5 L de capacidad.
FUNDAMENTACION TEORICA
La reacción de biocatálisis basada en células inmovilizadas es un proceso de cinética enzimática en fase heterogénea, pues con este tipo de biocatalizador se introduce una fase sólida en el biorreactor. La inmovilización de las células provoca que la velocidad de reacción global dependa de las resistencias a la transferencia de masa del sustrato desde el medio líquido al sitio activo en el interior de la partícula de biocatalizador.
Estas resistencias generan gradientes de concentración de sustrato de cuya intensidad depende el mecanismo de transferencia de masa [1,5]. Hipotéticamente las etapas de resistencia a la transferencia de masa que ha de vencer el sustrato hasta llegar al sitio activo son:
1) del seno de líquido hasta la película de líquido,
2) a través de la película de líquido, difusión externa,
3) desde la superficie de la partícula hasta el interior del sitio activo.
La reducción del tiempo de tránsito del sustrato por las etapas antes mencionadas depende del soporte, del medio y de los parámetros operacionales [5]. Por lo general, los valores óptimos de soporte, medio, pH, temperatura y la carga de biocatalizador por cantidad de sustrato son parámetros que se determinan en estudios a nivel de frascos y que no varían por cambio de equipamiento o de la escala [7]. Los parámetros operacionales que inciden en la transferencia de masa tales como: velocidad de agitación, velocidad espacial, flujo, caída de presión, etcétera están asociados con el tipo de biorreactor y escala, por lo que su optimización depende del sistema a utilizar.
Los biorreactores recomendados en reacciones de biocatálisis mediadas por células vivas inmovilizadas en alginato de calcio, son tanque agitado discontinuo o continuo y lecho fijo o fludizado [9]. En las reacciones que se requiere control de pH se utilizan biorreactores tipo tanque agitado.
La selección de un reactor tipo tanque agitado es una de las soluciones a tener en cuenta en la reacción de biocatálisis para la obtención de FOS mediada por células recombinantes vivas de Pichia pastoris, pues posibilita el control de pH y no se afecta la eficiencia catalítica por la producción de gases como sucede en los reactores de lecho fijo [9]. Además es posible aumentar la transferencia de masa aumentando la agitación, al reducir el grosor de la capa límite debido a la renovación continua de la superficie en las fases de interacción. Un régimen de agitación eficiente es aquel que mantenga las perlas de biocatalizador en suspensión y homogenice la mezcla de sustratos y productos [2,16].
El régimen de agitación está determinado por la geometría del reactor, el tipo de impelente, las características reológicas de la solución y la velocidad de agitación, está última es la variable a optimizar. La velocidad de agitación óptima será aquella en la que se logre alcanzar la máxima actividad del biocatalizador en suspensión con el sustrato y que se reduzca al mínimo la fragmentación por cizallamiento. Adicionalmente la fragmentación por cizallamiento de perlas de alginato puede ser mitigada en mayor grado cuando se usa un impelente de hélice [8].
MATERIALES Y METODOS
Biocatalizador
Células de Pichia pastoris recombinante que expresa 1- sacarosa:sacarosa fructosiltransferasa inmovilizadas en alginato de calcio 2 % (p/v) con una actividad de 10 U/g. Una unidad de enzima (U) representa la cantidad de biocatalizador que libera 1 mmol de glucosa por minuto a velocidades iniciales de la reacción en una solución de sacarosa a 1,75 M en tampón acetato de sodio 0,1 M, pH 5,5, a 30 ºC.
Determinación de glucosa liberada
A 400 µL de las muestras tomadas de la reacción de biocatálisis o su dilución se les adicionó igual volumen ácido dinitrosalicílico (DNSA). La mezcla se incubó por 10 min a 100ºC, posteriormente se enfrió en hielo por 5 min. Se tomaron 100 µL y se colocaron en una placa Costar de 96 pozos y se leyó la absorbancia a 550 nm en un lector de placas Fotómetro-Fluorímetro PR-521. Se utilizó como patrón una curva de glucosa (Sigma).
Separación de productos de la biocatálisis en cromatografía en capa fina
Las cromatografías en capa fina se realizaron en placas de sílica-gel 60 (Merck, Alemania). Las muestras se diluyeron hasta 5 ºBx. y se aplicó 1 µL a la placa, como solvente de corrida se utilizó acetona 95 % (v/v). Se realizaron 5 corridas y los compuestos fructosados se observaron después de asperjar la placa con una solución saturada de 1-butanol, urea 3 % (p/v) y etanol absoluto 5 % (v/v) e incubarla a 100 ºC por 15 min.
Cuantificación de los carbohidratos en la reacción de biocatálisis
El análisis cuantitativo de las muestras se realizó por HPLC de un sistema isocrático combinado con detección por índice de refracción para el análisis de carbohidratos. Se aplicaron 20 µL de muestra en una columna Aminex HPX 42-C (BioRad, Richmond), con un flujo de trabajo de 0,6 mL/min, una presión de aproximadamente 52 bar y una temperatura de trabajo de 81,7 °C. El solvente utilizado fue agua mili-Q. Se empleó un detector de índice de refracción Knauer Differential-Refractometer. Los resultados se analizaron con ayuda del paquete informático BioCrom, versión 3,0, CIGB, 1996-1997.
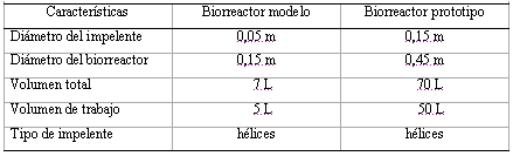
Características de los biorreactores
Las características de diseño de los biorreactores utilizados se muestran en la tabla 1.
Tabla 1
Característica de diseño de los birreactores
Condiciones cinemáticas de la reacción de biocatálisis
- Temperatura: 30 ºC, pH 5,5
- Concentración de sacarosa inicial: 600 g/L
- Tiempo de reacción: 72 h
- Relación peso de biocatalizador/volumen de sustrato (g/L): 1/10
- La velocidad de agitación del impelente fue la variable a estudiar en el biorreactor modelo, modificando la misma en un rango de 0-200 rpm.
Influencia de la velocidad de agitación en la velocidad de reacción
Para estudiar el efecto de la agitación en la producción de FOS, se varió la misma en un rango de valores de 0, 100 y 200 rpm en el biorreactor modelo con una carga de biocatalizador en una relación 1:10 peso de biocatalizador/volumen de sustrato y manteniendo constante las restantes condiciones operacionales de concentración inicial de sacarosa 600 g/L, temperatura 30 ºC y tiempo de reacción de 3 h. Transcurrido ese tiempo se detuvo la reacción, determinado la glucosa producida durante la síntesis de FOS.
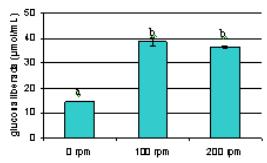
La glucosa liberada, indicativo de velocidad global de la reacción de biocatálisis, fue 2,6 veces más alta en las reacciones con agitación que sin ella (figura 2). Sin embargo, no existió diferencia significativa entre la glucosa liberada a 100 y 200 rpm, por lo que una agitación de 100 rpm es suficiente para mantener el biocatalizador en suspensión y disminuir la película de líquido en la superficie de las perlas aumentando el contacto con el sustrato y la liberación del producto. Al no variar la cantidad de producto con el aumento de la agitación parece ser que la difusión en el interior de las perlas continúa siendo la limitante del proceso y es independiente de la agitación externa.
Fig. 2 Glucosa liberada a diferentes velocidades de agitación del impelente.
Las perlas se incubaron en sacarosa 1,75 M en una relación 0,16 g de biocatalizador/gramo de sustrato a 30 ºC por 3 h y la agitación se varió a 0, 100 y 200 rpm.
Los valores representan la media ± el error estándar de tres réplicas. Letras diferentes denotan diferencias significativas entre los valores de glucosa liberada a las diferentes agitaciones ensayadas (prueba de Student-Newman-Keuls, p=0,05).
Estudio de la reacción de biocatálisis en biorreactor modelo (5 L)
Después de determinar que a la velocidad de agitación de 100 rpm se alcanza la máxima velocidad de reacción en el biorreactor modelo con un impelente de hélices, se procedió a desarrollar la reacción de biocatálisis bajo este régimen de agitación por 72 h. Se observó que a medida que transcurre el tiempo de reacción hay un aumento progresivo de la concentración del trisacárido (1-kestosa) y una disminución de la sacarosa como se muestra en la separación por cromatografía de placa delgada de la figura 3. Cuando disminuyó la concentración de sacarosa solo se apreció una débil tendencia a la polimerización a partir de 1-kestosa y a la actividad de hidrólisis. En condiciones similares otros biocatalizadores conformados por fructosiltransferasas de origen fungoso o bacteriano muestran síntesis de 1-nistosa a partir de la 1-kestosa. [11,18]. Transcurrido el tiempo total de reacción la concentración de 1-kestosa es de 322 + 7 g/L, representando el 53,6 % de los carbohidratos totales presentes en la mezcla, lo que significa que se ha alcanzado un rendimiento cuyos valores oscilan entre los máximos obtenidos en estudios a escala de laboratorio [12].
Análisis de las consecuencias de la aplicación de los diferentes criterios de escalado para operar el biorreactor prototipo (50 L).
En el escalado de la reacción de biocatálisis a 50 L se empleó el método basado en el “Principio de Similitud” a partir de la información obtenida en los ensayos realizados en el biorreactor modelo. La aplicación de este método se basa en garantizar similitud mecánica que implica la geométrica, cinemática y dinámica, así como la química y térmica las que son posibles de lograr al mantener:
- Igual relación diámetro de impelente/diámetro del tanque
- Igual temperatura, pH y tiempo de reacción
- Igual relación biocatalizador/sustrato
Además se complementa si el escalado se realiza teniendo en cuenta al menos uno de los siguientes criterios de escalado:

La selección de uno u otro criterio de escalado está sujeto al análisis de las consecuencias de adoptar cada uno de ellos en nuestro sistema de reacción. La determinación de las consecuencias se realiza a través del cálculo teórico de cada uno de los parámetros que caracteriza el sistema, por ejemplo:
Igual velocidad en la punta del impulsor o impelente donde:

De forma similar a los dos ejemplos antes ilustrados se realiza el cálculo de la velocidad de agitación (N50) para los restantes criterios de escalado aplicando la ecuación correspondiente. En la tabla 2 se muestra el resumen del comportamiento de los diferentes parámetros según el criterio de escalado seleccionado.
Tabla 2
Valores de los diferentes parámetros según el criterio de escalado aplicado
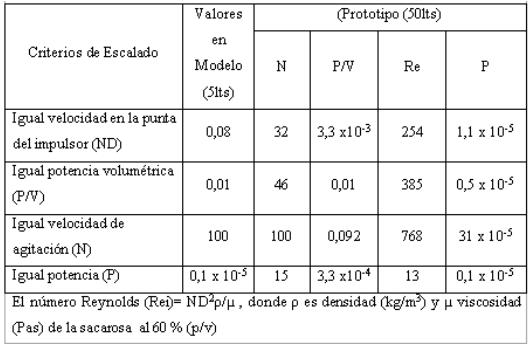
Al analizar los resultados mostrados en la tabla 2 se observa que si se mantiene como criterio, igual velocidad en la punta de impulsor, el número de Reynolds se incrementa en 3 veces, la potencia total en 11 veces y la potencia volumétrica en 3 veces con respecto al biorreactor modelo. Cuando es empleado el criterio igual potencia volumétrica el número de Reynolds se incrementa en 4,5 veces y la potencia total en 5 veces. A pesar de que la aplicación de ambos métodos resultó en un aumento del número de Reynolds entre 3 y 4,5 veces, no implica un cambio del régimen de flujo, los valores de potencia son proporcionales al cambio de escala. De ahí que se afirme, que en el escalado de la reacción de biocatálisis en un biorreactor discontinuo es posible aplicar los criterios de igual velocidad en la punta del impulsor (ND) e igual potencia volumétrica (N3D2).
La aplicación de los otros criterios de escalado fue descartada debido a que igual velocidad del agitador originaría un consumo de potencia 30 veces superior y un número de Reynolds 10 veces superior, no proporcionales al cambio de escala, que provocaría un exceso de consumo de potencia y un régimen de flujo que produciría cizallamiento en las perlas del biocatalizador. En el caso de aplicar igual potencia no se lograría la homogeneidad requerida en el sistema.
Operación del biorreactor prototipo (50L)
La operación del biorreactor prototipo de 50 litros se realizó homogenizando el sistema a una velocidad de agitación de 32 rpm, que se corresponde con la aplicación del criterio de igual velocidad en la punta del impelente para el escalado de la reacción de biocatálisis, con este criterio se garantizó que el cizallamiento del biocatalizador fuera similar al producido en el biorreactor modelo [4, 13,19].
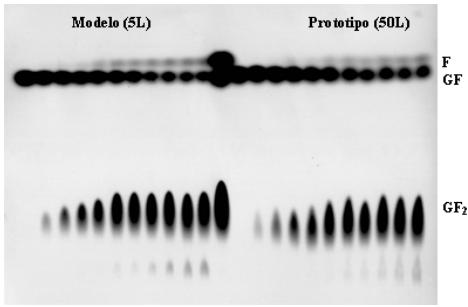
Fig. 3 Separación por cromatografía de capa fina de los productos resultantes en las cinéticas
de reacción en los biorreactores modelo y prototipo. Carriles1-11muestras del biorreactor
modelo tomadas cada 8 h desde las 0-72 h. Carril 12 Patrón de peso: (F) Fructosa, (GF) sacarosa
y (GF2) 1-kestosa. Carriles 13-24 muestras del biorreactor prototipo tomadas cada 8 horas
desde las 0-72 h.
En la figura 3 se muestra la separación por cromatografía de placa fina de los productos de la reacción de síntesis de fructooligosacáridos. Tanto para el biorreactor modelo como el prototipo, la reacción transcurrió de forma similar, lo que evidenció que el escalado aplicando el criterio igual velocidad en la punta de impulsor fue acertado. Además la cuantificación de la producción de 1-kestosa al cabo de las 72 h arroja valores de 320 + 5 g/L en el biorreactor prototipo, corroborando la anterior afirmación.
CONCLUSIONES
El escalado de la reacción de biocatálisis para la síntesis de fructooligosacáridos a partir de la sacarosa aplicando el Principio de Similitud basado en el criterio de igual velocidad en la punta de impulsor permite alcanzar rendimientos similares en ambas escalas.
BIBLIOGRAFIA
1. ALVARADO HUALLANCO, MB. y MAUGERIFILHO, F. Kinetics and modeling of fructooligosaccharide synthesis by immobilized fructosyltransferase from Rhodotorula sp. J Chem Technol Biotechnol 85. 2010. Págs. 1654-166.
2. ARROYO, M. Inmovilización de enzimas, Fundamentos, métodos y aplicaciones. Ars Pharmaceutica 39 (2). 1998. Págs. 111-127.
3. CHIEN, CS.; LEE, WC. y LIN TJ. Immobilization of Aspergillus japonicus by entrapping cells in gluten for production of fructooligosaccharides. Enzyme Microb Technol 29. 2001. Págs. 252-257.
4. DELVIGNE, F., DESTAIN, J. y THONART, P. A methodology for the design of scale-down bioreactors by the use of mixing and circulation stochastic models. Biochemical Engineering Journal 28 (3). 2006. Págs. 256-268.
5. DUTTA, R. Immobilized enzyme. en Fundamentals of Biochemical Engineering. Editado por Springer-Verlag. New York. 2008. Págs. 50-69.
6. FRANCK, A. Technological functionality of inulinand oligofructosa. British Journal of Nutrition 87 (2). 2002. Págs S287-S291.
7. ILLANES, A. Enzymes Biocatalysis Principles and Applications. Editado por Springer Science & Business Media B.V. 2008. Págs. 205-253.
8. JIROUT, T. y RIEGER, F. Impeller design for mixing of suspensions. Chemical Engineering Research and Design. 2010.
9. KIERSTAN, MPJ. y GOUGHLAN, MP. Immobilisation of cells and enzymes by gel entrapment. En: Immobilisation of cells and enzymes a practical approach. Washington DC. 1985. Págs. 39-54.
10. MAIORANO, AE. et al., Microbial production of fructosyltransferases for síntesis of pre-biotics. 2008. Págs. 1867-1877.
11. PÉREZ, E. R. y otros, Producción continua de fructo-ologosacáridos a partir de sacarosa utilizando la levanasacarasa de Gluconacetobacter diazotrophicus inmovilizada en tres soportes. Revista Centro Azúcar Vol 35, No 4, 2008. Págs. 65-90.
12. PÉREZ, E. R. et al., Novel technology of a yeastbased biocatalyzer for production of high-value fructooligosaccharides (FOS) from sucrose. Editorial Feijoo. 2010.
13. RODRÍGUEZ, IL. y BLÁQUEZ, G., Escalado de reactores químicos y biológicos. Granada, España. 2010.
14. SANGEETHA PT, RAMESH MN y PRAPULLA SG., Recent trends in the microbial production, analysis and application of fructooligosaccharides. Trends Food Sci Technol 16. 2005. Págs. 442-457.
15. SUZUKI, N et al., Superiority of 1-kestose, the Smallest Fructo-oligosaccharide, to a Synthetic Mixture of Fructo-oligosaccharides in the Selective Stimulating Activity on Bifidobacteria. Bioscience and Microflora 25(3). 2006. Págs. 109-116.
16. WILLAERT RG, BACKER L y BARON G., Mass Transfer in Immnobilised Cell Systems. 1996. Págs. 32-45.
17. YOSHIKAWA J., AMACHI S, SHINOYAMA H. y FUJII T. Production of fructooligosaccharides by crude enzyme preparations of ß-fructofuranosidase, from Aureobasidium pullulans. 2008. Págs. 535-539.
18. YUN, J W., Fructooligosaccharides-Ocurrence, preparation, and application. Enzyme and Microbial Technology 19. 1996. Págs.107-117.
19. Zlokarnik, M., Scale-up in Chemical Engineering. 2002.
Recibido: Septiembre de 2010
Aprobado: Abril de 2011
MSc. Enrique R. Pérez-CruzI. Centro de Ingeniería Genética y Biotecnología, Sancti Spíritus, Cuba. enrique.perez@cigb.edu.cu