INTRODUCCIÓN
El síndrome de inmunodeficiencia adquirida (SIDA) fue reconocido por primera vez en el año 1981 y el virus de inmunodeficiencia humana (VIH) resultóidentificado como su agente etiológico en el año 1984. El VIH es un retrovirus que ataca e infecta a los linfocitos TCD4; la disminución de estos linfocitos conlleva a un grado severo de inmunodeficiencia y permite el desarrollo de enfermedades oportunistas y neoplásicas.1
La infección por VIH se ha incrementado paulatinamente a nivel mundial en los últimos años y se ha convertido en un problema de salud pública, principalmente en países en vías de desarrollo. Para el año 2014 se estimaba que en el mundo 36,9 millones de personas estaban infectadas con el VIH, el 70% pertenecía al África Subsahariana.2 Alrededor de 1,1 millón de personas en los Estados Unidos estaban infectadas con el VIH en la primera década del siglo XXI; se diagnosticaban aproximadamente 56000 casos nuevos cada año.3 Hasta el año 2014 se diagnosticaron en Cuba cerca de 20 125 casos infectados con el VIH.4 En la Provincia de Villa Clara, desde que inició la epidemia, se diagnosticaron 1 045 casos; la tasa más alta correspondió al Municipio de Santa Clara: 276,79xcada 100 000 habitantes.5
Las manifestaciones oftalmológicas son variadas, involucran tanto a los anejos como al globo ocular y se presentan entre el 50% y el 73% de los pacientes con VIH. La frecuencia de las complicaciones oftalmológicas aumenta progresivamente con la mayor supervivencia que en la actualidad ofrecen los tratamientos antirretrovirales.6,7,8,9,10
Las enfermedades oftalmológicas en los pacientes infectados con VIH son debidas a infecciones oportunistas, neoplasias, anomalías vasculares y alteraciones neurooftalmológicas y algunas están relacionadas a medicamentos específicos empleados en la terapia de estos enfermos. Las infecciones oportunistas son la mayor causa de morbilidad y ceguera en los pacientes con VIH/SIDA.8
Estudios recientes sugieren que entre un 5% y un 25% de los pacientes con VIH en los países en vía de desarrollo pueden desarrollar algún tipo de ceguera en su vida y que las enfermedades que comprometen al segmento posterior son las responsables, en su gran mayoría, de la pérdida visual que experimentan.8,9
Las manifestaciones oftalmológicas son un reflejo de enfermedad sistémica, incluso pueden ser las primeras manifestaciones de infecciones diseminadas en pacientes con SIDA.8 Debido al diagnóstico que se dio a un paciente con VIH que tuvo como primera manifestación clínica una enfermedad que le afectó el segmento posterior y le dejó una pérdida visual significativa se decidió realizar una revisión detallada y actualizada de la literatura con el objetivo de profundizar y mejorar el entendimiento sobre las alteraciones más frecuentes del segmento posterior en pacientes con VIH.
MÉTODOS
Para la actualización del conocimiento sobre las alteraciones más frecuentes del segmento posterior en pacientes con VIH se realizó una revisión de las publicaciones más relevantes relacionadas con el tema durante los últimos años. La búsqueda y la localización de la información se apoyó en la elección de palabras clave/descriptores que configuraron el perfil de búsqueda y se utilizó el MeSH Database de PubMed. Se realizó unaextensa revisión de artículos científicos en Google Académico y otros mega buscadores de revisión sistemática mediante TripDatabase y Cochrane. Se utilizaron los siguientes descriptores: retinopatía asociada al VIH, retinitis, citomegalovirus, coriorretinitis, toxoplasmosis, SIDA. La búsqueda bibliográfica incluyó libros de texto actualizados y expertos en la materia.
RESULTADOS Y DISCUSIÓN
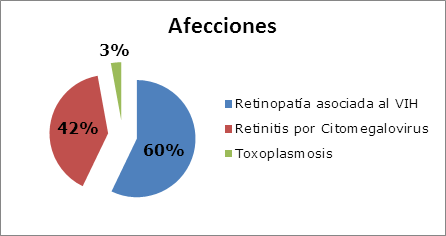
Las manifestaciones o las alteraciones del segmento posterior que suelen encontrarse en un paciente con VIH/SIDA pueden dividirse en no infecciosa: retinopatía asociada al VIH, e infecciosas: retinitis por citomegalovirus, necrosis retinal aguda, necrosis retinal externa progresiva, retinitis herpética necrotizante, toxoplasmosis ocular, pneumocistis carinii, sífilis, tuberculosis, candidiasis y criptococosis;11,12 las más frecuentes se muestran en la Figura 1.
Retinopatía asociada al VIH
Es una microvasculopatía caracterizada por la presencia de exudados algodonosos, alteraciones microvasculares y hemorragias retinales. Se debe a la deposición del complejo inmune, al aumento de la viscosidad del plasma o a la invasión del endotelio vascular por el VIH. Generalmente es asintomática, a menos que la mácula se encuentre comprometida.9,12,13,14 Se ha informado una frecuencia entre el 25% hasta el 50% en los pacientes con VIH, que se asocia a una marcada inmunosupresión y se presenta, generalmente, en pacientes con conteo de linfocitos TCD4<200 células/µl -Tabla 1-.1,15
La presencia de la retinopatía no infecciosa asociada al VIH suele indicar progresión de la enfermedad y mal pronóstico vital, con menor supervivencia en los pacientes con VIH y un fondo de ojo normal.7
Los exudados algodonosos no son patognomónicos de la retinopatía asociada al VIH, pero son el hallazgo clínico más representativo y son el resultado de micro infartos de la capa de fibras nerviosa de la retina por la disrupción del transporte axonal causado por isquemia. En los pacientes con VIH se localizan en el polo posterior, cerca de un vaso retinal y del nervio óptico (o de ambos) y pueden estar asociados a algún tipo de hemorragia retinal. No se relacionan con inflamación, células en el vítreo o fugas vasculares en la angiografía fluoresceínica.1,12
Las alteraciones microvasculares incluyen microaneurismas, telangiectasias, áreas focales de no perfusión y pérdida de capilares; todos demostrados por angiografía fluoresceínica. Las hemorragias pueden presentarse en cerca del 30% de los pacientes con VIH, están localizadas en el polo posterior y suelen ser en forma de llamas (superficiales) o redondeadas (profundas). El patrón de estas hemorragias suele modificarse con el tiempo y no parecen estar relacionadas a coagulopatías o diátesis hemorrágica. Ocasionalmente estas hemorragias presentan un área o una mancha central blanca que se nombran manchas de Roth. Esta retinopatía no requiere de tratamiento médico específico.1,12
Retinitis por citomegalovirus
Suele presentarse en personas severamente inmunocomprometidas: pacientes con SIDA o con inmunosupresión inducida por quimioterapia e inmuno-moduladores. Es la infección ocular oportunista más frecuente en pacientes con un recuento de linfocitos TCD4 inferior a 200 células/µl. Se observa aproximadamente hasta en un 40% de pacientes con VIH/SIDA y es la causa más frecuente de ceguera en estos pacientes -Tabla 2-.7,16,17
El agente etiológico es el citomegalovirus (CMV), un virus humano omnipresente de la familia de los herpesvirus. A pesar de la disminución de su incidencia en la era de los antirretrovirales de gran actividad, su importancia continúa vigente.7,18,19
El contacto sexual es una fuente importante de inoculación del CMV en hombres que tienen sexo con otros hombres, en este tipo de personas la seropositividad del CMV excede el 90%.20 El virus viaja por el torrente sanguíneo a través de monocitos y leucocitos polimorfonucleares, cuando llega a la retina infecta las células endoteliales vasculares. El virus alcanza las células gliales y del epitelio pigmentario de la retina y causa la destrucción necrótica de todas las capas retinianas. La coroides suele estar respetada, aunque puede mostrar cambios inflamatorios mínimos con infiltrado neutrofílico.21
En estadios iniciales los pacientes pueden referir escasos síntomas, que pueden ser ausentes, particularmente, si la retinitis se presenta en la periferia retinal. La visión borrosa, los flotadores, las fotopsias y las alteraciones del campo visual son los síntomas más referidos por los pacientes.11,16,20 El examen físico debe incluir biomicroscopía del segmento anterior con lámpara de hendidura, oftalmoscopía indirecta y biomicroscopía (o ambas) del segmento posterior con pupila dilatada.22
El examen de los anejos y del segmento anterior de un paciente con retinitis por CMV usualmente no revela alteraciones aunque, en algunos casos, se pueden encontrar precipitados finos retroqueráticos y una reacción leve en la cámara anterior; la reacción vítrea es típicamente despreciable.18,20 La retinitis comienza con un infiltrado retinal necrótico blanco, de bordes edematosos, asociado a hemorragias retinales; nuevos parches se esparcen a través de la retina subyacente, se unen y progresan desde la retina periférica hacia el polo posterior. La coroides raramente se encuentra afectada. En ocasiones estos infiltrados, en sus inicios y cuando son pequeños, pueden confundirse con exudados algodonosos. La historia natural de la enfermedad revela un crecimiento centrífugo implacable de las lesiones con una destrucción total de la retina en ausencia de tratamiento médico en un período que oscila entre tres y seis meses.1,12,18,20
Se han descrito tres variantes clínicas de la retinitis por CMV:1,9,12,18,19,20
Forma clásica o necrótica fulminante hemorrágica (también conocida como “retinopatía en queso y salsa de pizza”): se caracteriza por un infiltrado necrótico con edema y hemorragias subyacentes con un crecimiento hacia la retina central a lo largo del trayecto de las arcadas vasculares.
Forma granular o indolente: caracterizada por afectar a la retina periférica con un infiltrado granular oval o redondeado, con escaso o ningún edema, pocas hemorragias y escaso o ningún envainamiento vascular. La retina en la zona central se atrofia y la retinitis activa progresa lentamente hacia la frontera de la lesión.
Forma perivascular (también conocida con angeítis de rama congelada): está caracterizada por un marcado envainamiento vascular.
El nervio óptico puede encontrarse afectado hasta en un 4% de los pacientes con retinitis por CMV, sobre todo si las lesiones se encuentran en el polo posterior.18
El diagnóstico se basa en criterios clínicos por las características típicas del fondo de ojo de un paciente inmunocomprometido mediante la oftalmoscopía indirecta. La prueba de Goldmann-Witmer (niveles de anticuerpos en humor acuoso y vítreo comparados con los del suero) puede apoyar el diagnóstico en los casos difíciles y atípicos.11,23
El diagnóstico diferencial en los estadios iniciales incluye a los exudados algodonosos y en los estadios más avanzados debe ser diferenciada de otras retinitis causadas por herpesvirus o por varicela zoster (necrosis retinal aguda, necrosis retinal externa progresiva), coriorretinitis por toxoplasma, retinitis sifilítica, infecciones micóticas y linfomas intraoculares.1,11,18,20
Si el tratamiento se retrasa una pérdida visual severa e irreversible es la norma.24
Para un tratamiento exitoso de la retinitis por CMV se requiere la combinación entre el anti-CMV y la terapia antirretroviral de gran actividad, por lo que se necesita una estrecha colaboración entre el médico tratante y el Especialista en Oftalmología para conseguir la terapia más favorable. El plan terapéutico debe ser individualizado y planificado en dependencia del estado inmunológico del paciente, de las medicaciones concomitantes, de la tolerancia individual, de las preferencias personales que involucren la efectividad y riesgos del tratamiento, de las restricciones y del impacto en su calidad de vida -Tabla 3-.18,20
Mg: Milígramo; kg: kilogramo; EV: endovenoso; VO: vía oral
El tratamiento sistémico de mantenimiento se extiende hasta la total cicatrización de las lesiones y con un conteo de CD4 superior a 100 células/µl.25 La terapia sistémica se puede combinar con terapia local siempre que exista disponibilidad, es una alternativa más en el difícil manejo de estos pacientes. Se describe el uso intravítreo de ganciclovir en dosis de entre 200-2 000µg en 0,1ml o foscarnet de 2,4mg en 0,1ml dos o tres veces a la semana en la fase de inducción y una vez a la semana en la fase de mantenimiento. Otra alternativa son los dispositivos intravítreos de ganciclovir, que ofrecen la ventaja de una liberación lenta y prolongada del medicamento en la cavidad vítrea y logran altas concentraciones en el sitio de la infección. El tiempo de duración de estos dispositivos es de entre cinco a ocho meses y pueden ser retirados en caso de ser necesario.1,18,20
La pérdida visual que experimentan estos pacientes se debe, principalmente, al compromiso de la mácula y del nervio óptico y al desprendimiento regmatógeno de retina, que se presenta entre un 11% y un 35% de los ojos con retinitis por CMV y se debe a desgarros que aparecen en la unión entre la retina necrótica y la retina normal.18 La fotocoagulación con láser puede ser empleada para tratar de prevenir esta complicación.11 Una vez instaurado el desprendimiento de retina la vitrectomía pars plana con aceite de silicona como tamponador es el tratamiento de elección.1,12,18,20
La uveítis por reconstitución inmunitaria es una complicación que puede presentarse en un paciente con retinitis por CMV cuando mejoran sus estatus inmune. Una vez instaurada la terapia con antirretrovirales de gran actividad el sistema inmune comienza su recuperación, la respuesta inmune intraocular al virus trae como consecuencia una marcada reacción inflamatoria en la cámara anterior y en el vítreo. La uveítis por reconstitución inmunitaria puede presentarse entre un 15 y un 63% de los pacientes con adecuada respuesta al tratamiento y con una retinitis inactiva. La inflamación puede acompañarse de edema macular, papilitis, membrana epirretiniana y síndrome de tracción vítreo macular. El tratamiento con corticosteroides orales, perioculares o intravítreos es la regla.1,18,20,25
La práctica clínica ha confirmado la importancia que reviste el trabajo mancomunado entre los especialistas que siguen, diagnostican y tratan a personas con retinitis por CMV. Debido a que los antecedentes patológicos personales y los hallazgos clínicos en el fondo de ojo de un paciente inmunocomprometido, cualquiera que sea la causa es, en muchas ocasiones, suficiente para hacer un diagnóstico clínico oportuno y certero, que permita obtener mejores resultados en la terapia de los pacientes.
Toxoplasmosis ocular en pacientes con VIH
Los pacientes inmunocomprometidos tienen un riesgo incrementado de padecer toxoplasmosis aguda. Generalmente obedece a la reactivación de una infección crónica o a una infección reciente. Las principales formas de contagio son la congénita y la adquirida. El toxoplasma Gondii es el agente etiológico, un protozoario intracelular obligado responsable de causar la enfermedad alrededor del mundo. Los gatos son los hospederos definitivos del parásito, los humanos y una variedad de otros animales de sangre caliente son hospederos intermedios. La infección por toxoplasma en los pacientes inmunocomprometidos puede ser fulminante, con un resultado fatal si no se trata apropiadamente.25,26,27
La toxoplasmosis ocular se presenta entre un uno y hasta un 3% de los pacientes con VIH/SIDA, de ellos un cuarto responden a una infección reciente. Suele presentarse en pacientes muy inmunocomprometidos, con conteo de CD4 inferiores a 150/µl. Entre el 25 y el 40% de pacientes con VIH/SIDA y toxoplasmosis ocular van a presentar una toxoplasmosis cerebral asociada, que es la forma más frecuente de infección por toxoplasma en estos pacientes; mientras, a la inversa, entre un 10 y un 20% de pacientes con encefalitis por toxoplasma van a presentar una retinocoroiditis por toxoplasma. Por tanto, un estudio neurológico completo que incluye tomografía axial computadorizada con contraste debe realizarse en un paciente con VIH/SIDA y retinitis por toxoplasma.1,22,26,28,29,30
La retinocoroiditis por toxoplasma en pacientes con SIDA se presenta de forma atípica. La reacción inflamatoria es variable y depende del conteo de CD4 en el momento en el que se presenta la infección. Al examen del fondo de ojo se encuentran lesiones necróticas blanco amarillentas grandes, localizadas en polo posterior o en periferia, con escasas o ninguna hemorragia, con pobre vitritis asociada, incluso ausente, y frecuentemente sin relación con cicatrices coriorretinianas antiguas. En ocasiones se observan lesiones múltiples y bilaterales. Los precipitados retroqueráticos, el flare y la celularidad en el humor acuoso pueden ser leves o estar ausentes.1,11,26
En ocasiones la retinocoroiditis por toxoplasma en pacientes con SIDA puede tener un curso devastador y extenderse a la esclera e, incluso, a la órbita.26
Los estudios serológicos de IGG suelen ser típicamente positivos en pacientes en los que el diagnóstico no esté totalmente claro, puede indicarse una reacción en cadena de la polimerasa en humor acuoso y vítreo.25,26,30,31
Los diagnósticos diferenciales más importantes son la necrosis retinal aguda, retinitis por sífilis, la retinitis por CMV, la necrosis retinal externa progresiva y la coriorretinitis/endoftalmitis fúngica.1,26 La forma de presentación atípica de la retinocoroiditis por toxoplasma en un paciente con SIDA puede ser un reto diagnóstico para el Especialista en Oftalmología especializado en retina, más cuando no se cuente con los medios diagnósticos necesarios para definir estos casos. Se debe pensar en esta enfermedad para poder diagnosticarla, incluso, como primera manifestación de un paciente con un VIH no detectado previamente.
El tratamiento de elección es la pirimetamina de 25mg, de 75 a 100mg, en dosis de ataque seguido de 50mg en dos tomas diarias asociadas a sulfadiacina de 500mg, de cuatro a seis gramos diarios en cuatro dosis durante seis semanas. El sulfaprim de 480mg, dos tabletas cada 12 horas, es una alternativa si existe alergia a alguna de las drogas anteriores. La doxiciclina de 100mg, una tableta cada 12 horas, o la clindamicina de 300mg, una tableta cuatro veces al día por cuatro semanas, asociadas o no a la pirimetamina, y la azitromicina de 500mg, un gramo diario por tres semanas, asociada o no al sulfaprim, pueden manejarse como otras opciones. Los esteroides deben indicarse 48 horas después de comenzado el tratamiento antibiótico y cuando existen pocos o ningún signo inflamatorio no son necesarios. Se debe indicar ácido folínico de 5mg dos o tres veces por semana mientras se use la pirimetamina por el efecto supresor de la médula ósea que esta provoca, con estudio hematológico mensual mientras dure el esquema. Se debe indicar un tratamiento de mantenimiento con sulfadiacina, dos gramos, dos o tres veces por semana, o sulfaprim, dos tabletas tres veces por semana durante seis meses. En pacientes con antirretrovirales de alta eficacia y conteo de CD4>250/µl puede descontinuarse el tratamiento.11,31
CONCLUSIONES
Las alteraciones del segmento posterior se pueden presentar en un número considerable de pacientes con VIH/SIDA, incluso pueden ser la primera manifestación clínica de la enfermedad. La retinopatía asociada al VIH (no infecciosa) es la más representativa. La retinitis por CMV es la infección ocular oportunista más frecuente en pacientes con recuentos muy bajos de linfocitos TCD4. Puede observarse casi en la mitad de personas con VIH/SIDA y es la causa más común de ceguera en estos pacientes. La forma de presentación atípica de la coriorretinitis por toxoplasma debe ser tenida en cuenta aunque no sea tan frecuente como las anteriores, pensarse en ella para hacer el diagnóstico y realizar estudio neurológico completo por su asociación con la toxoplasmosis cerebral en pacientes con SIDA. Los conteos bajos de linfocitos TCD4 son el denominador común de las alteraciones del segmento posterior en los pacientes inmunocomprometidos