Introducción
En lactantes y niños menores de 15 años los tumores cerebrales son la segunda forma más común de cáncer, precedidos de la leucemia. En adultos representan 2 % de todos los tumores malignos diagnosticados en el hombre. En Estados Unidos se diagnostican 6 por cada 100.000 individuos.1,2,3,4 En Cuba a pesar que los tumores malignos del sistema nervioso central (SNS) no se encuentran entre las primeras causas de muerte por cáncer, en el año 2017, fallecieron por esta causa 626 individuos, lo que representó 2,5 % de las muertes por enfermedades malignas.2,5,6,7
Los gliomas malignos (GM) son los tumores cerebrales primarios más frecuentes del adulto. Constituyen entre 50 % a 70 % de los tumores primarios del SNC. Los tipos histopatológicos glioblastoma multiforme (GBM), astrocitoma anaplásico (AA) y oligodendroglioma anaplásico (OA) se diagnostican con mayor frecuencia 1)(3)(4)(7)(8)(23 Los tumores de la fosa posterior y de áreas paraselares aparecen con mayor frecuencia en la infancia y adultos jóvenes, mientras que en el adulto predominan los tumores supratentoriales.3,4,8,9
A diferencia de la mayoría de neoplasias sólidas, Los GM evolucionan de manera particular. Son tumores con una alta tasa de recidiva local tras el tratamiento quirúrgico que habitualmente se complementa con radioterapia y quimioterapia, con posterior progresión de la enfermedad a nivel local, lo que acaba causando la muerte del paciente con una mediana de sobrevida de 9 a 12 meses. Estas lesiones son generalmente incurables, y dentro de los primeros 2 años después del diagnóstico, 90 % de los pacientes ha fallecido 3,4,10
La Organización Mundial de la Salud define cuatro categorías de astrocitomas de acuerdo a las características histológicas como grado de diferenciación, presencia de necrosis y proliferación vascular.11,12
Uno de los primero eventos en el desarrollo de un glioma es aumento en la expresión de factores de crecimiento, de sus receptores o de ambos. La amplificación del gen EGFR promueve el crecimiento celular, la migración y la sobrevivencia celular.5,12,13 La habilidad de las células tumorales para generar estas formas mutantes funcionales de EGFR puede contribuir a la capacidad de los gliomas para evadir la quimioterapia y aumenta la complejidad para diseñar estrategias terapéuticas contra el EGF.12,14,15
El tratamiento principal de los glioblastomas y de los astrocitomas anaplásicos ha sido, y continúa siendo, la mayor resección quirúrgica posible del tumor, documentada mediante resonancia magnética nuclear (RMN) dentro de las 72 h de la cirugía.14 El tratamiento adyuvante con radioterapia asociado a quimioterapia, basada en compuestos alquilantes como la carmustina (BCNU) o la temozolomida (TMZ) han demostrado que pueden incrementar la supervivencia.4,11,13,15,16 El tratamiento con inhibidores de angiogénesis como el anticuerpo monoclonal dirigido contra el receptor del factor de crecimiento epidérmico (EGFR) fue aprobado en 2009 para el tratamiento de GB recurrentes tras encontrarse altas tasas de respuesta de supervivencia libre de progresión.4 La inmunoterapia pasiva con anticuerpos monoclonales (AcM) es de las más efectivas contra el EGFR. Actualmente existen varios AcM contra ese receptor registrados para el tratamiento de algunos tumores sólidos epiteliales: Cetuximab® (AcM quimérico), nimotuzumab (AcM humanizado) y Panitumumab® (AcM humano).6,16,17
Nimotuzumab es un AcM humanizado, inmunoglobina de isotipo IgG1, obtenido por tecnología de ADN recombinante y producido en líneas de células de mamífero (mieloma murino NSO). Reconoce al EGFR con una afinidad intermedia de 10-9 M, contiene las regiones hipervariables (CDR) de origen murino (ior egf/r3) y los marcos de las regiones variables y de las regiones constantes de las cadenas pesada y ligera de origen humano.6 La expectativa de vida niños con tumores cerebrales recurrentes, refractarios a tratamientos a la cirugía, la radioterapia y la quimioterapia, es de un mes aproximadamente. Un primer ensayo (fase II/III) en Cuba evaluó la combinación de nimotuzumab y radioterapia. La supervivencia global, 44,5 meses, fue significativamente superior en el grupo experimental, en comparación con 30,4 meses en el grupo control, que solo recibió radioterapia.6,18
El objetivo de esta investigación fue presentar caso clínico de un paciente con diagnóstico de astrocitoma anaplásico y tratamiento oncoespecífico concurrente con Nimotuzumab.
Presentación de caso
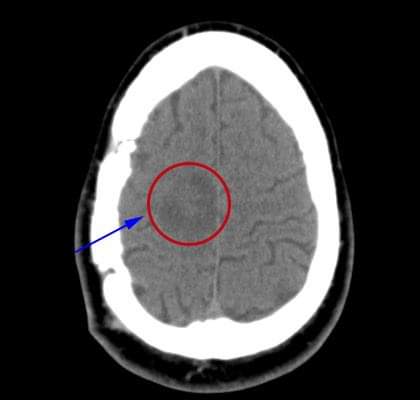
Paciente masculino de 31 años de edad, con antecedentes de salud. En marzo de 2015 comienza a presentar cuadros convulsivos a repetición y disminución de la fuerza muscular del hemicuerpo izquierdo. Es estudiado radiológicamente y se detecta lesión de aspecto tumoral en ventana medial del lóbulo parietal derecho (fig. 1).
Es intervenido quirúrgicamente, se realiza resección incompleta del tumor superior al 70 % con resultado de tumor maligno de alto grado.
Biopsia: Astrocitoma cerebral anaplásico Grado III de la OMS.
Se decide tratamiento radiante adyuvante, el cual es rechazado por el paciente. Se discute en colectivo médico y se propone tratamiento con Nimotuzumab como monoterapia con intensión paliativa.
La fase de inducción fue con nimotuzumab (bulbos 50 mg) 4 bulbos, diluidos en solución salina 09 % 300 mL, vía endovenosa, semanal, por 6 semanas. La fase de mantenimiento: Nimotuzumab (Bulbos 50 mg) 400 mg diluidos en solución salina 09 %, 300 mL, vía endovenosa, quincenal, por 10 dosis; Nimotuzumab (Bulbos 50 mg) 400 mg diluidos en solución salina 09 %, 300 mL, vía endovenosa, mensual, hasta la progresión.
El paciente se mantiene asintomático, con buen estado general y neurológicamente estable hasta enero de 2018 que comienza presentar crisis convulsivas por lo que es evaluado por servicio de neurocirugía del Hospital General Docente Miguel Enríquez y se detecta crecimiento de la lesión tumoral y se propone realizar tratamiento radiante (fig. 2).
Se decide tratamiento con radiaciones ionizantes con acelerador lineal. Se planifica DTT: 60 Gy. (Dosis tumor total), DTD: 2 Gy (Dosis tumor diaria) y fracciones: 30 sesiones.
Paciente que completa el tratamiento planificado sin reacciones adversas. Buen estado general, ligera disminución de la fuerza muscular del hemicuerpo izquierdo y control de las crisis convulsivas (fig. 3).
Se mantiene con Nimotuzumab. Cuatro meses después comienza a presentar signos de hipertensión endocraneána por edema cerebral con deterioro de las funciones neurológica por lo que es reintervenido quirúrgicamente para derivación. Es dado de alta hospitalaria con hemiplejia total y completa del lado derecho. Dos meses comienza nuevamente con deterioro marcado de las funciones neurológicas y fallece en junio de 2018.
Discusión
El glioblastoma multiforme y el astrocitoma anaplásico son los tumores cerebrales primarios más frecuentes del adulto, de muy mal pronóstico, y con un rápido crecimiento. Según la clasificación de la OMS son considerados tumores de alto grado de malignidad. Las series de casos reportados a nivel mundial estiman que la mediana de supervivencia de estos pacientes es solo de 12-15 meses, con una supervivencia media a los cinco años inferior al 5 % a pesar del tratamiento combinado agresivo.9) (10) (11,19 Debido a su carácter infiltrante, los tumores del SNC de alto grado, después de cirugías radicales y altas dosis de radioquimioterapia, desarrollan la recidiva tumoral en 60-90 % de los casos.9,20 El paciente se mantuvo estable clínicamente por un periodo de 3 años (39 meses) a pesar de no realizarse una resección completa del tumor y no recibir tratamiento radiante complementario después de la primera cirugía como está establecido en las guías de tratamiento de esta entidad. Solo recibió tratamiento inmunológico con nimotuzumab. Se comprobó que la adición de este monoclonal no exacerba la toxicidad de las otras terapias usadas.
La biología de los gliomas malignos se asocia con el balance de la expresión de las proteínas que controlan de manera positiva o negativa el ciclo celular, la proliferación, la motilidad, la neoformación vascular y el reconocimiento del sistema inmune.21,22,23 Estudios moleculares a nivel mundial han identificado alteraciones de p53 y amplificaciones de EGFR en los pacientes con astrocitomas de alto grado. La inmunoterapia pasiva con AcM es de las más efectivas contra el EGFR.6) (21
Nimotuzumab es un AcM humanizado, inmunoglobina de isotipo IgG1, obtenido por tecnología de ADN recombinante registrado por el Centro de Inmunología Molecular de la Habana para tumores malignos epiteliales de cabeza y cuello y tumores de alto grado de sistema nervioso central, tiene propiedades antiangiogénica, antiproliferativa y pro-apoptótica.24 El anticuerpo humanizado es capaz de reconocer al receptor con afinidad similar a sus ligandos (10-9M), se une al dominio extracelular del receptor del EGF-R con alta afinidad e inhibe fuertemente la vía de señalización asociada a este receptor.25
El anticuerpo monoclonal (AcM) humanizado Nimotuzumab (TheraCIM/ h-R3), al igual que el Cetuximab, es un anticuerpo específico contra el dominio extracelular del EGFR.25 Se distingue por su excelente perfil de toxicidad sobre otros monoclonales que tienen como diana terapéutica el receptor del Factor de crecimiento epidérmico (EGFR). El TheraCIM tiene una afinidad intermedia y es más sensible a unirse a aquellas células de mayor densidad de EGFR, como las células tumorales, que en las células con expresión de EGFR normal, presentes en tejidos epiteliales conservados.6 La expectativa de vida en pacientes pediátricos portadores de tumores cerebrales recurrentes, refractarios a tratamientos convencionales como la cirugía, la irradiación y la quimioterapia, es de un mes aproximadamente. Además de su mal pronóstico, no existe un estándar de tratamiento para esta afección.6,22
Este anticuerpo ha demostrado un incremento en la sobrevida de los pacientes tratados concurrente con radioterapia después de una cirugía oncológica. Al igual que el cetuximab, el nimotuzumab ha mostrado un potente efecto antitumoral, tanto in vitro como en modelos preclínicos, basado en sus capacidades antiproliferativas, antiangiogénicas y proapoptóticas.
El nimotuzumab es un novedoso AcM humanizado con efecto antitumoral que trasciende por el aumento de la supervivencia de los pacientes con tumores gliales malignos, demostrado por estudios controlados y en la práctica médica. Su perfil de seguridad supera los de otros anticuerpos monoclonales anti-EGFR por la aparición de escasas reacciones secundarias, lo cual favorece su uso combinado con otras terapias convencionales.