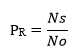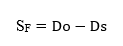Introducción
A pesar de que, en Cuba, después de 1959, las cifras de fiebres entéricas y de gastroenteritis disminuyeron considerablemente, 1,2la vigilancia sanitaria de la presencia de salmonelas en los alimentos es una actividad regulada en el país. (3
Se conocen diferentes metodologías para el aislamiento e identificación de Salmonella en alimentos, estas técnicas son laboriosas y requieren de una gran variedad de medios de cultivo para aumentar la sensibilidad diagnóstica. 4
El actual Reglamento Europeo, 5 relativo a los criterios microbiológicos aplicables a los productos alimenticios, prevé que las empresas alimentarias puedan utilizar otros métodos de diagnóstico diferentes a los de referencia, siempre que los resultados entre ellos sean equivalentes y que el método alternativo haya sido validado. Gracias a ello, se han desarrollado diferentes sistemas comerciales y técnicas moleculares, de tipificación e inmunológicas para aumentar la sensibilidad y la rapidez en la identificación, 4 que por su elevado costo, no son factibles en muchos laboratorios de análisis de rutina. La incorporación de los medios cromogénicos y fluorogénicos a las técnicas microbiológicas, ha constituido una alternativa económica pues su uso mostró un grupo de ventajas, entre ellas una disminución significativa de tiempo, 6 aspecto relevante para el diagnóstico en salud e imprescindible para la liberación rápida de los productos alimenticios. El aseguramiento y el control de la calidad de estos nuevos medios de cultivo, es esencial para garantizar la calidad y confiabilidad de los resultados de los análisis en el que se utilizan. 7-9
En Cuba, se desarrolló por primera vez, en el Centro Nacional de Biopreparados (BioCen), CromoCen® SALM, medio de cultivo selectivo cromogénico y fluorogénico para la detección de Salmonella en alimentos de consumo humano y animal, 3 que debe de cumplir con un grupo de requisitos de desempeño diagnóstico y de rendimiento para garantizar resultados precisos y confiables en los análisis. 7-9 El método que emplea el medio de cultivo CromoCen® SALM fue validado según los requerimientos de la norma ISO 16140 10 y se adoptó su uso en norma cubana NC 1270: Microbiología de alimentos de consumo humano y animal-Guía general para la detección de Salmonella-Método cromogénico y fluorogénico de rutina. 3
La norma ISO 11133:2014/Amd.1:201811,12 está destinada a los medios de cultivo que se emplean en el análisis microbiológico de alimentos para consumo humano, alimentación animal y agua. Es de obligatorio cumplimiento, tanto para las entidades que los producen y distribuyen, como para los laboratorios microbiológicos que usan estos medios de cultivo. En la norma se establecen criterios mínimos y métodos para evaluar el rendimiento de los medios de cultivo para garantizar productos de calidad y reducir el trabajo en los laboratorios.
El objetivo del estudio consistió en evaluar los criterios de control de la calidad y de rendimiento del medio de cultivo CromoCen® SALM, establecidos en la norma ISO 11133:2014/Amd.1:2018, para demostrar su fiabilidad para el análisis microbiológico de los alimentos para el consumo humano.
Métodos
Se produjeron tres lotes del medio cromogénico y fluorogénico CromoCen® SALM (5011000, 5021000 y 5031000) en la Planta de Producción de Medios de Cultivo de BioCen. Para ello, se tuvieron en cuenta las Buenas Prácticas de Fabricación de Diagnosticadores 13,14) y la norma ISO 9001:2015 15, ambas adoptadas por el Sistema de Gestión de la Calidad de la Institución. Como parte de la verificación de la calidad del producto terminado y para demostrar su rendimiento, se realizaron análisis de consistencia entre los lotes, evaluando sus indicadores físico-químicos de calidad, los ensayos de productividad, selectividad y de electividad. Los ensayos se ejecutaron a los diferentes lotes, por duplicado y por analistas diferentes, manteniendo las condiciones de reproducibilidad intra-laboratorio.11,12
Análisis de la calidad físico-químico
Se definió un conjunto de indicadores que caracterizan la calidad del producto como: color y apariencia del polvo, del medio de cultivo preparado y la homogeneidad del polvo. Además, se determinó el contenido de humedad del polvo por el método gravimétrico y el valor del pH por el método potenciométrico detallado en la Farmacopea de los Estados Unidos.16)
Ensayos de rendimiento microbiológico
El medio de cultivo se preparó según las instrucciones señaladas en el prospecto del producto y se distribuyó en cantidad de 20 mL en placas de Petri estériles de 94 × 16 mm (Greiner Bio-one, Alemania), en una superficie plana y nivelada.
La determinación de la relación de productividad se realizó por el método cuantitativo (por ser un nuevo medio el que se evalúa), para obtener un resultado más fiable. Para el ensayo se utilizaron dos cepas microbianas de colección, procedentes del cepario central de BioCen: Salmonella enterica subsp. enterica ser. Typhimurium WDCM 00031 (una de las cepas recomendadas para los ensayos de los medios de cultivo que se utilizan en el análisis microbiológico de los alimentos) y Salmonella enterica subsp. enterica ser. Typhi ATCC 19430 (inclusión de un serovar diferente por el diseño y la funcionalidad del medio de cultivo que se evalúa). A partir de un cultivo puro en agar triptona soya de la cepa seleccionada se estandarizó una suspensión microbiana en un espectrofotómetro (GENESYS 10S UV-VIS, Thermo Scientific) hasta una concentración de 0,25 DO550nm, equivalente a 3 × 108 ufc/mL, aproximadamente. Se prepararon diluciones seriadas, de 1 mL en 9 mL de solución salina estéril al 0,85 % p/p, hasta una concentración microbiana teórica de 300 ufc/mL.
Para calcular la productividad por el método cuantitativo se inocularon las dos últimas diluciones en las placas preparadas de CromoCen® SALM, por el método de siembra por inundación de la superficie. En paralelo y como referencia se utilizó el medio de cultivo agar triptona soya (BioCen, Cuba), el cual se evaluó previamente resultando todos sus parámetros de calidad conformes con la ISO 11133:2014/Amd.1:2018. Los medios de cultivo se incubaron a (35 ± 1)°C por (24 ± 3) h. El experimento, para las muestras de un mismo lote, se realizó ensayando las muestras por duplicado. Se consideraron para el cálculo, las placas en las que se obtuvo un recuento de (100 ± 20) ufc/placa y se evaluó visualmente la reacción característica de cada cepa en el medio de cultivo.
El cálculo de la relación de productividad (PR) se ejecutó según la fórmula: 11,12
donde:
Ns: |
promedio de ufc obtenidas en la superficie de la placa de CromoCen® SALM |
No: |
promedio de ufc obtenidas en la superficie de la placa de agar triptona soya |
Además, se realizó un diagrama de control a partir de los valores de relación de productividad obtenidos con Salmonella ser. Typhimurium WDCM 00031 en los tres primeros lotes de CromoCen® SALM. El diagrama de control se realizó según lo referido en el Anexo G de la norma ISO 11133:2014/Amd.1:2018. 11,12
Se reporta la media de tres réplicas y el intervalo de confianza por indicador evaluado.
Se analizó si existían diferencias significativas entre los valores de relación de productividad obtenidos para cada lote con la prueba de Tukey para un 95 % de confianza con la utilización del paquete estadístico “Stadistica8” (StatSoft, Inc., EE.UU., 2008).
Se empleó un cultivo puro de Enterococcus faecalis WDCM00009 para el cálculo del factor de selectividad. La cepa se estandarizó a 0,125 DO550nm (1,50 × 108 ufc/mL) en solución salina estéril al 0,85 % (p/p) con ayuda de un espectrofotómetro. A partir de la suspensión se prepararon diluciones decimales seriadas hasta 10-4 y se inoculó con las dos últimas diluciones por el método de siembra por inundación de la superficie tanto en CromoCen® SALM como en agar triptona soya. Todos los medios se incubaron a (35 ± 1)°C por (24 ± 3) h.
El valor del factor de selectividad (SF), se calculó con la siguiente fórmula: 11,12
donde:
Do: |
es la dilución mayor que muestra crecimiento en el medio agar triptona soya expresada en unidades log10 |
Ds: |
es la dilución mayor que muestra crecimiento comparable en CromoCen® SALM expresada en unidades log10 |
Para la electividad se seleccionaron siete cepas microbianas, no diana, de diferentes géneros de bacterias Gram negativas que crecen en el medio de cultivo y que pueden ser posibles interferentes al realizar el análisis de las muestras: Aeromonas hydrophila WDCM00063, Citrobacter freundii ATCC 8090, Escherichia coli WDCM 00013, Proteus mirabilis ATCC 12453, Pseudomonas aeruginosa WDCM 00025, Serratia marcescens ATCC 13880 y Shigella sonnei ATCC 25931. Previamente se comprobó que estas cepas no presentaban las mismas características morfológicas que los microorganismos diana en los medios. A partir de un cultivo puro de cada cepa, proveniente de agar triptona soya, incubado por (24 ± 3) h, se obtuvieron suspensiones microbianas en solución salina estéril al 0,85 % (p/p). Su concentración microbiana se ajustó, con ayuda de un espectrofotómetro, a 0,3 DO550 nm, correspondiente a una concentración aproximada de 3 × 108 ufc/mL. Se prepararon diluciones decimales seriadas hasta 104 ufc/mL, para inocular el medio de cultivo preparado por el método de siembra por estría hasta el agotamiento del inóculo en la superficie. Se incubó a (35 ± 1)°C por (24 ± 3) h.
Se determinó la capacidad del medio de cultivo para lograr la diferenciación de los géneros microbianos de acuerdo a las características culturales (color y morfología) de las colonias aisladas, así como, la presencia o no de fluorescencia azul bajo luz ultravioleta (longitud de onda de 366 nm), producto de la degradación de un sustrato fluorogénico que se encuentra en la formulación del medio de cultivo.
Resultados
La evaluación físico-química mostró que el medio CromoCen® SALM en polvo posee un color beige rosado, homogéneo, fluido sin grumos y sin partículas extrañas en los tres lotes ensayados, sin diferencias entre ellos. El medio de cultivo restituido mostró un color rosado-rojizo y opalescente con un precipitado característico del componente insoluble del medio.
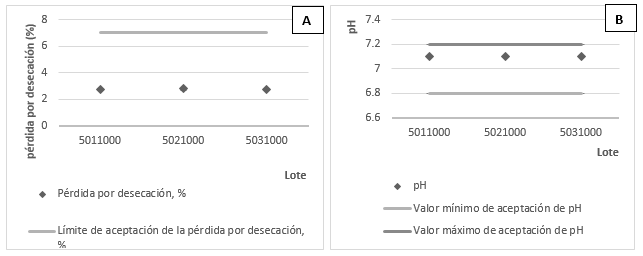
Los valores de los indicadores del contenido de humedad y del pH de cada lote de medio de cultivo se presentan en la figura 1. El valor del contenido de humedad fue de 2,68% ± 0,10 (lote: 5011000); 2,82% ± 0,11 (lote: 5021000) y 2,69% ± 0,07 (lote: 5031000), mientras que el valor de pH coincidió en los tres lotes (7,1 ± 0,01) y se encontró en el intervalo entre 6,8 y 7,2; definido en las especificaciones para este producto.
Se evidenció una capacidad de recuperación de CromoCen® SALM con respecto al agar triptona soya expresada como la relación de productividad superior al 50 % (Tabla 1). La prueba de Tukey aplicada al análisis comparativo de los resultados evidenció que no existieron diferencias significativas para la relación de productividad entre los lotes evaluados de ambos medios de cultivo.
El serotipo Salmonella ser. Typhi mostró colonias de color verde-grisáceo con centro oscuro y un ligero cambio en el color del medio de cultivo alrededor de la colonia a amarillo-naranja, mientras que Salmonella ser. Typhimurium se distinguió por el desarrollo de colonias de color violeta intenso con centro negro y bordes más claros.
Tabla 1 Relación de productividad de CromoCen® SALM
| Cepa microbiana | Medio de cultivo (Lote) |
Promedio de ufc/placa/ [95% IC] (n=3) |
PR |
|---|---|---|---|
|
|
CromoCen® SALM (5011000) |
109/8,02 | 0,95 |
|
CromoCen® SALM (5011000’) |
118/1,73 | ||
| Agar triptona soya | 120/0,71 | ||
|
CromoCen® SALM (5021000) |
109/3,51 | 0,98 | |
|
CromoCen® SALM (5021000’) |
109/6,56 | ||
| Agar triptona soya | 111/14,85 | ||
|
CromoCen® SALM (5031000) |
107/11,27 | 0,99 | |
|
CromoCen® SALM (5031000’) |
113/7,64 | ||
| Agar triptona soya | 111/12,73 | ||
|
|
CromoCen® SALM (5011000) |
96/2,89 | 0,97 |
|
CromoCen® SALM (5011000’) |
104/13,00 | ||
| Agar triptona soya | 103/12,02 | ||
|
CromoCen® SALM (5021000) |
92/10,58 | 0,98 | |
|
CromoCen® SALM (5021000’) |
100/8,50 | ||
| Agar triptona soya | 97/4,24 | ||
|
CromoCen® SALM (5031000) |
88/3,51 | 1,00 | |
|
CromoCen® SALM (5031000’) |
94/12,53 | ||
| Agar triptona soya | 91/2,83 |
IC: intervalo de confianza; PR: productividad relativa; ’: duplicado del lote; n: cantidad de placas promediadas por cada lote
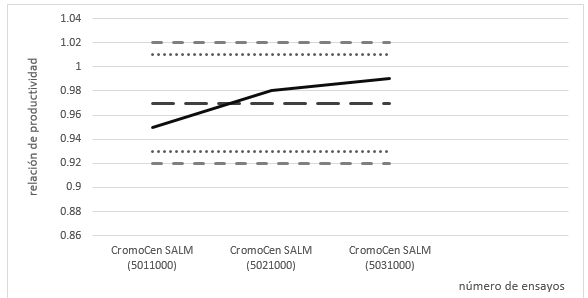
El diagrama de control obtenido a partir de los valores de la relación de productividad para Salmonella ser. Typhimurium WDCM 00031 en los tres primeros lotes de CromoCen® SALM se muestra en la figura 2. No se observaron diferencias significativas entre los valores de relación de productividad de los lotes evaluados al aplicar la prueba de Tukey.
Para CromoCen® SALM al evaluar E. faecalis, (microorganismo que debe resultar inhibido), y analizar la mayor dilución expresada en unidades de log10 que muestra crecimiento, se obtuvo un valor igual a 0, evidenciando la inhibición total del crecimiento de este microorganismo a la concentración del inóculo de partida (1,50 × 108 ufc/mL). Por otro lado, en agar triptona soya, se observó un crecimiento abundante (≥ 300 ufc) en las dos diluciones inoculadas, obteniéndose un valor de 4. Según la fórmula referida anteriormente el factor de selectividad resultó igual a 4.
En el medio de cultivo cromogénico y fluorogénico CromoCen® SALM se pudieron diferenciar un grupo de microorganismos Gram negativos de Salmonella por el desarrollo de colores diferentes a este microorganismo diana. C. freundii mostró una coloración rosada intensa con centro negro y bordes más claros de las colonias, E. coli manifestó una coloración verde y A. hydrophila, S. sonnei, S. marcescens, P. aeruginosa y P. mirabilis se distinguieron por un color rosado claro. Todos los géneros microbianos desarrollaron una fluorescencia azul bajo luz ultravioleta de 366 nm, excepto P. aeruginosa cuya fluorescencia resultó de color verde. P. mirabilis no desarrolló fluorescencia.
Discusión
La coincidencia en los resultados de la apariencia, color y homogeneidad del polvo de los diferentes lotes del medio de cultivo CromoCen® SALM demuestran la adecuada consistencia del proceso de producción del diagnosticador.
La apariencia opalescente del medio de cultivo terminado proporciona un adecuado contraste entre los diferentes colores de las colonias en el medio de cultivo 17,18. Esta característica es utilizada por otros fabricantes de medios comerciales como Oxoid, para el diseño de sus composiciones y facilita la identificación del microorganismo diana y su diferenciación con el resto de los microorganismos Gram negativos.
Los valores del contenido de humedad y del pH evidencian reproducibilidad entre los lotes fabricados y resultados satisfactorios. El contenido de humedad resultó inferior a 7%, requisito de calidad definido para este tipo de producto para asegurar, durante el tiempo de almacenamiento, una estabilidad adecuada, 19 evitando la interacción química entre componentes y su degradación. Este es un parámetro crítico que tiene efecto sobre la vida útil del producto. Los valores de pH de CromoCen® SALM se encontraron cercanos a la neutralidad (6,5 a 7,5), según requisitos de calidad del medio de cultivo y en los límites permitidos (6,8 a 7,2). Esta característica es favorable para el desarrollo de Salmonella teniendo en cuenta que se enmarca en el rango de pH óptimo para su crecimiento.
Los requisitos de la norma ISO 11133:2014, (11, 12) exigen que las composiciones de los medios de cultivo selectivos cromogénicos y fluorogénicos cumplan con el criterio de mostrar una relación de productividad cuantitativa mayor o igual a 0,50; apariencia, tamaño y morfología de colonias típicas y factor de selectividad de 2 como mínimo.
La elevada recuperación de los microorganismos diana en el medio de cultivo, expresada como una relación de productividad superior a 0,95 en CromoCen® SALM, puede estar relacionada con el uso en la formulación de bases nutritivas producidas en la planta de Medios de Cultivo del Centro Nacional de Biopreparados, a partir de procesos propios de obtención 20-22. Estas bases nutritivas propias contienen alto porcentaje de nitrógeno amínico y nitrógeno total, lo que garantiza el contenido de compuestos nitrogenados de naturaleza proteica, imprescindibles para el desarrollo de los microorganismos. También contienen macro-, microelementos y vitaminas y una baja concentración de iones Cl- y de plomo. Estos elementos favorecen el crecimiento de los microorganismos, la activación de enzimas y la síntesis de compuestos esenciales. Además, altas concentraciones de cloruro de sodio romperían el equilibrio osmótico entre la célula y el medio y el plomo es un elemento tóxico para la célula. 19,23
Se obtuvieron altos valores de la relación de productividad con el cultivo de Salmonella ser. Typhi, a pesar de que este serotipo se caracteriza por un metabolismo más lento que los otros serotipos que se clasifican dentro del género. 24
La mezcla de bases nutritivas de diferentes orígenes y su concentración en relación con las sales biliares como inhibidor de crecimiento de bacterias Gram positivas que se incluyen en CromoCen® SALM, resulta una combinación eficaz para favorecer la recuperación Salmonella. 25
La alta recuperación Salmonella podría garantizar la detección de estas bacterias cuando se encuentren en bajas concentraciones en las muestras, aspecto fundamental en su detección, ya que se reporta que pocas cantidades de estos microorganismos en un alimento son suficientes para provocar síntomas clínicos en humanos. 26
Con ayuda del diagrama de control se demostró que los lotes sucesivos producidos de CromoCen® SALM no manifestaron ninguna desviación de calidad, evidenciándose una producción estable y consistente del producto. Resta por confeccionar nuevamente el diagrama de control, una vez que se disponga de nuevos datos de relación de productividad de Salmonella ser. Typhimurium para 10 lotes consecutivos producidos, tal como recoge la ISO 11133:2014/Amd.1:2018.
Los medios de cultivo cromogénicos para Salmonella utilizan sustancias inhibidoras 24) o mezclas de estas, 6 para deprimir el crecimiento de otros géneros microbianos que pudieran coexistir en la misma muestra y que ejercen competencia por los nutrientes impidiendo la detección de los microorganismos diana. CromoCen® SALM contiene en su formulación sales biliares, sustancia que impidió totalmente el crecimiento de E. faecalis, bacteria Gram positiva utilizada en el ensayo de calidad. Como se reporta que esta sustancia puede causar daño en el ADN, proteínas y membrana celular de un gran número de bacterias pero que no afecta el crecimiento de Salmonella porque esta posee una variedad de genes y mecanismos de resistencia a este compuesto, 27 la respuesta es esperada y demuestra la adecuada selección de componentes en el lote.
El control de calidad reflejó la capacidad que tiene el medio de cultivo para detectar los serotipos de mayor interés clínico y sanitario, como son Salmonella ser. Typhimurium y Salmonella ser. Typhi, por las características morfológicas que desarrollan las bacterias en el mismo. Contar con un diagnosticador cromogénico y fluorogénico, capaz de detectar una amplia variedad de serotipos del género Salmonella, incluyendo a aquellos serotipos con un comportamiento bioquímico “atípico” 17 con un adecuado rendimiento, tiene un gran impacto social y económico, ya que se reconoce que Salmonella es uno de los agentes causantes de las enfermedades transmitidas por alimentos a nivel mundial 28 y en Cuba 29. Los serotipos más comunes aislados de alimentos son Salmonella ser. Typhimurium y Salmonella ser. Enteritidis, pero la aparición de una variedad de serotipos y de cepas resistentes a los antibióticos aumenta notablemente a nivel mundial 30) y en nuestro país 31.
Además, CromoCen® SALM es capaz de diferenciar los microorganismos diana de un grupo de microorganismos que son comúnmente microbiota acompañante en la muestra que se analiza. Estos microorganismos se detectan, en ocasiones, como falsos positivos disminuyendo los valores de especificidad de la técnica, encontrándose entre ellos: Citrobacter,32Escherichia coli,33Aeromonas34 y Pseudomonas. (33,34 Estos géneros se analizaron en el medio de cultivo y pueden ser fácilmente diferenciados.
Se puede aseverar que el medio de cultivo CromoCen® SALM cumple los requisitos de calidad establecidos para los medios cromogénicos-fluorogénicos selectivo y diferencial, según la norma ISO 1133 vigente. La correcta formulación de los lotes del medio, así como el cumplimiento de los requisitos de calidad en los procesos de preparación garantizan la adecuada funcionalidad del medio para la detección de Salmonella en muestras de alimentos. Los altos valores de productividad, sus adecuadas selectividad y electividad lo hacen un medio apropiado y confiable para la detección de Salmonella de importancia sanitaria y clínica.