Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión impresa ISSN 0034-7515
Rev Cubana Farm vol.46 no.4 Ciudad de la Habana oct.-dic. 2012
PRODUCTO NATURAL
Estabilidad en anaquel de un gel de Rhizophora mangle L. (mangle rojo) para heridas y quemaduras
Long-term stability of a Rhizophora mangle L. (red mangrove) gel for wounds and burns
Dra. Cs. Dulce María Soler Roger,I Lic. Yanet Rodríguez Perdomo,I Dra. Cs. Tania Pérez Bueno,I MSc. Yamilka Riverón Alemán,I Lic. Iván Gastón Morales LacarrereII
I Centro Nacional de Sanidad Agropecuaria (CENSA). Mayabeque, Cuba.
II Centro de Investigación y Desarrollo de Medicamentos (CIDEM). La Habana, Cuba.
RESUMEN
Objetivo: evaluar la estabilidad en anaquel de un gel elaborado a partir del extracto acuoso de la corteza de Rhizophora mangle L. (mangle rojo).
Métodos: los tres lotes pilotos del gel (GM01, GM02 y GM03) se almacenaron a temperatura de refrigeración (5 ± 3 °C) durante 12 meses. Se realizó una evaluación físico-química y microbiológica a tiempo inicial y a los 3, 6, 9 y 12 meses.
Resultados: todos los lotes mantuvieron una apariencia de geles homogéneos, viscosos, libres de grumo, brillantes y de un color pardo-rojizo oscuro y mostraron amplias áreas de extensibilidad. El pH estuvo entre 6 y 7 y la reología fue característica de un fluido no newtoniano del tipo Herschel Bulkley con potencial modificado en todos los tiempos evaluados. Los tres lotes cumplieron el límite microbiano establecido, así como la concentración mínima inhibitoria que estuvo entre 8 y 10 mg/mL y la concentración de taninos entre 13 a 30 mg/g.
Conclusiones: se demostró que todos los lotes del gel fueron estables durante el período de estabilidad en anaquel, por lo que se propone que se almacene de 2-8 ºC durante 1 año.
Palabras clave: estabilidad en anaquel, Rhizophora mangle L., mangle rojo, gel.
ABSTRACT
Objective: to evaluate the long-term stability of a gel obtained from the aqueous extract of the Rhizophora mangle L. (red mangrove) bark.
Methods: the three gel pilot batches (GM01, GM02 and GM03) were stored under refrigeration (5 ± 3 °C) for 12 months. Physical-chemical and microbiological evaluations were made at the beginning and after 3, 6, 9 and 12 months.
Results: All these batches kept their appearance of homogeneous, viscous, lump-free and bright gels with dark reddish-brown color and wide areas of extensibility. The pH ranged 6 to 7 and the rheology reflected a non-Newtonian Herschel Bulkley-type fluid with modified potential at all evaluated times. The three batches met the established microbial limit and the minimum inhibitory concentration (MIC) of 8 to 10 mg / mL and the tannin concentration of 13 to 30 mg/g.
Conclusions: it was demonstrated that all the gel batches were stable during the long-term stability study, so it was suggested that the gel should be stored at 2-8 °C for one year.
Key words: long-term stability, Rhizophora mangle L., red mangrove, gel.
INTRODUCCIÓN
Las plantas han formado la base de los sistemas tradicionales de medicina, los cuales han existido por cientos de años y son cada vez más utilizadas en todo el mundo durante las últimas décadas, como lo demuestra el rápido crecimiento de los mercados mundiales y nacionales de medicamentos a base de hierbas.1,2
En Cuba, su uso ha adquirido en los últimos años una relevancia fundamental como fuente de materia prima para la Industria Farmacéutica, en la sustitución de materia prima de importación para la elaboración de medicamentos y como arma terapéutica en los sistemas médicos y fitoterapéuticos tradicionales.3-5 De forma similar a lo que ocurre en la mayoría de los países, las plantas medicinales se encuentran incluidas en la categoría de medicamentos. Por tanto, se hace necesario que todo fitopreparado empleado con fines terapéuticos, cumpla los parámetros de calidad, seguridad y eficacia, aspectos que han sido deficientes en los productos herbarios.6-9
Como parte del sistema para el control, producción y comercialización de dichos medicamentos, es indispensable el registro del medicamento, el cual se evalúa por el Centro para el Control Estatal de Medicamentos (CECMED). En él se le solicitan al fabricante datos sobre la estabilidad del producto farmacéutico que avale el periodo de validez solicitado, ya que la seguridad y la eficacia de los productos farmacéuticos están influenciadas no solo por sus propiedades intrínsecas sino por la estabilidad que presenten.10,11
El gel de Rhizophora mangle L. se obtiene a partir del extracto acuoso concentrado de la corteza de este árbol, con probada eficacia como antiséptico y acelerador de la curación de heridas.12-14 Esta nueva forma farmacéutica fue diseñada tomando como antecedente las limitaciones de la formulación líquida registrada en el CECMED como CIKRON-H, entre ellas, el escurrimiento de las heridas en el momento de su aplicación y su correspondencia con la necesidad de aplicarlo cada 24 h, además de mejorar la presentación del producto final. El CIKRON-H, como presentación líquida tuvo una estabilidad en anaquel de 12 meses,15 para esta nueva forma de presentación fue realizado un estudio de estabilidad acelerada durante 3 y 6 meses para 40 y 25 °C respectivamente, lo que demostró que todos los lotes del gel permanecieron estables.16 Para confirmar estos resultados en condiciones reales de almacenamiento es indispensable hacer este estudio, por lo que el objetivo de este trabajo es evaluar la estabilidad en anaquel del gel de mangle rojo para determinar su periodo de validez.
MÉTODOS
Los tres lotes pilotos producidos se identificaron como GM01, GM02 y GM03, y se envasaron en tubos colapsibles de aluminio con laqueado interior de capacidad de 25 g, con inyector sellado de membrana de aluminio y tapa plástica de polietileno de alta densidad con perforador. Fueron producidos con la misma formulación, proceso de fabricación y condiciones de envase que se propone para circular en el mercado.
Se almacenaron a temperatura de 5 ± 3 °C durante 12 meses y se realizó una evaluación de los indicadores de estabilidad físico-química y microbiológica a tiempo inicial y a los 3, 6, 9 y 12 meses.
Características organolépticas
Se evaluó la apariencia física en cuanto a olor, color, textura (homogénea o no homogénea) y consistencia (fluida, semiviscosa o viscosa) mediante la utilización de los órganos sensoriales.
Contenido de taninos totales
Se realizó mediante una precipitación cuantitativa de los taninos con albúmina sérica y su posterior determinación colorimétrica con cloruro férrico.17
Límite microbiano
Se procedió según lo establecido por la USP 29, para determinar el conteo total de microorganismos viables aerobios por el método de placa vertida o número más probable (NMP).18
Actividad antimicrobiana
Se determinó la mínima concentración del producto (formulado a 30 mg/mL de sólidos solubles totales) que es capaz de inhibición en el crecimiento de la cepa de Sthaphylococcus aureus ATCC 29740 en un período de 24 h.19
Reología
Se realizó en un roto viscosímetro HAAKE de cilindros concéntricos, que lleva acoplado el sistema M5/SV2 y utiliza un programa computadorizado ROT.23 versión 2.3 HAAKE. Se trabajó en un ambiente termostatado a 25 °C. El gradiente de velocidad empleado fue de 0 a 440 s-1, con una duración de 2 min y la velocidad de cizalla fue de 0-200 Pa. Se realizaron mediciones tras el aumento y la disminución de la velocidad de deformación con el objetivo de obtener las curvas ascendentes y descendentes de los gráficos de fluidez. Se graficó la tensión de cizalla t (Pa) vs. velocidad de cizalla g (s-1).
Extensibilidad
Se le realizaron tres réplicas a cada lote en cada uno de los tiempos evaluados. La extensibilidad se midió utilizando placas de cristal (20 × 20 cm), se situó la placa inferior sobre una hoja de papel milimetrado a la que se le trazaron diagonales y se colocó una muestra de 2 g de gel sobre el punto de intersección. Se ubicó la placa superior durante 1 min y se tomaron los valores de los ocho radios formados.20 El área de extensibilidad (AE) se calculó según la siguiente expresión:
AE= p (rp)2
donde:
rp: radio promedio de las ocho mediciones (mm)
pH
El pH se determinó con un pH-metro PH M83 AUTOCAL pH METER y se consideró como límite de aceptación 6-7 según las características propias del extracto empleado en la elaboración del gel.
Análisis estadístico
Se usó el paquete estadístico STATGRAPHICS PLUS version 5.1 (Statistical Graphics Corp., EUA para señalar la existencia o no de diferencia significativa entre los lotes con respecto al pH, el contenido de taninos y la extensibilidad.
RESULTADOS
En cuanto a las características organolépticas de los lotes no se observaron cambios perceptibles, ni se detectaron signos visuales de inestabilidad física. Todos los lotes mantuvieron las especificaciones de calidad establecidas con una apariencia de geles de un color pardo rojizo oscuro, brillantes, homogéneos, de olor característico y consistencia viscosa.
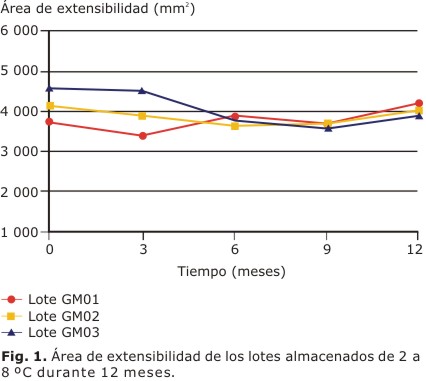
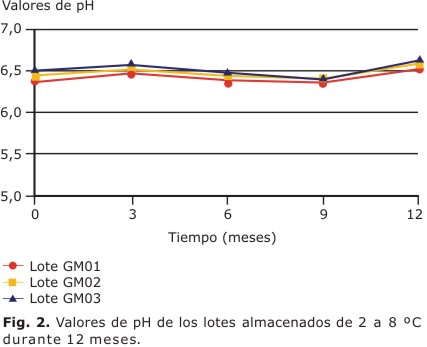
Todos los lotes mantuvieron grandes áreas de extensibilidad, entre 3 000 y 5 000 mm2 durante el estudio (Fig. 1), adecuadas para su aplicación en heridas y quemaduras. En las preparaciones tópicas el pH debe ser neutro o débilmente ácido, lo más parecido al de la piel. En este caso, todos los lotes se mantuvieron dentro de las especificaciones establecidas, en un rango entre 6 y 7 (Fig. 2).
En el estudio reológico realizado a los tres lotes, todos presentaron un fluido newtoniano de tipo plástico no ideal, correspondiente a modelo Herschel Bulkley, que se mantuvo durante los 12 meses de evaluación, el cual constituye un indicador de estabilidad física del gel.
Durante el período evaluado (tabla), todos los lotes se mantuvieron dentro de los límites de aceptación para este indicador de calidad (13-30 mg/g), y en correspondencia con los valores anteriores, la actividad antimicrobiana se comportó entre 8 y 10 mg/mL, lo que garantiza su actividad biológica in vitro pues el producto está formulado a una concentración de sólidos solubles totales tres veces mayor, es decir, a 30 mg/mL.
Los tres lotes cumplieron con el límite microbiano que regula que no exista más de 102 UFC y que no deben estar presentes Pseudomona aeruginosa, Staphylococcus aureus, Candida sp, Salmonella sp ni otras enterobacterias. Estos ensayos de control sobre la contaminación microbiana deben entenderse tanto de forma cuantitativa como cualitativa. Según esto, en los medicamentos y cosméticos no deben de haber agentes de enfermedades (especies patógenas), y el contenido de saprofitos no debe sobrepasar los valores límites definidos.
DISCUSIÓN
La prueba de estabilidad es la principal herramienta para evaluar la fecha de caducidad y las condiciones de almacenamiento para productos farmacéuticos. Los estudios de estabilidad están vinculados al establecimiento y garantía de la seguridad, calidad y eficacia del medicamento desde la temprana fase de desarrollo a través del ciclo de vida del medicamento.21 El diseño de este estudio se debe realizar con el fin de obtener información sobre el comportamiento de las características físicas, químicas, microbiológicas y biofarmacéuticas de un medicamento durante el periodo de validez propuesto y en las condiciones de almacenamiento y en el envase en que se propone circular, o con el que circula en el mercado. Sus resultados permiten confirmar o establecer el periodo de validez y las condiciones de almacenamiento.10
Todos los lotes mantuvieron una apariencia adecuada y fueron fácilmente lavables, a pesar de la capacidad de manchar que tiene el extracto acuoso de mangle rojo. Este resultado puede deberse al carbopol que contiene esta formulación, el cual tiene un elevado grado de transparencia, facilidad de aplicación y de remoción, además de propiedades emolientes y refrescantes.22 La posibilidad de ser eliminado de la zona tratada mediante un simple lavado resulta siempre de interés, pues se reduce el dolor del paciente durante este proceso. No obstante, esta recomendación no debe en ningún caso, influir en el efecto general de la medicación como sucede, por ejemplo, en aquellas enfermedades que requieren por su remisión, de vehículos grasos fuertemente oclusivos y que lógicamente no son lavables.23
Además de estas características, este gel mostró una buena extensibilidad, solo se observó diferencia significativa (p £ 0,05) entre los lotes a los tres meses dados por la propia variabilidad del método. En el análisis reológico se observó un comportamiento característico de los geles en todos los lotes.
Al respecto, un gel no debe ser ni poco extensible (muy viscoso), ni demasiado extensible (muy fluido) ya que sería muy desagradable a la hora de su aplicación e incómodo para el paciente, por lo que se requiere que esté en un término medio y que con el tiempo se mantenga estable; por su importancia, este indicador ha sido evaluado por otros autores.24-26
La determinación del pH es necesaria para detectar cualquier alteración de este indicador durante el almacenamiento, lo que asegura que el valor de pH del gel es compatible con los componentes de la formulación y con el sitio de aplicación, lo que evita que se produzca una irritación.27 En este caso el pH de todos los lotes fue estable y no se manifestaron diferencias significativas entre los lotes a los diferentes tiempos. Si bien desde el punto de vista del volumen de producción las preparaciones dermatológicas ocupan el 4 % en las estadísticas, constituyen, sin embargo, un grupo de significativa importancia dentro de la tecnología farmacéutica. Esto se debe a que su formulación requiere de consideraciones muy especiales, no solamente en lo referente a la naturaleza de los principios activos, las bases o vehículos y los diferentes aditivos, sino también por la complejidad del órgano sobre el cual van a ser aplicados, es decir, sobre la piel.28 Dentro de las consideraciones especiales que se deben tener en cuenta se encuentra el pH, dado que durante el período de almacenamiento puede ocurrir un cambio significativo si el pH excede el límite establecido, al igual que el incumplimiento de las especificaciones de la descripción y las propiedades físicas como, por ejemplo, el color, separación de fases, entre otros.10
La actividad biológica del gel como antiséptico y acelerador de la curación de heridas está relacionada con los taninos totales, que constituyen el compuesto mayoritario del extracto acuoso de la corteza de Rhizophora mangle L. y son los principios activos de esta formulación.29 En la compleja composición química que tiene, predominan los polifenoles (54,78 %), representados en su mayoría por taninos poliméricos (80 %) y taninos hidrolizables (20 %), destacándose la presencia en estos últimos de epicatequina, catequina, ácido clorogénico, ácido gálico y ácido elágico, además de galotaninos y elagitaninos.30 La determinación de taninos totales se realizó por un método previamente validado por Travieso y otros17 y mostró, al igual que en el estudio de estabilidad acelerado16 que el lote 3 difirió del resto en todos los tiempos evaluados (p £ 0,05). Se observó un aumento en la concentración de taninos en el tiempo, debido fundamentalmente a las características de la técnica empleada para su cuantificación, que también puede detectar la presencia de otros compuestos coloreados oxidados que se forman en el tiempo, por el efecto del alto contenido de agua en esta forma farmacéutica. Todos estos valores se mantuvieron dentro del límite y es importante señalar que respaldando estos resultados, la actividad biológica in vitro determinada a través de la actividad antimicrobiana, se mantuvo entre 8 y 10 mg/mL. Aunque se demostró que su componente mayoritario (la fracción de taninos poliméricos) contribuyó con el mayor aporte a la actividad antimicrobiana del extracto de mangle frente a diferentes microorganismos, todos los grupos químicos presentes en él mostraron también esta actividad.31 Armenteros informa que concentraciones de 8 mg/mL de extractos de mangle rojo inhiben el crecimiento de Staphylococcus aureus y Streptococcus agalactiae; con concentraciones de 10 mg/mL Candida albicans y Pseudomona aeruginosa; y a partir de 40 mg/mL Salmonella thyphimurium y Escherichia coli.32 Resultados similares fueron obtenidos por Montes de Oca y otros, 2001.33
De forma general, los tres lotes mantuvieron los indicadores evaluados dentro de los límites establecidos, lo que indica que fue certera la selección de los excipientes de la formulación, así como del envase, aspecto fundamental para garantizar la estabilidad del medicamento.34-36 El tubo de metal es muy utilizado en este tipo de formulaciones ya que permite una fácil dispensación del preparado, con buen cierre y una adecuada protección del producto. Si se utiliza de forma correcta, el riesgo de contaminación de la fracción remanente es mínimo ya que el tubo, al ser colapsable, no vuelve a inspirar aire hacia su interior. En este estudio, el uso de este tipo de envase contribuyó a que el límite microbiano se mantuviera dentro de las especificaciones establecidas por la USP 29.18 Por el contrario, en el caso de los tubos plásticos, la recuperación de la forma original motivada por la elasticidad del material puede favorecer la degradación del preparado remanente debido a la entrada de aire hacia el interior del recipiente.34
Todos los lotes del gel fueron estables durante el período de estabilidad en anaquel, por lo que se propone que se almacene de 2-8 ºC durante 1 año, y se recomienda continuar este estudio hasta los 24 meses.
REFERENCIAS BIBLIOGRÁFICAS
1. Hooyenga PA, Witkamp RF, Groen K. Herbal products: Marketing strategies and legislation. Int J Green Pharm. 2009;3:270-6.
2. Aneesh TP, Hisham M, Sekhar MS, Madhu M, Deepa TV. International market scenario of traditional Indian herbal drugs-India declining. Int J Green Pharm. 2009;3:184-90.
3. Morón F. Plantas medicinales: la experiencia cubana. Revista Mundo Natural. Fitoterapia [Internet]. 2005 [citado 10 Feb 2009]. Disponible en: http://www.biomanantial.com/plantas-medicinales-la-experiencia-cubana-a-133.html
4. Martín-Viaña N de la Paz, Morales Lacarrere IG, Torres Amaro L. Desarrollo tecnológico y estudio de estabilidad de un medicamento antiulceroso de origen natural. Rev Cubana Plant Med [Internet]. 2007 Dic [citado 14 Mar 2010];12(4). Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1028-47962007000400002&lng=es&nrm=iso&tlng=es
5. Plantas medicinales. [Internet] 2009 [citado10 Feb 2010]. Disponible en: http://www.sld.cu/fitomed/pm.html
6. Brinker F. Managing and interpreting the complexities of botanical research. Herbal Gram. 2009;82:42-9.
7. Chadwick L, Fong HHS. Herb quality assurance and standardization in herb-drug interaction evaluation and documentation. In: Lam YWF, Huang SM, Hall SD, eds. Herbal Supplement-Drug Interactions. New York: Taylor & Francis; 2006. p.191-203.
8. Ernst E. Methodological aspects of traditional Chinese medicine (TCM). Ann Acad Med Singapore. 2006;35:773-4.
9. Ip SP, Zhao M, Xian Y, Chen M, Zong Y, Tjong YW, et al. Quality assurance for Chinese herbal formulae: standardization of IBS-20, a 20-herb preparation. Chin Med. 2010;5(1):8.
10. Regulación 23-2000. Requerimientos de los estudios de estabilidad para el registro de productos farmacéuticos nuevos y conocidos. La Habana: CECMED; 2000.
11. Requisitos para las solicitudes de inscripción, renovación y modificación en el registro de medicamentos de origen natural de uso humano. La Habana: CECMED; 2001.
12. Melchor G, Fernández O, Alvarez E, Fragas I, Lobo E. Evaluación del efecto antiséptico in vivo del CIKRON-H. Rev Mex Cien Farm. 2001;32(2):25-32.
13. Fernández O, Capdevila JZ, Dalla G, Melchor G. Efficacy of Rhizophora mangle aqueous bark extract in the healing of open surgical wounds. Fitoter. 2002;73(7/8):564-8.
14. Bulnes C, Fernández O, Navarro D, Marrero E, Rueda D, Figueroa O, Melchor G, Proenza T. Healing effect of a red mangrove extract on open aseptic wounds in rats. Rev Salud Anim. 2001;23(2):102-8.
15. Escobar A, Pérez T, Riverón Y, Melchor G, Sánchez LM, Fernández O, et al. Estabilidad en vida de estante del CIKRON-H. Rev Salud Anim [Internet]. 2008 Abr [citado 14 Mar 2010];30(1):32-38. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0253-570X2008000100005&lng=es
16. Soler DM, Rodríguez Y, Pérez T, Riverón Y, Morales IG. Estabilidad acelerada de un gel de Rhizophora mangle L. (mangle rojo) para heridas y quemaduras. Rev Cubana Farm [Internet]. 2011 [citado 20 Nov 2011];45(4). Disponible en: http://bvs.sld.cu/revistas/far/vol45_4_11/far11411.htm
17. Travieso MC, Betancourt A, Escobar A, Linares A, Rodríguez Y, Pérez T. Validación del método de cuantificación de taninos totales en formulaciones semisólidas de Rhizophora mangle L. (mangle rojo). Rev Cubana Plant Med [Internet]. 2011 [citado 12 Mar 2011];16(1). Disponible en: http://bvs.sld.cu/revistas/pla/vol16_1_11/pla09111.htm
18. US Pharmacopeia <61> Microbial Limit Tests. USP 29. The United States Pharmacopeial. Rockville: Convention; 2006. p. 2503-8.
19. Daguet GL, Chabbert VA. Técnicas en Bacteriología. Barcelona: Editorial JIMS; 1977. p. 135-53.
20. PN/L/CP/003/00 Determinación del índice de extensibilidad. [Internet]. 2008 [citado12 Sept 2009]. Disponible en: http://www.rentasoft.es/Compufarma/Formulacion/PN_L_CP_003_00.pdf
21. WHO. Draft regional guidelines on stability testing of active substances and pharmaceutical products. World health organization. [Internet]. 2006 [cited 2010 Mar 13]. Available from: http://www.emro.who.int/emp/media/pdf/EMRC5312En.pdf
22. Almeida I, Bahia MF. Geles-Aspectos Fundamentais. Revista portuguesa de farmácia. Ordem dos Farmaceuticos. 2000;L(3):97-103.
23. Muñoz M. Síntesis y caracterización de geles como vehículos de Meloxicam y Acetato de Vitamina E de aplicación tópica terapéutica y cosmética. Tesis doctoral. [Internet]. 2005 [citado 3 Feb 2009]. Disponible en: http://digibug.ugr.es/handle/10481/560
24. Lardy F, Vennat B, Pouget P, Pourrat A. Functionalization of hydrocolloids: Principal component analysis applied to the study of correlations between parameters describing the consistency of hydrogels. Drug Dev Ind Pharm. 2000;26:715-21.
25. Contreras MD, Sanchez M. Application of a factorial design to the study of the flow behavior, spreadability, transparency of Carbopol ETD 2020 gel. Part II. Int J Pharm. 2002;234:149-57.
26. Barakat NS. Optimization of physical characterization, skin permeation of naproxen from glycofurol-based topical gel. Asian J Pharm. 2010;4:154-62.
27. Marquele-Oliveira F, Fonseca YM, de Freitas O, Fonseca MJV. Development of topical functionalized formulations added with propolis extract: Stability, cutaneous absorption and in vivo studies. Int J Pharm. 2007;342:40-8.
28. Pareja B. Aspectos biofarmacéuticos de las preparaciones dermatológicas. Revisión de tema. Folia Dermatol (Peru). 2004;15(1):49-52.
29. Sánchez LM, Valcárcel L, Escobar A, Noa M. Polyphenol and phytosterols composition in an antibacterial extract from Rhizophora mangle L´s bark. J Herbal Pharmacother. 2006;6:5.
30. Sánchez LM, Escobar A, Valcárcel L. Caracterización preliminar de la materia prima de Rhizophora mangle L. en la obtención de productos farmacéuticos procedentes de tres zonas geográficas de Cuba. Rev Salud Anim. 2005;27(2):115-23.
31. Sánchez LM, Armenteros M, Varcárcel L. Actividad antimicrobiana de los principales grupos químicos presentes en Rhizophora mangle L. Rev Salud Anim. 2000;22(3):174-9.
32. Armenteros M, Ginorio MC. Determination of the minimum inhibitory concentration of Rizophora mangle L. (Red mangrove) against different microorganisms. Rev Salud Anim. 1999;21(2):135.
33. Montes de Oca N, Riverón Y, González RA. Evaluation of antimicrobial activity of different extracts of Rhizophora mangle L. using five methods. Rev Salud Anim. 2001;23(1):1-7.
34. Soriano MC, Sánchez-Lafuente C, Alvarez-Fuentes J, Holgado MA. Acondicionamiento de medicamentos: funciones y tipos de envasado. Industria Farmacéutica. 2000:15(3):95-101.
35. Ratna V. Stability of drugs: Packaging and stability. [Internet]. 2005 [cited 2010 Mar 13]. Available from: http://www.pharmpedia.com/Stability_Of_Drugs:Packaging_And_Stability
36. Shabir GA. Review of Pharmaceutical Product Stability, Packaging and the ICH Guidelines. Am Pharm Rev. 2008;11(1):139-41.
Recibido: 5 de abril de 2012.
Aprobado: 2 de junio de 2012.
Dulce María Soler Roger. Centro Nacional de Sanidad Agropecuaria (CENSA). Carretera de Jamaica y Autopista Nacional. San José de Las Lajas. Mayabeque, Cuba. Correo electrónico: dmsoler@censa.edu.cu