Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Cultivos Tropicales
versión On-line ISSN 1819-4087
cultrop vol.38 no.1 La Habana ene.-mar. 2017
Respuesta agronómica del cultivo de tomate al bioproducto QuitoMax®
Agronomic tomato crop response to bioproduct QuitoMax®
Dra.C. Elein Terry Alfonso,I Dr.C. Alejandro Falcón Rodríguez,I M.Cs. Josefa Ruiz Padrón,I Yudines Carrillo Sosa,I Dr.C. Hugo Morales MoralesII
IInstituto Nacional de Ciencias Agrícolas (INCA). Gaveta postal No.1, San José de las Lajas. Mayabeque, Cuba. CP 32700.
IIUniversidad Autónoma de Chihuahua (UACH). Cd. Delicias Carretera a Rosales km 2½. Chihuahua, México. C.P. 33000.
RESUMEN
Los productos bioactivos, ejercen diversos efectos beneficiosos en las plantas, tales como, la inducción de mecanismos defensivos y la estimulación del crecimiento vegetal, además de tener la ventaja de no ser dañinos a las plantas ni al medio ambiente; siendo un ejemplo, las oligosacarinas y dentro de ellas la Quitosana y sus derivados, las cuales ejercen efecto positivo en el crecimiento y desarrollo de las plantas. El presente trabajo se desarrolló en condiciones de campo, con el objetivo general de evaluar el efecto de diferentes concentraciones (0,1; 0,5 y 1,0 gL-1), y su aplicación por imbibición y aspersión foliar del bioproducto QuitoMax® en el crecimiento, desarrollo y rendimiento del cultivo del tomate (cultivar Mara). Los resultados mostraron un efecto positivo del bioproducto a partir de la imbibición de las semillas en la concentración de 1,0 g L-1 estimulándose las diferentes variables del crecimiento que fueron evaluadas en semillero; por otra parte, la combinación imbibición más la aspersión foliar con la dosis de 0,3 g ha-1 a los siete días después del trasplante, estimuló los componentes del rendimiento de las plantas e incrementó el rendimiento agrícola en un 55 % con respecto al tratamiento control.
Palabras clave: bioestimulante, crecimiento, quitosano, rendimiento, Solanum lycopersicum.
ABSTRACT
The bioactive products, have various beneficial effects on plants, such as, induction of defense mechanisms and stimulation of plant growth, besides it having the advantage of not being harmful to plants and the environment; the oligosaccharines and inside them the chitosan and its derivatives are an example, they exert positive effect on growth and development of plants. This work was carried in field condition with the overall objective of evaluating the effect of different concentrations (0,1, 0,5 and 1,0 g L-1), and its application by imbibition and foliar spray product QuitoMax® on growth, development and yield and its components of tomato (cultivar Mara). The results showed a positive effect of byproduct from the seeds imbibition on concentration of 1,0 g L-1 stimulating growth variables that were evaluated in the nursery; moreover, the combination soaking plus foliar spray at a dose of 0,3 g ha-1 at 7 days after transplantation, stimulated yield components of plants and increased crop yields by 55 % compared to control treatment.
Key words: biostimulant, growth, chitosan, yield, Solanum lycopersicum.
INTRODUCCIÓN
Con el propósito de conservar el agroecosistema y teniendo en cuenta la creciente demanda de alimentos, así como los altos cotos de los paquetes tecnológicos, surge la necesidad de buscar nuevas tecnologías para incrementar la producción y ofrecer productos libres de residuos tóxicos a los consumidores (1).
Los gobiernos hoy en día, reinstauran la idea del reciclaje eficiente de los residuos y el uso de productos biológicos como los bioestimulantes, para reducir al mínimo el empleo de productos químicos que ocasionan toxicidad a la salud humana y al agroecosistema en general. Estos bioestimulantes, son una gama de productos que contienen principios activos, los cuales actúan sobre la fisiología de las plantas, incrementando el crecimiento y desarrollo vegetal, así como el rendimiento y calidad de las cosechas (1).
En el caso específico de Cuba, el uso de estos bioproductos se incrementa gradualmente en la agricultura y su aplicación se hace frecuente y casi imprescindible en el manejo agrotécnico de los cultivos, con ello se busca aumentar los rendimientos agrícolas y garantizar la sostenibilidad biológica y económica de los sistemas de producción (2).
Generalmente, estos productos se aplican por vía foliar mediante la aspersión, los mismos permiten corregir de manera rápida, deficiencias de nutrientes en momentos críticos para el desarrollo de los cultivos. Sin embargo, otras formas de aplicación como el tratamiento de semillas vía imbibición y la adición al sustrato se han informado como positivas en el beneficio biológico de los cultivos pero han sido poco estudiados (3).
En el contexto actual de los bioestimulantes agrícolas, ha tenido un gran auge en la última década, el desarrollo de productos que tienen a las Quitosanas como principales ingredientes activos. Estas son polímeros y oligómeros de glucosamina que se obtienen por desacetilación básica del polímero de quitina que, a su vez, se extrae del exoesqueleto de los crustáceos (4, 5).
Los polímeros y oligómeros de quitosana pueden tener una amplia aplicación agrícola a partir de las potencialidades biológicas que se le han demostrado a estos compuestos, como la promoción del crecimiento y desarrollo vegetal de varios cultivos de importancia económica (6, 7).
El Grupo de Productos Bioactivos (GPB) del Instituto Nacional de Ciencias Agrícolas (INCA), ha desarrollado un producto líquido a base de polímeros de quitosana obtenidos de quitina presente en el exoesqueleto de langosta, cuyo nombre comercial es QuitoMax®. Dicho producto es evaluado y extendido en diversos cultivos de importancia económica como son tabaco (Nicotiana tabacum L.), papa (Solanum tuberosum L.), pimiento (Capsicum annuum L.), pepino (Cucumis sativus L.), frijol (Phaseolus vulgaris L.), soya (Glicine max L.), maíz (Zea mays L.), arroz (Oryza sativa L), entre otros, con resultados positivos y promisorios que han determinado una demanda actual en la agricultura nacional (8).
El tomate (Solanum lycopersicum L.), es una de las hortalizas que más se produce e industrializa en todo el mundo y de las de mayor valor económico. Su demanda aumenta continuamente y con ella su cultivo, producción y comercio, los promedios anuales sobrepasan los 152 956 115 t lo cual fue referido en diferentes informes. En Cuba, dicho cultivo representa el 50 % del área total dedicada a las hortalizas y la producción oscila alrededor de los 750 000 t; sin embargo, los rendimientos registrados en varias áreas productivas del país son bajos, debido entre algunas causas a las desfavorables condiciones edafoclimáticas que prevalecen, la falta de insumos y la escasez de alternativas para garantizar las exigencias del cultivo (9).
De acuerdo a los antecedentes expuestos, el presente trabajo tuvo como objetivo general, evaluar el efecto de diferentes dosis y formas de aplicación de QuitoMax® en el crecimiento, desarrollo y rendimiento agrícola del cultivo del tomate.
MATERIALES Y MÉTODOS
La presente investigación se desarrolló en áreas experimentales del Departamento de Servicios Agrícolas del INCA, situado en el municipio de San José de las Lajas, provincia Mayabeque, Cuba, en el período comprendido de diciembre 2014 – marzo 2015.
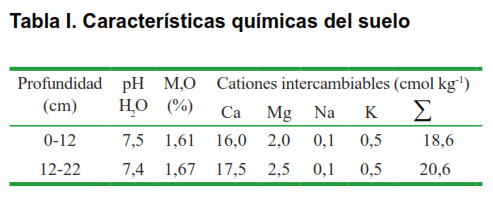
Las plantas crecieron sobre suelo Ferralítico Rojo Compactado Éutrico, según la Nueva Versión de Clasificación de los Suelos de Cuba (10). Se determinaron las características químicas del mismo siguiendo las técnicas descritas en el manual para análisis de suelo, foliar, abonos orgánicos y fertilizantes químicos (11). A continuación se muestra los resultados del análisis químico (Tabla I); donde, a excepción de la materia orgánica, que resultó baja, el pH y los cationes intercambiables, se encuentran en el rango adecuado para el normal desarrollo del cultivo de tomate (11).
Posteriormente, para llevar a cabo el experimento, se utilizaron semillas de tomate del cultivar `Mara`, con un poder germinativo superior al 90 %, obtenida a través del Programa de Mejoramiento Genético del INCA. Se utilizó el bioestimulante QuitoMax®, cuyo ingrediente activo es un polímero de Quitosana, obtenido por el Grupo de Productos Bioactivos (GPB) del INCA, a partir de la desacetilación básica (NaOH) de la quitina presente en la cubierta de las langostas (12). Se preparó una disolución madre de QuitoMax® al 1 %, la cual se diluyó en H2O destilada estéril hasta obtener las concentraciones deseadas para los experimentos.
Las semillas fueron embebidas (Emb) durante 30 minutos en las concentraciones de QuitoMax® correspondientes y se sembraron en semillero tradicional a cielo abierto sobre canteros (13); los cuales estaban constituidos por un sustrato compuesto por abono orgánico (estiércol vacuno) y suelo, donde cada tratamiento ocupó un área experimental de 1,0 m2, bajo un diseño completamente aleatorizado con tres repeticiones.
Las plántulas con 30 días de edad en el semillero, se llevaron al campo, estableciéndolas en parcelas de 28 m2, a un marco de plantación de 1,40 x 0,30 m distribuidas bajo un diseño de bloques al azar con cuatro réplicas y seis tratamientos (Tabla II). Las atenciones culturales se realizaron de acuerdo a las establecidas en el instructivo técnico del cultivoA.
La aplicación foliar (AF) del producto se realizó a los siete días después del trasplante (inicio de los primordios florales) con una dosis de 0,3 g ha-1 (4), en horas tempranas de la mañana (8:00-9:00 am) aprovechando la apertura estomática de las hojas, utilizando una asperjadora manual de 16 L, la cual se calibró antes de ser usada.
A los 10, 15 y 25 días después de la germinación (DDG) en condiciones de semillero, se realizaron muestreos destructivos de planta completa con un tamaño de muestra que permitió tener una certeza de 95 % (15 plántulas por cada parcela de cada tratamiento) (14), a las que se les realizaron las evaluaciones de crecimiento referidas en otros trabajos (1) como son:
-
Altura de las plántulas (cm): se midió con regla graduada, desde el cuello de la raíz hasta la axila de la hoja más joven.
-
Diámetro del tallo de las plántulas (cm): se determinó con un pie de rey, a partir de dos centímetros por encima del cuello de la raíz.
-
Número de hojas por plántula: por conteo visual.
-
Longitud radical (cm): se midió la raíz principal con una regla graduada.
-
Masa fresca de las plántulas (g): pesaje en balanza analítica (Sartorius).
- Masa seca de las plántulas (g): secado en estufa (BrBOXUN) a 70 oC hasta masa constante y pesaje en balanza analítica (Sartorius).
En la etapa de floración – fructificación, se seleccionaron 15 plantas por cada tratamiento al azar, a las que se le realizaron las siguientes evaluaciones (1):
-
Número de racimos, flores y frutos por planta: por conteo visual.
-
Masa promedio de los frutos (g): por división de la masa total de los frutos entre la cantidad de frutos de la parcela.
-
Estimación del Rendimiento agrícola (t ha-1): por pesada de la producción total del área de cálculo, extrapolada a una hectárea.
Los datos obtenidos, se analizaron mediante un ANOVA de Clasificación Simple (semillero) y doble (campo). Las medias resultantes se compararon con la Prueba de Rangos Múltiples de Duncan (15) para p≤ 0,05 cuando existieron diferencias significativas entre los tratamientos, procesado con el programa Statgraphics Centurión (16).
RESULTADOS Y DISCUSIÓN
Efecto de concentraciones de QuitoMax® en el crecimiento de plántulas de tomate
Los resultados obtenidos al evaluar la altura de las plántulas de tomate (Figura 1 A), muestran que las concentraciones de QuitoMax® empleadas, tuvieron un efecto positivo en esta variable, específicamente en los tratamientos donde se embebieron las semillas con las concentraciones de 0,5 y 1,0 g L-1.
A los 15 DDG, las plántulas de ambos tratamientos, alcanzaron el tamaño óptimo requerido para el trasplante el cual se encuentra entre 15-18 cm (9). Sin embargo, el tratamiento con la menor concentración (0,1 g L-1) superó al control a los 10 DDG, mientras que a los 15 y 25 DDG, se comportaron de igual modo, por lo que no se denota un efecto de esta dosis en esta variable del crecimiento.
La altura de las plantas es el primer indicador visible que indica el momento del trasplante, acortar este período implica ahorros económicos en todo el ciclo del cultivo. Resultados similares de incremento en altura de las plantas en menor tiempo que lo indicado por el instructivo del cultivo, han sido obtenidos por ejemplo, con la aplicación de rizobacterias estimuladoras del crecimiento vegetal en los cuales se logra con siete días de diferencia, una postura de tomate de calidad (17).
En cuanto al diámetro del tallo (Figura1 B), los resultados obtenidos demuestran la acción positiva del QuitoMax® en esta variable de crecimiento, donde los mayores valores correspondieron a los tratamientos donde se embebieron las semillas con las concentraciones de 0,5 y 1,0 g L-1 de QuitoMax® con respecto al tratamiento con la menor concentración evaluada del producto (0,1 g L-1) y al control.
La aplicación de QuitoMax® mediante imbibición de semillas, favoreció el número de hojas por plántula (Figura 2 A), alcanzándose el mayor valor a los 10 DDG en los tratamientos donde se embebieron las semillas con las concentraciones de 0,5 y 1,0 g L-1; mientras que a los 15 y 25 DDG, este indicador cuantificó el mayor valor en el tratamiento con la concentración de 1,0 g L-1 del producto.
Los resultados obtenidos en la longitud radical (Figura 2 B), mostraron diferencias significativas p < 0.05 en todas las concentraciones evaluadas, por lo que las diferentes dosis de QuitoMax® ejercieron un efecto positivo en esta variable de crecimiento. Se obtuvieron los mayores valores en el tratamiento con la concentración de 1,0 g L-1, seguido del tratamiento con la concentración de 0,5 g L-1, mientras que los menores valores correspondieron al control y al tratamiento con la concentración de 0,1 g L-1 del producto. Ésta última, repercutió negativamente en la longitud radical de las plántulas, fundamentalmente en la etapa inicial y final del semillero.
La masa fresca de la parte aérea de las plántulas (Figura 3 A), presentó diferencias significativas p<0.005 en todas las concentraciones probadas, obteniendo los mayores valores el tratamiento con la concentración de 1,0 g L-1, seguido por los tratamientos con las concentraciones de 0,5 y 0,1 g L-1, aunque esta última no difirió significativamente del control a los 15 DDG.
Resultados similares a la masa fresca fueron encontrados en la masa seca de la parte aérea de las plántulas con la aplicación del QuitoMax® mediante imbibición de las semillas (Figura 3 A), donde los tratamientos con las mayores concentraciones del producto (0,5 y 1,0 g L-1) beneficiaron esta variable de crecimiento. En el tratamiento donde se embebieron las semillas con la menor concentración de QuitoMax® (0,1 g L-1), no mostró diferencias significativas con el control en todo el periodo de crecimiento evaluado, excepto a los 15 DDG.
De manera general, en todas las variables de crecimiento evaluadas, la aplicación del QuitoMax® mediante imbibición de semillas resultó beneficiosa para el crecimiento de las plántulas de tomate con respecto a las plántulas provenientes de semillas no tratadas. Los mejores resultados se obtuvieron en los tratamientos con las mayores concentraciones, específicamente con la concentración de 1,0 g L-1.
Resultados similares fueron obtenidos en Solanáceas pero en minitubérculos de papa cuyo crecimiento se vio favorecido con la aplicación de distintas concentraciones de quitosana por imbibición de semillas. Esto proporcionó efectos deseables en el contexto agrícola, como promover el crecimiento vegetativo e inducir la germinación además de mejorar la tolerancia al estrés abiótico (18).
En un estudio del cultivo de tomate var. Amalia, se realizó la imbibición de semillas a diferentes concentraciones durante cuatro y ocho horas, sólo la concentración de 1,0 gL-1 ejerció un efecto positivo en la masa seca de plántulas del cultivo; sin embargo, no presentó modificaciones en las demás variables evaluadas (19). Estos resultados no concuerdan con los expuestos en este trabajo, donde las concentraciones utilizadas estimularon las variables del crecimiento aun cuando el tiempo de imbibición fue considerablemente inferior al utilizado por estos autores.
La respuesta mostrada por las distintas variables de crecimiento pudieran ser explicada a partir de la capacidad de QuitoMax® para estimular el crecimiento de las plántulas, lo que también mantiene una estrecha relación con las concentraciones empleadas, el tamaño molecular y la forma de aplicación del producto al cultivo, que incluye el tiempo de contacto con el órgano que percibe la aplicación, en este caso la semilla, siendo estimulada la velocidad de germinación y acelerando el crecimiento. Se ha demostrado que las quitosanas estimulan los niveles de proteínas en las hojas así como los niveles enzimáticos, incrementándose la resistencia basal de las plantas (4, 19).
Efecto de dosis y formas de aplicación del QuitoMax® en el desarrollo y rendimiento agrícola de las plantas de tomate en condiciones de campo.
Con la aplicación del producto QuitoMax®, se logró un incremento significativo en todos los componentes del rendimiento evaluados con respecto al control, lo que demuestra el efecto positivo de este producto en el desarrollo de las plantas de tomate en condiciones de campo.
En la Tabla III se observa que los mayores valores en el número de racimos, flores y frutos fueron para la concentración de 1,0 g L-1 de QuitoMax® combinada con la aspersión foliar de 0,3 g ha-1 del producto (T7); este tratamiento, solo no difirió del aquel donde se embebieron las semillas con la concentración de 0,5 g L-1 combinada con la aspersión foliar de 0,3 g ha-1 del producto para la variable número de flores por planta.
Por otra parte, los menores valores de los componentes evaluados correspondieron a las plantas que no recibieron ningún tratamiento con el producto (control), aunque este último no presentó diferencias significativas en el número de racimos y de flores con el tratamiento donde se embebieron las semillas en la concentración de 0,1 g L-1, tampoco difiere en el número de flores del tratamiento con la concentración de 0,5 g L-1 aplicada mediante imbibición de semillas, lo que demuestra que las semillas embebidas en estas dosis no responden positivamente para estos componentes del rendimiento de las plantas. Por tanto, dosis bajas aplicadas solo a la semilla, no ejercen un efecto en la productividad de las plantas, demostrándose que para que esto ocurra es necesario entonces la combinación con la aspersión foliar en el momento inicial del desarrollo de las plantas.
En cuanto al rendimiento agrícola, las aplicaciones del producto en sus diferentes formas influyeron positivamente en este indicador productivo (Tabla IV). Todos los tratamientos con el QuitoMax® superaron al control y a su vez existieron diferencias significativas entre ellos en dependencia de las concentraciones y sus combinaciones con sin la aspersión foliar del producto.
El mayor rendimiento obtenido (25,26 t ha-1) corresponde al tratamiento donde se embebieron las semillas con la concentración de 1,0 g L-1 combinada con la aspersión foliar de 0,3 g ha-1 del producto, luego del trasplante, con un incremento de 55 %, con respecto al control.
Otros tratamientos que resultaron favorables en el rendimiento, fueron donde se embebieron las semillas en las concentraciones de 0,1 y 0,5 gL-1 y además se les adicionaron una aspersión foliar de 0,3 g ha-1 del producto, con valores de 23,13 y 24,46 t ha-1 respectivamente para un 42 y 50 % de incremento. Por otra parte, los demás tratamientos en los que el producto fue aplicado en una sola ocasión, mostraron un rango de valores que oscila de 17 a 19 tha-1 los cuales fueron superiores al control con un rendimiento superior de 16,28 t ha-1.
Los resultados antes señalados, están en correspondencia con resultados obtenidos en mini tubérculos de papa y en el cultivo del tomate al lograr la promoción del crecimiento de la parte aérea y radical de las plantas, el adelanto del período de floración y fructificación, el incremento del tamaño y masa de los frutos, así como, el número de flores y frutos con aplicaciones de quitosana (18, 20).
Por otra parte, resultados similares a los encontrados en este trabajo han sido publicados a partir de estudios realizados en diferentes cultivos como tomate (Solanum lycopersicum L.), cártamo (Carthamus tinctorius L.) y girasol (Helianthus annuus L.), en aras de determinar las potencialidades de los polímeros de quitosanas, en los que lograron estimular el crecimiento mediante imbibición de semillas en estadios de semilleros, así como, los rendimientos por aspersión foliar en campo con resultados promisorios (21, 22).
También, se señala que la aplicación de bioestimulantes, potencia las auxinas que intervienen en el proceso de reproducción vegetal, ocurriendo un sinergismo entre las sustancias aplicadas y las hormonas naturales de las plantas (23), lo cual hace pensar que similar comportamiento sucede cuando se aplica el QuitoMax® al cultivo del tomate, logrando estimular desde el crecimiento hasta el rendimiento.
De igual manera, estos resultados confirman estudios que demuestran que la combinación de formas de aplicación tales como, el tratamiento a las semillas y la aplicación al suelo o sobre la planta de soluciones de quitosana en minitubérculos de papa, aumenta el rendimiento del cultivo (18).
La respuesta favorable de los indicadores productivos puede deberse a que la aspersión foliar del QuitoMax® estimuló los procesos fisiológicos de las plantas, incrementando el tamaño de las células, lo cual hace más asimilable los nutrientes por las mismas (24, 25). Por otra parte, este efecto también pudo estar relacionado con la capacidad del producto de actuar como antitranspirante al provocar un cierre parcial o total de los estomas, favoreciendo el estado hídrico de la planta y otros procesos fisiológicos que contribuyen a aumentar la producción de biomasa y el rendimiento agrícola, a la vez que reduce las pérdidas de agua en las plantas (5).
CONCLUSIÓN
De acuerdo a los resultados obtenidos puede arribarse a la conclusión de que el QuitoMax® aplicado por imbibición de las semillas, por aspersión foliar o en su combinación, estimula las variables de crecimiento, desarrollo y rendimiento. La imbibición de las semillas con la concentración más alta (1,0 g L-1) produjo los mayores incrementos en el crecimiento, a nivel de semillero; mientras que, su combinación con la posterior aspersión foliar de 300 mg ha-1, provocó, además, incrementos en el rendimiento del cultivo en un 55 % con respecto al control de producción.
NOTA AL PIE
AMINAGRI. Instructivo técnico del cultivo del tomate, Cuba, 1992, p. 52.
BIBLIOGRAFÍA
1. Rodríguez, R. C. R.; Figueredo, J. V. y González, P. O. S. “Influencia de la quitosana en tomate (Solanum lycopersicum, Mill) var. «Amalia»”. Centro Agrícola, vol. 40, no. 2, 2013, pp. 79-84, ISSN 2072-2001.
2. Ordookhani, K.; Khavazi, K.; Moezzi, A. y Rejali, F. “Influence of PGPR and AMF on antioxidant activity, lycopene and potassium contents in tomato”. African Journal of Agricultural Research, vol. 5, no. 10, 31 de mayo de 2010, pp. 1108-1116, ISSN 1991-637X.
3. Fernández-Larrea, V. “Programa para la recuperación de bioplaguicidas, biofertilizantes y bioestimulantes en Cuba”. Agricultura Orgánica, no. 2, 2013, pp. 2-5, ISSN 1028-2130.
4. Falcón-Rodríguez, A.; Costales, D.; Cabrera, J. C. y Martínez-Téllez, M. A. “Chitosan physico–chemical properties modulate defense responses and resistance in tobacco plants against the oomycete Phytophthora nicotianae”. Pesticide Biochemistry and Physiology, vol. 100, no. 3, 2011, pp. 221-228, ISSN 0048-3575, DOI 10.1016/j.pestbp.2011.04.005.
5. Mansilla, A. Y.; Albertengo, L.; Rodríguez, M. S.; Debbaudt, A.; Zúñiga, A. y Casalongué, C. A. “Evidence on antimicrobial properties and mode of action of a chitosan obtained from crustacean exoskeletons on Pseudomonas syringae pv. tomato DC3000”. Applied Microbiology and Biotechnology, vol. 97, no. 15, 2013, pp. 6957-6966, ISSN 0175-7598, 1432-0614, DOI 10.1007/s00253-013-4993-8.
6. Badawy, M. E. I. y Rabea, E. I. “A Biopolymer Chitosan and Its Derivatives as Promising Antimicrobial Agents against Plant Pathogens and Their Applications in Crop Protection”. International Journal of Carbohydrate Chemistry, vol. 2011, 2011, pp. 1-29, ISSN 1687-9341, 1687-935X, DOI 10.1155/2011/460381.
7. Shehata, S. A.; Fawzy, Z. F. y El-Ramady, H. R. “Response of cucumber plants to foliar application of chitosan and yeast under greenhouse conditions”. Australian Journal of Basic and Applied Sciences, vol. 6, no. 4, 2012, pp. 63–71, ISSN 1991-8178.
8. Lizárraga, P. E. G.; Miranda, C. S. P.; Moreno, M. E.; Lara, S. A. V. y Torres, P. I. “Maize seed coatings and seedling sprayings with chitosan and hydrogen peroxide: their influence on some phenological and biochemical behaviors”. Journal of Zhejiang University SCIENCE B, vol. 14, no. 2, 2013, pp. 87-96, ISSN 1673-1581, 1862-1783, DOI 10.1631/jzus.B1200270.
9. Casanova, A.; Gómez, O.; Cardoza, H.; Piñeiro, F.; Hernández, C.; Murguido, A.; Fundora, L. y Hernández, A. Guía técnica para la producción del cultivo del tomate. 2.a ed., Ed. Instituto de Investigaciones Hortícolas Liliana Dimitrova, 2010, La Habana, Cuba, 57 p., ISBN 978-959-7210-07-8, Biblioteca ACTAF.
10. Hernández, J. A.; Pérez, J. M.; Bosch, D.; Rivero, L.; Camacho, E.; Ruíz, J.; Salgado, E. J.; Marsán, R.; Obregón, A.; Torres, J. M.; Gonzáles, J. E.; Orellana, R.; Paneque, J.; Ruiz, J. M.; Mesa, A.; Fuentes, E.; Durán, J. L.; Pena, J.; Cid, G.; Ponce de León, D.; Hernández, M.; Frómeta, E.; Fernández, L.; Garcés, N.; Morales, M.; Suárez, E. y Martínez, E. Nueva versión de clasificación genética de los suelos de Cuba. Ed. AGROINFOR, 1999, La Habana, Cuba, 64 p., ISBN 959-246-022-1.
11. Paneque, P. V. M.; Calaña, N. J. M.; Calderón, V. M.; Borges, B. Y.; Hernández, G. T. C. y Caruncho, C. M. Manual de técnicas analíticas para análisis de suelo, foliar, abonos orgánicos y fertilizantes químicos [en línea]. Ed. Ediciones INCA, 2010, La Habana, Cuba, 157 p., ISBN 978-959-7023-51-7, [Consultado: 27 de enero de 2016], Disponible en: <http://mst.ama.cu/578/>.
12. Echevarría, H. A.; Cruz, T. A.; Rivero, G. D.; Rodríguez, P. A. T.; Ramírez, A. M. A. y Cárdenas, T. R. M. “Actividad antifúngica de la quitosana en el crecimiento micelial y esporulación del hongo Pyricularia grisea Sacc”. Cultivos Tropicales, vol. 33, no. 3, 2012, pp. 80-84, ISSN 0258-5936, 1819-4087.
13. González, P. D.; Costales, D. y Falcón, A. B. “Influencia de un polímero de quitosana en el crecimiento y la actividad de enzimas defensivas en tomate (Solanum lycopersicum L.)”. Cultivos Tropicales, vol. 35, no. 1, 2014, pp. 35-42, ISSN 0258-5936.
14. Badii, M. H. J.; Castillo, A. G. y Guillén, A. “Tamaño óptimo de la muestra”. Innovaciones de Negocios, vol. 5, no. 1, 2008, pp. 53–65, ISSN 1665-9627.
15. Duncan, D. B. “Multiple Range and Multiple F Tests”. Biometrics, vol. 11, no. 1, 1 de marzo de 1955, pp. 1-42, ISSN 0006-341X, DOI 10.2307/3001478.
16. StatPoint Technologies. Statgraphics Centurion [en línea]. (ser. Centurion), versión 16.1 (XV), [Windows], 21 de mayo de 2010, Disponible en: <http://statgraphics-centurion.software.informer.com/download/>.
17. Terry, E. A.; Terán, R.; Martínez-Viera, R. y Pino, M. A. “Biofertilizantes, una alternativa promisoria para la producción hortícola en organopónicos”. Cultivos Tropicales, vol. 23, no. 3, 2002, pp. 43-47, ISSN 0258-5936, 1819-4087.
18. Kowalski, B.; Terry, F. J.; Herrera, L. y Agramonte, P. D. “Application of Soluble Chitosan in vitro and in the Greenhouse to Increase Yield and Seed Quality of Potato Minitubers”. Potato Research, vol. 49, no. 3, 2006, pp. 167-176, ISSN 0014-3065, 1871-4528, DOI 10.1007/s11540-006-9015-0.
19. González, F.; Casanova, A.; Hernández, A.; Méndez, M.; González, R. y Delgado, A. “Efecto de la aplicación de Biobras-16 en la producción de plántulas injertadas de tomate (Lycopersicon esculentum Mill)”. Temas de Ciencia y Tecnología, vol. 10, no. 30, 2006, pp. 53–63, ISSN 2007-0977.
20. El-Mohamedy, R. S.; Abdel-Kader, M. M.; Abd-El-Kareem, F. y El-Mougy, N. S. “Inhibitory effect of antagonistic bio-agents and chitosan on the growth of tomato root rot pathogens in vitro”. Journal of Agricultural Technology, vol. 9, no. 6, 2013, pp. 1521–1533, ISSN 1686 - 9141.
21. Jabeen, N. y Ahmad, R. “The activity of antioxidant enzymes in response to salt stress in safflower (Carthamus tinctorius L.) and sunflower (Helianthus annuus L.) seedlings raised from seed treated with chitosan: Enzyme activity in seedlings from chitosan-treated seed”. Journal of the Science of Food and Agriculture, vol. 93, no. 7, 2013, pp. 1699-1705, ISSN 00225142, DOI 10.1002/jsfa.5953.
22. Rodríguez, A.; Acosta, A. y Rodríguez, C. “Fungicide resistance of Botrytis cinerea in tomato greenhouses in the Canary Islands and effectiveness of non-chemical treatments against gray mold”. World Journal of Microbiology and Biotechnology, vol. 30, no. 9, 2014, pp. 2397-2406, ISSN 0959-3993, 1573-0972, DOI 10.1007/s11274-014-1665-5.
23. Sathiyabama, M.; Akila, G. y Charles, R. E. “Chitosan-induced defence responses in tomato plants against early blight disease caused by Alternaria solani (Ellis and Martin) Sorauer”. Archives Of Phytopathology And Plant Protection, vol. 47, no. 16, 2014, pp. 1963-1973, ISSN 0323-5408, 1477-2906, DOI 10.1080/03235408.2013.863497.
24. Lizárraga-Paulín, E. G.; Torres-Pacheco, I.; Moreno-Martínez, E. y Miranda-Castro, S. P. “Chitosan application in maize (Zea mays) to counteract the effects of abiotic stress at seedling level”. African Journal of Biotechnology, vol. 10, no. 34, 2011, pp. 6439-6446, ISSN 1684-5315.
25. Hadwiger, L. A. “Multiple effects of chitosan on plant systems: Solid science or hype”. Plant Science, vol. 208, 2013, pp. 42-49, ISSN 0168-9452, DOI 10.1016/j.plantsci.2013.03.007.
Recibido: 01/03/2016
Aceptado: 24/05/2016
Dra.C. Elein Terry Alfonso, Instituto Nacional de Ciencias Agrícolas (INCA). Gaveta postal No.1, San José de las Lajas. Mayabeque, Cuba. CP 32700. Email: terry@inca.edu.cu