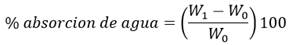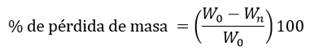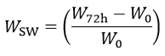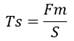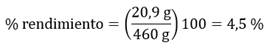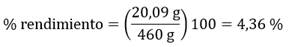Introducción
En 2022 la OMS reportó que en el mundo mueren, el 83 % de las personas por enfermedades no transmisibles (ENT) y dentro de esa cifra un 17 % pertenecen a muerte súbita por enfermedades vasculares [1].
Las arterias son el canal de irrigación del cuerpo humano. Cada una de ellas cumple una función específica y según esta, son las características morfológicas, mecánicas, físicas y químicas que poseen.
La arteria aorta es la más gruesa de todo el sistema. La misma se encuentra a la salida del corazón por lo que sus características mecánicas a la compresión y tracción suelen ser lo suficientemente elevadas, con respecto a las demás, para poder soportar la potencia de flujo con que sale la sangre hacia el canal de irrigación. Aunque su morfología es estándar, ya que todas poseen tres capas, la íntima, la media y la adventicia; su composición suele ser diferente a medida que se aleja del corazón [2]. La capa más externa de la pared arterial es la adventicia y está compuesta por colágeno, tejido conectivo y fibras elásticas. La capa del medio es la media que consiste en músculo liso dispuesto de forma circunferencial y más fibras elásticas. La intima es la capa más interna y está compuesta por una monocapa de células endoteliales, que provee una estructura compleja que permite la conducción de la sangre de manera estable [3].
La arteria aorta abdominal, que tiene un diámetro aproximadamente entre 20 y 25 mm [4] posee entre otros compuestos colágeno tipo 1, colágeno tipo 3, elastina, fibrina, ácido hialurónico, etc. Esta ocupa el tramo más largo de toda la arteria aorta y es propensa a formar aneurismas en diferentes variantes [5].
Los aneurismas son una de las causas de muerte silenciosa más frecuentes a nivel mundial. Los de aorta abdominal se manifiestan como el aumento del 50 % de diámetro de la arteria [6]; esta enfermedad es fatal si no se realiza un diagnóstico diferencial oportuno y tratamiento estable.
Muchos de estos tratamientos se realizan reparando o restableciendo la parte dañada de la arteria con diferentes métodos. Uno de estos métodos es colocar un andamio tubular en sustitución del tramo de arteria dañada, para que las células autólogas lo recubran y se regenere por sí solo.
A nivel mundial existen diferentes formas de obtener andamios que se han dedicado a la reconstrucción de arterias, que, aunque son funcionales, no cumplen con los requerimientos de la arteria humana. Entre estos están el método de gelificación por centrifugación, liofilización, descelularización y electrohilado, por citar algunos [7]. En estos, se utilizan diferentes materiales, pero el más recurrente ha sido el colágeno, por ser el soporte natural de la matriz extracelular y ocupar el 30 % del cuerpo humano [8]. Entre los primeros trabajos que se encuentran reportados en la literatura sobre andamos para sustituir arterias, están los de Weinberg y Bell [9], los que lograron un andamio de colágeno tipo 1, que, aunque poseía pobres características mecánicas, al ser implantado fue regenerado autólogamente, en un modelo animal. Este andamio fue, más adelante, mejorado mecánicamente por [10, 11, 12], entre otros, los que introdujeron otros componentes de la matriz extracelular en el ndamio mejorando sus características químicas, físicas, morfológicas y mecánicas.
En Cuba se ha trabajado sobre esta línea logrando andamios de colágeno tipo 1 obtenido de las crestas y patas del pollo y la piel de cerdo, variando los moldes y utilizando el método de liofilización [13], en busca de mejorar las características mecánicas y morfológicas de estos para la reparación del miocardio y arterias aortas. Es por este motivo que el objetivo de este trabajo es construir andamios tubulares, con colágeno obtenido de piel de cerdo y patas de pollo, para caracterizarlos y considerar su empleo en la regeneración de la arteria aorta.
Métodos y Materiales
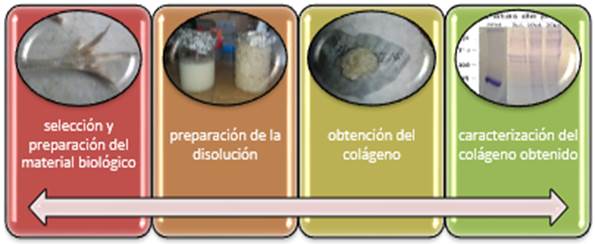
Este trabajo se divide en tres etapas, posee una metodología general y dentro de esta, varios pasos, para hacer cumplir el objetivo final que es caracterizar los andamios que se obtengan para su uso en ingeniería de tejido vascular. Para cada etapa se realizaron los pasos siguientes utilizando los materiales que a continuación se relacionan.
Paso 1. Obtención del colágeno y caracterización.
Obtención de colágeno
En esta etapa se utilizaron 460 g de patas de pollo y 460 g de piel de cerdo como material biológico para la extracción del colágeno. En su preparación una trituradora, ácido acético al 30 %, agua destilada, cloruro de sodio 100 % (NaCl), papel de filtro o filtro para dializado, tubos de ensayo desechables, cristalería de laboratorio, centrifuga y una balanza. Los pasos seguidos para la obtención del colágeno y su caracterización se muestran en la figura 1 y se describen seguidamente.
Las patas de pollo y la piel de cerdo se lavaron con una solución salina, alcohol al 95 % y agua destilada para eliminar impurezas y grasa. Se cortaron en pequeños trozos para lograr que se disuelva con mayor facilidad en el ácido acético, triturándolos. Se eliminó la grasa en la materia prima empleando alcohol al 95 % y agua destilada. La solubilización se realizó uniendo por separado las distintas proporciones de materiales a trabajar (cerdo y patas de pollo), con una solución de ácido acético al 30 %. Estas se conservaron a una temperatura de 4 °C durante 72 horas con agitación intermitente. A las 72 horas se filtró la disolución en tamices de 1 mm por decantación. El tejido retenido en el filtro se desecha o disuelve nuevamente en ácido acético para obtener más masa gelatinosa. Esta solución se centrifuga por dos ocasiones. La primera centrifugación se realizará a 4000 rpm durante 40 min para separar el disolvente de la masa gelatinosa obtenida del proceso de decantación y filtrado. La segunda se hace para obtener el colágeno disuelto en el precipitado. Al sobrenadante extraído de la primera centrifugación se le aplicó un 5 % de NaCl en granos mientras se agitaba magnéticamente durante 2 horas. Se centrifugó nuevamente 20 min a 2500 rpm y se eliminó el líquido por decantación y filtrado. Un dializado posterior se realizó en agua destilada para eliminar el NaCl.
Prueba de electroforesis SDS-page y espectroscopia infrarroja por transformada de Fourier
Al colágeno obtenido se le realizó una prueba de electroforesis de proteínas SDS-PAGE. Mediante esta prueba se puede determinar el tipo de colágeno presente en la muestra. Siguiendo el procedimiento empleado por Sotelo [14], se prepararon las muestras a analizar estimando el peso del contenido de cada tubo de muestra en balanza de precisión. Se restó dicho peso al de un vial vacío y se calculó el volumen necesario de buffer sample 2x, resuspendiendo cada pellet para que las muestras quedaran a 50 µg/100 µl. Se empleó minigel de 10 cm x 10 cm al 6 %, aplicándole a la muestra una corriente de 65 mA y una tensión de 200 V.
La espectroscopía infrarroja por transformada de Fourier (FTIR) se realizó a un fragmento de la muestra de colágeno, al cual se le administró una radiación infrarroja desde 600 hasta 4000 1/cm. Este método llamado por reflexión, fue aplicado a la muestra de colágeno antes del liofilizado. Esto es muy útil para poder identificar la composición de una muestra, y se representa de manera visual en forma de gráfico de transmitancia vs longitud de onda.
Cálculo del rendimiento
El rendimiento se calculó mediante la ecuación (1) [13].
Paso 2 Obtención de Andamios
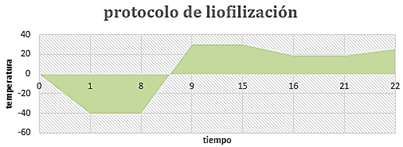
Para obtener los andamios se realizó un proceso de liofilización, utilizando moldes cuyo prototipo se presenta en la figura 2. Estos poseen un diámetro de 20 mm entre las paredes exteriores, un núcleo también metálico y una altura de 50 mm. La holgura entre el núcleo y la camisa se fijó en los valores de 0,1; 0,5 y 1 mm.
El liofilizado se realizó durante 22 horas, el cual consta de tres etapas. La congelación a una temperatura de -40 oC y un tiempo de 7 horas. El secado primario a una temperatura de 19 oC durante 5 horas y el enfriamiento final hasta la temperatura ambiente. El proceso en su totalidad se observa en la gráfica de la figura 3.
Paso 3. Caracterización del andamio
Se realizó una caracterización porosa superficial mediante un microscopio óptico CB2000CF con lente 10x. Se realizaron pruebas de biodegradabilidad, swelling y absorción de agua, para las que se utilizaron una desecadora, pipeta, Buffer fosfato salino (PBS) de ph 7, porta muestra, agua destilada, balanza analítica Kern ABT 220-4M y un cuarto de incubación a 37 grados. Se realizó una prueba de resistencia máxima del material en la sección circular del andamio tubular, utilizando una máquina de tracción M01 desarrollada por nuestro equipo de trabajo.
La prueba de absorción de agua se basa en el cálculo de la diferencia entre el pesaje inicial y el final luego de haber sometido a la muestra a sumergirse en agua por tiempo determinado. Esta diferencia es calculada por la ecuación (2):
Donde:
W 1 |
masa del andamio después de x tiempo en agua destilada. |
W 0 |
masa inicial del andamio (muestra seca). |
La biodegradabilidad se realiza cortando una muestra del andamio e introduciéndola en PBS por espacio de 72 horas en incubación, a temperatura de 37 ºC. Se saca luego de este tiempo y se pesa. Luego se coloca por x de tiempo en una desecadora, pesando la muestra en estado seco. Se calcula la pérdida de masa a través de la ecuación (3):
Donde:
W n |
masa seca del andamio después de n horas de incubación en solución búfer salina. |
W 0 |
masa inicial del andamio . |
Para calcular el índice de hinchamiento o swelling pesamos la muestra seca y la sometemos, por un tiempo de 72 horas, a estar inmersa en la solución a 37 ºC de temperatura, se pesa y se calcula el índice de hinchamiento por la ecuación (4):
Esta prueba a diferencia de la de absorción de agua utiliza como medio de humectabilidad un ácido o una base y no se calcula en porciento sino en índice de hinchamiento.
La resistencia máxima del material se obtiene mediante la rotura por tracción de una muestra obtenida de la sección circunferencial del andamio en forma de tubo. El valor de la fuerza dado por la celda de carga se divide por el área de la sección transversal de la muestra. Este parámetro se calcula mediante la ecuación (5):
Resultados
Paso 1. Obtención del colágeno y caracterización
Se obtuvieron dos muestras de colágeno, una de la piel de cerdo y la otra de las patas de pollo, como se muestra en las figura 4 a y b.
 Fuente: elaboración propia
Fuente: elaboración propiaFig. 4 Muestras de colágeno obtenido, a) colágeno obtenido de la piel de cerdo, b) colágeno obtenido de las patas del pollo.
Prueba de electroforesis de proteínas SDS-PAGE y FTIR
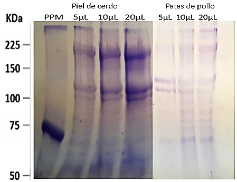
En la figura 5 se muestran las electroforesis realizadas a los colágenos de patas y cerdo obtenidos mediante el proceso de extracción ácida, en ella se observan 2 bandas cercanas entre los 100 y 130 KDa que corresponden a cadenas α y una banda cercana a los 225 KDa que representan cadenas β. Las bandas que se observan por sobre los 225 KDa pertenecen a los trímeros ϒ.
 Fuente: elaboración propia
Fuente: elaboración propiaFig. 5 Pruebas de electroforesis de proteínas SDS-page, de colágeno obtenido de piel de cerdo y patas de pollo.
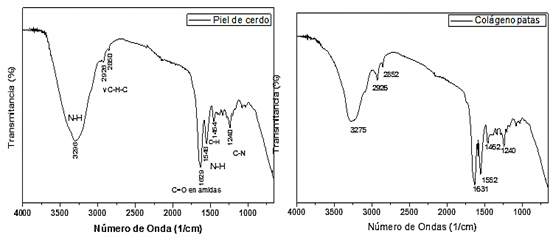
Las pruebas de FTIR realizadas se presentan en la figura 6, en ella se destacan para patas de pollo, como amida A (32751/cm), B (2926 1/cm), I (1631 1/cm), II (1552 1/cm), III (1240 1/cm) y para piel de cerdo como la amida A (3296 1/cm), B (2926 1/cm), I (1629 1/cm), II (1548 1/cm), III (1240 1/cm).
 Fuente: elaboración propia
Fuente: elaboración propia Fig. 6 Prueba de FTIR realizadas al colágeno obtenido de piel de cerdo y patas de pollo.
Cálculo del rendimiento
De 460 g de patas de pollo en disolución de ácido acético al 30 % se obtuvieron 20,9 g de colágeno.*
De 460 g de piel de cerdo en disolución de ácido acético al 30 % se obtuvieron 20,09 g de colágeno.**
Paso 2. Obtención de Andamios
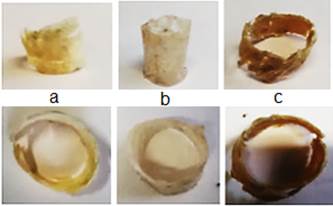
En la figura 7 se observan tres andamios, de ellos, dos corresponden a andamios realizados con patas de pollo, a) y c) y uno realizado con piel de cerdo.
Paso 3. Caracterización del andamio
Las pruebas de absorción de agua, biodegradabilidad y swelling se realizaron con los andamios de pared de 0,1 mm y 0,5 mm de espesor. Se utilizaron en la prueba de tensión superficial y la microscopía muestras de los tres andamios.
Prueba de absorción de agua, biodegradabilidad y swelling
La absorción se realizó introduciendo las muestras secas de los andamios mencionados anteriormente, en agua destilada por un tiempo de 2 h. La muestra del andamio de patas de pollo tenía un peso inicial de 0.04 g, el que al humedecerse aumentó a 0,42 g para un porciento de absorción de agua de un 950 %. La del andamio de piel de cerdo tenía un peso inicial de 0.017 g alcanzando un peso húmedo de 0,16 g y un porciento de absorción de agua de 841 %.
La biodegradabilidad se aplicó a muestras de 4 mm2. Las de patas de pollo tenían un peso seco de 0,1 g y un peso húmedo de 0,34 g, al finalizar las 72 h de su puesta en la desecadora alcanzó un peso de secado de 0,08 g. Esto al aplicar la fórmula para hallar porciento de pérdida de masa le otorga un 20 %. Para el andamio construido con piel de cerdo la muestra inicial pesaba 0,02 g, al humedecerse alcanzó 0,21 g y luego de 72 h en la desecadora su peso disminuyó a 0,004 g, lo que le otorga un porciento de pérdida de masa del 80 %.
En el swelling el andamio de patas de pollo tuvo un peso seco de 0,1 g y alcanzó una humectación de 0,34 g para un índice de hinchamiento de 2,4. Para la muestra del andamio de cerdo, que inicialmente poseía un peso de 0,02 g, y que después de sumergida alcanzó 0,21 g, el índice de hinchamiento llegó a ser de 9,5.
Morfología superficial
La morfología superficial se muestra en la figura 8.
 Fuente: elaboración propia
Fuente: elaboración propiaFig. 8 Morfología superficial de los andamios con objetivo 10X. Andamio de patas de pollo 1 mm, a) corte longitudinal de la pared, b) superficie externa. Andamio de colágeno de cerdo, c) corte longitudinal de la pared, d) superficie externa. Andamio de patas de pollo 0,5 mm de pared, e) superficie externa, f) corte longitudinal de la pared.
Resistencia máxima del material
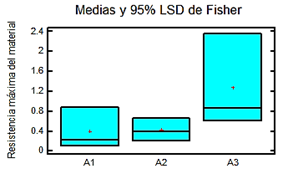
En esta prueba se tuvieron en cuenta los tres andamios a los que se le realizaron tres réplicas por cada uno, de la manera descrita en materiales y métodos y mostrada en la figura 9 cuyos valores aparecen en la tabla 1.
 Fuente: elaboración propia
Fuente: elaboración propia Fig. 9 Imagen que muestra realización de la prueba de resistencia máxima del material a los andamios.
Aplicando un análisis estadístico con el programa ANOVA se obtuvieron los datos mostrados en la tabla 1 y la figura 10. Donde A1 es el andamio de patas de 1mm de espesor, A2 es el andamio de patas de 0,5 mm y A3 es el andamio de cerdo.
Tabla 1 Valores obtenidos en la prueba de resistencia máxima del material, el promedio, la varianza y la desviación estándar obtenidos a través del ANOVA. Fuente: elaboración propia
| Pruebas de resistencia máxima del material ( |
Andamio de colágeno de patas de 1mm (MPa) | Andamio de colágeno de patas 0,5 mm (MPa) | Andamio de colágeno de cerdo 0,1 mm (MPa) |
|---|---|---|---|
| Prueba 1 | 0,085 | 0,20 | 0,85 |
| Prueba 2 | 0,225 | 0,66 | 2,35 |
| Prueba 3 | 0,875 | 0,40 | 0,61 |
| Promedio | 0,395 | 0,42 | 1,27 |
| Desviación standard | 0,421545 | 0,230651 | 0,942974 |
| Varianza | 0,1777 | 0,0532 | 0,8892 |
Discusión
Como se observa en la figura 4 el colágeno obtenido no difiere en color, ni textura para ninguno de los dos tejidos biológicos utilizados. Ambos poseen un rendimiento bajo, si se compara con el rendimiento obtenido por [15] 31,23 %, [16] 12,63 % y [17] 14,49 %, para patas de pollo en disolución de ácido acético y por [18], cuyas extracciones en diferentes métodos fueron 23 %, 40 % y 20 % para la piel de cerdo.
En la prueba de electroforesis de proteínas se confirma la presencia de colágeno tipo 1 para ambas muestras, cuyo patrón es característico para las cadenas α1 y α2 entre 100 y 130 kDa y para las cadenas β entre 200 y 250 kDa. Es conocido que cada tejido biológico representa un patrón electroforético según el tipo de animal, zona del cuerpo y condiciones ambientales donde se desarrolla el mismo. Para el caso del pollo el patrón electroforético representado es para las cadenas α1 de 130 kDa, cadenas α2 de aproximadamente 120 kDa y las cadenas β sobre los 220 kDa, el mismo está acorde con los obtenidos por [15] y [19] en sus trabajos de obtención de colágeno de patas de pollo. En el caso del colágeno obtenido de la piel de cerdo la aparición de cadenas α1 entre 115 y 120 kDa, cadenas α2 entre los 100 y 110 kDa y β sobre los 220 kDa tiene concordancia con los reportes realizados por [20, 21].
La presencia del colágeno queda confirmada por los resultados de la prueba de FTIR, donde se exhibe un patrón de bandas que concuerdan con la disposición de una proteína. Este patrón, que se divide en dos partes, representa a la amida a característica entre (3400-3300 cm-1) y b entre (3100-2800 cm-1) las que pertenecen a la primera y las amidas I entre (1700-1600 cm-1), II entre (1550-1300 cm-1) y III entre (1250-1000 cm-1) que pertenecen a la segunda. Estas últimas son las que delimitan la configuración del colágeno y poseen la llamada huella dactilar que define el tipo de colágeno entre los valores (1250-1600 cm-1), reportándose el colágeno tipo I entre (1250-1100 cm-1) [22]. Para las muestras en estudio esto se cumple en ambos casos con una representación de su huella dactilar en picos de 1240 1/cm, coincidiendo con los valores reportados por [18, 23, 24].
Los andamios obtenidos se observan en la imagen de la figura 7. Se puede presenciar que los andamios a y b, poseen una coloración más clara que el que se exhibe en la figura 7c. Esto pudiera deberse a un parámetro denominado luminosidad (L) que se incrementa cuando se liofiliza una muestra de origen natural [25]. Este parámetro, que se define como el flujo de luz en una dirección dada y depende del número y la orientación de las superficies reflectantes de esta, aunque incentiva la diferencia de color, depende de factores como la velocidad de congelación. Según [25] como la congelación rápida genera cristales pequeños y orientados al azar, la luminosidad de los productos que se congelan con mayor rapidez, es mayor que la de productos con congelación más lenta. En el caso que nos ocupa se utilizó la misma temperatura de congelación (-40 ºC) y el mismo material para la confección del molde, pero el espesor de la pared de los andamios fue diferente, por lo que existe la posibilidad que el andamio de espesor 1 mm, figura 7c, se congelará a menor velocidad que los demás, obteniendo una coloración menos luminosa.
Lo que se demuestra a través de la microscopía superficial donde existen diferencias en la disposición de los poros, observándose una mayor cantidad de estos y de menor tamaño, en el andamio de cerdo (0,1mm) figura 8c y 8d, sobre la superficie. De igual manera pasa con el andamio de patas de pollo de pared 0,5 mm de espesor figura 8e y 8f, donde se observa una mayor cantidad de poros que en el de 1mm de espesor figura 8a y 8b.
Para las pruebas de absorción de agua, el andamio de colágeno de patas de pollo alcanzo un mayor valor de humectabilidad (950 %), para una diferencia entre ambos andamios de 109 %, esta capacidad le aporta mejoras en las características mecánicas al andamio, debido a que al absorber más liquido le da la posibilidad de amortiguar hidráulicamente mayores cargas. Los porcientos alcanzados en esta prueba para los andamios, están acorde con los obtenidos por [26] en sus trabajos para andamios de colágeno que fueron entre 950 y 1700 %.
Por su parte la biodegradabilidad y el hinchamiento fueron medidos en un tiempo de 72 h. Estos resultaron de mayor valor en el andamio construido con colágeno de piel de cerdo para una diferencia entre ellos de 60 % en la biodegradabilidad y 7,1 de índice de hinchamiento. El tiempo de biodegradación es de importante conocimiento para la regeneración celular. En este caso mientras menor sea el porciento de degradación, significa que es más lenta, por lo que mejores prestaciones puede aportar el andamio para el objetivo final, pues autores como [24], han reportado que la regeneración celular de la arteria aorta, suele suceder entre las 4 y 5 semanas.
La resistencia máxima del material realizada a los andamios muestran una tendencia a ser menor en el caso de las patas de pollo, aunque no existe una diferencia significativa calculada dentro de un 95 % de confianza, según datos aportados por el análisis estadístico, aun cuando son obtenidos de diferentes tejidos naturales. Esto puede deberse a que el espesor de la pared del andamio de colágeno de piel de cerdo, es mucho más fino lo que propicia la formación de gran cantidad de núcleos de solidificación durante la etapa de congelamiento (freezing). Esto provoca que durante el cambio de fase sólida a gaseosa tengamos la presencia de poros muy pequeños y menos interconectados, con esto un incremento importante en la resistencia a la rotura del biomaterial, o también puede deberse a la orientación obtenida por la fibra dentro del molde. Podemos afirmar esto ya que autores como [27] demostraron que la resistencia máxima del material depende del alineamiento de la fibra y la dirección que se tome para realizar la prueba, proponiendo valores de resistencia desde 0,77 hasta 4,64 MPa aproximadamente para andamios de colágeno cuya prueba se realizó de manera uniaxial longitudinalmente.
Algunos autores reportan valores de resistencia máxima en andamios para arterias de 1,30 MPa [28] coincidiendo con el del andamio de cerdo obtenido. Otros reportan 0,344 MPa en andamios para reparación de válvula aortica [29] y 0,021 MPa para el tejido natural del miocardio [30] que respaldan la resistencia máxima que presentaron los andamios de patas de pollo. No obstante, reportes hechos por autores como [31] alcanzan los 2,79 MPa, por [32] los 2,9 MPa y [33] los 2,4 MPa.
Conclusiones
Se obtuvieron andamios tubulares construidos a partir del colágeno extraído de la piel de cerdo y de las patas de pollo. En la caracterización de los mismos se demostró la presencia de colágeno del tipo I en todos los casos, destacándose que aquellos obtenidos a partir de las patas de pollo tienen mayor absorción, menor resistencia mecánica, un bajo índice de hinchamiento y son menos propensos a la biodegradabilidad con relación a los andamios de piel de cerdo. Las características de los andamios obtenidos permiten considerarlos para su uso en la regeneración de arterias.