INTRODUCCIÓN
La propagación in vitro de malanga (Colocasia o Xanthosoma) tiene gran importancia económica ya que permite proveer de semilla de alta calidad genética y sanitaria a los productores. Generalmente el material vegetal inicial son yemas axilares o ápices meristemáticos (Yam et al., 1990; García et al., 1999; Rodríguez et al., 2003; Verma y Cho, 2010; Nath et al., 2012; Medero et al., 2016). Sin embargo, las técnicas de propagación in vitro han tenido limitaciones debido a la contaminación microbiana, principalmente por bacterias (Hernández et al., 2005; Folgueras, 2006; Carrazana et al., 2011; Vilchez et al., 2011; Hossain, 2012; Santos et al., 2015).
Estos contaminantes causan pérdidas económicas en las industrias de cultivo de tejidos vegetales. Unido a ello, la manipulación incorrecta del material vegetal y un medio ambiente no estéril aumentan la tasa de contaminación microbiana (Leelavathy y Sankar, 2016; Orlikowska et al., 2017).
En este contexto, para reducir las pérdidas por la presencia de contaminantes bacterianos en el cultivo in vitro de malanga se han referido diferentes estrategias. Entre ellas se menciona el cultivo de las plantas madre en un sustrato estéril (Keolanui et al., 1993), el uso de antibióticos (Rodríguez et al., 2003), la aplicación de electroterapia (Vilchez et al., 2011) o no eliminar las plantas contaminadas con bacterias (Carrazana et al., 2011). Otros autores como Santos et al. (2015) comprobaron que el empleo de meristemos disminuye su incidencia. Sin embargo, también se ha considerado que la aplicación de medidas para la prevención y el manejo de la contaminación microbiana en el cultivo in vitro de plantas suelen ser más efectivas, duraderas y económicas (Leifert et al., 1994; Leifert y Cassells, 2001; Alvarado-Capó, 2003). Este enfoque no ha sido empleado de forma rutinaria en la propagación in vitro de malanga.
Atendiendo a lo anterior, el objetivo de este trabajo fue demostrar que la inclusión de acciones para el manejo de la contaminación bacteriana en la propagación in vitro de C. esculenta cv. ‘INIVIT MC-2012’ a partir de explantes de campo, puede reducir las pérdidas por este concepto.
MATERIALES Y MÉTODOS
Material vegetal
Se emplearon rizomas primarios de Colocasia esculenta (L.) Schott cv. ‘INIVIT MC-2012’, proveniente del Banco de Germoplasma del INIVIT donde se siguieron las indicaciones del Instructivo Técnico de la Malanga (MINAG, 2012) para las atenciones agronómicas. Los rizomas cumplían con las características fenotípicas de los descriptores de la especie y cultivar (Medero et al., 2014), no presentaban síntomas visuales de enfermedades y fueron cosechados después de 12 meses de cultivo en campo (Figura 1).
Se comparó la incidencia de contaminantes bacterianos en las fases de establecimiento y multiplicación de C. esculenta con el empleo de dos protocolos de propagación in vitro a partir de rizomas primarios de plantas cultivadas en campo.
El primero, propuesto por García et al. (1999) y el segundo, este mismo protocolo modificado por Gutierrez et al. (2017) que incluye pasos en el procedimiento para el manejo de la contaminación bacteriana.
Para cada protocolo se partió de 20 rizomas primarios de los cuales se extrajeron al menos dos yemas axilares. De cada una se estableció una línea que se conformó por todos los explantes que se derivaron de ella y que se manejaron en cada subcultivo separados de otras líneas.
Los subcultivos se realizaron cada 18 días en cámara de crecimiento a 26±2 °C, con luz continua blanca fluorescente (150 μmol m-2 s-1) y fotoperíodo 16 horas luz (Medero et al., 2015).
En cada subcultivo (establecimiento y tres subcultivos de multiplicación) se cuantificó el número de explantes contaminados con bacterias (por observación visual de los recipientes de cultivo y comprobación de la presencia del grupo microbiano en observaciones directas al microscopio óptico, 400x y 1000x). Se calculó el porcentaje de contaminación bacteriana con respecto al total de explantes al inicio del subcultivo. Todos los explantes contaminados se eliminaron del proceso.
RESULTADOS Y DISCUSIÓN
La contaminación bacteriana se observó en el medio de cultivo debajo de los explantes o alrededor de estos lo que coincidió con descripciones previas en el cultivo in vitro de malanga (Carrazana et al., 2011; Gutierrez et al., 2015). De forma general, los caracteres culturales del crecimiento bacteriano fueron similares en todos los explantes de una misma línea lo que apunta al explante inicial como fuente primaria de contaminación.
Con la aplicación del protocolo para la propagación in vitro de C. esculenta a partir de rizomas de plantas cultivadas en campo (García et al., 1999) modificado por Gutierrez et al. (2017) se redujo el porcentaje de pérdidas por contaminación bacteriana en todos los subcultivos evaluados (Figura 2), con cero contaminantes visibles en los dos primeros de multiplicación. Este protocolo incluye como aspectos esenciales para el manejo de la contaminación bacteriana la reducción del tamaño del explante (empleo de yemas axilares de 0.3-0.5 cm), el cultivo individual de los explantes en la fase de establecimiento in vitro en tubos de ensayo con un explante en cada uno, un protocolo para la detección visual de contaminantes bacterianos previo a cada subcultivo, el trabajo por líneas a partir de cada explante inicial hasta el tercer subcultivo de multiplicación, medidas de asepsia y procedimientos para el uso del instrumental y la capacitación del personal en la temática contaminación microbiana en el cultivo in vitro de plantas.
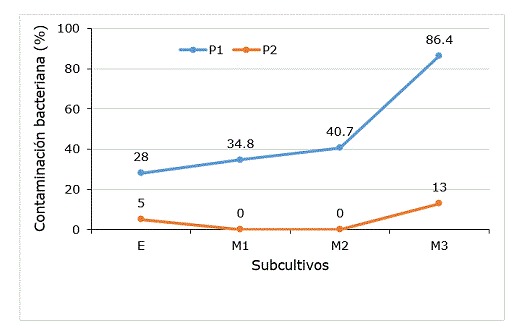
Figura 2 Incidencia de contaminación bacteriana en el establecimiento y multiplicación in vitro de yemas axilares de Colocasia esculenta INIVIT MC-2012 con el empleo de dos protocolos de propagación. E establecimiento, M multiplicación, P protocolo de propagación, P1 García et al. (1999), P2 García et al. (1999) modificado por Gutierrez et al. (2017).
Aunque en este trabajo se emplearon explantes iniciales procedentes de campo la contaminación bacteriana no rebasó el 5% en el establecimiento in vitro. La reducción del tamaño del explante inicial es una de las modificaciones que se introdujeron en el protocolo propuesto por García et al. (1999) y que contribuyó a que disminuyeran las pérdidas en más de un 20%. En este cultivar, Santos et al. (2015) demostraron que la utilización de meristemos extraídos de rizomas brotados en zeolita reduce la incidencia de contaminantes. Sin embargo, el porcentaje de regeneración de plantas a partir de meristemos en muchas ocasiones es limitado. La posibilidad de poder emplear yemas axilares de material vegetal diagnosticado como libre de virus, directo de campo, sin alta incidencia de contaminantes bacterianos, es una alternativa para la propagación de plantas in vitro (Rodríguez et al., 2003).
Por otra parte, la detección de contaminantes bacterianos previo al subcultivo de los explantes con un protocolo definido y el entrenamiento del personal contribuye a que solo se manipulen explantes libres de contaminantes microbianos visibles. Esta es una práctica sencilla que no requiere gastos adicionales y garantiza que no se disemine la contaminación con el instrumental durante la manipulación de los explantes.
De igual forma, el trabajo por líneas aseguró que los explantes de diferente origen no se mezclaran. Con ello se garantizó la trazabilidad del material vegetal. Aunque pudieran parecer engorrosas las operaciones de manipulación de los explantes por líneas hasta el tercer subcultivo este procedimiento permite manejar mejor la contaminación bacteriana. En este sentido, pueden ser descartadas las líneas contaminadas o separar las que ya hayan presentado explantes contaminados (en el caso en que no se manifieste crecimiento bacteriano en todos los explantes de la línea a la misma vez, asociado al explante inicial), eliminarlas del proceso o definir otra estrategia productiva como por ejemplo, formar un solo lote con esas líneas, no continuar multiplicándolas sino transferirlas a la fase de enraizamiento para llevarlas a la fase de aclimatización.
En el tercer subcultivo de multiplicación, después de dos sin presencia de contaminantes bacterianos en la propagación con el protocolo modificado por Gutierrez et al. (2017), nuevamente se observó contaminación bacteriana aunque en 73.4% menos que con el protocolo original. La aparición de contaminantes bacterianos en la fase de multiplicación y su incremento con el número de subcultivos ha sido mencionada por otros autores en diferentes cultivos y se asocia a la presencia de contaminantes endógenos (Leifert et al., 1994; Carrazana et al., 2011; Santos et al., 2015; Orlikowska et al., 2017). En tal sentido, Carrazana et al. (2011) determinaron el carácter endófito de las bacterias en el cultivo in vitro de malanga Xanthosoma cv. ‘México 08’.
Los resultados demostraron la importancia de considerar en la propagación in vitro procedimientos de manejo de la contaminación bacteriana que faciliten la toma de decisiones, eviten la mezcla de explantes contaminados y no contaminados en un mismo recipiente de cultivo y la diseminación de los microrganismos. En este contexto el entrenamiento al personal es determinante.
CONCLUSIONES
La combinación de acciones para el manejo de la contaminación bacteriana entre las que se encuentran la reducción del tamaño del explante, el trabajo por líneas y la detección visual de contaminantes previo al subcultivo del material vegetal reduce la presencia de contaminantes bacterianos en la propagación in vitro de C. esculenta cv. ‘INIVIT MC-2012’.















