Introducción
La demanda de energía eléctrica se intensifica notablemente cada año, y este crecimiento trae consigo el agotamiento de los combustibles fósiles, la contaminación del medio ambiente y el calentamiento global. Por tal razón, se necesita explorar nuevas tecnologías que permitan la conversión de la energía a partir de fuentes renovables, como la eólica y la solar. Paralelo a esto, la expansión de la electrónica portátil y los vehículos eléctricos han promovido una creciente demanda de fuentes energéticas de alto rendimiento, que tengan altas densidades de energía y potencia, con características de ligereza, delgadez, flexibilidad y rentabilidad.1-6
Estas características se pueden garantizar de forma eficaz mediante el uso de medios electroquímicos que conviertan la energía química en energía eléctrica y viceversa, para los cuales es importante el desarrollo de un sistema eficiente de almacenamiento, que permita incrementar el grado de utilización de las energías renovables, y garantizar el desarrollo sostenible.7,8 Los sistemas de almacenamiento de energía eléctrica en función de su comportamiento de carga y descarga, se pueden dividir en dos tipos: los supercondensadores o condensadores híbridos y las baterías recargables.3,5,9-11
Las baterías recargables basadas en níquel, entre las cuales se pueden mencionar: níquel-cadmio (Ni/Cd), níquel-zinc (Ni/Zn), níquel-hierro (Ni/Fe), níquel-hidrógeno (Ni/H2) y níquel-hidruro metálico (Ni/H/Me), han atraído la atención como sistemas de almacenamiento de energía, debido a su alta conductividad iónica, su rendimiento, su seguridad y bajo costo.1,5,12,13 Específicamente las baterías de Ni/Fe o de Edison, han sido estudiadas en los últimos años, porque se caracterizan por su robustez, no toxicidad y respeto al medio ambiente.5,12-14 Estas baterías tienen como cátodo al hidróxido de níquel (II), que es un material de gran interés como electrodo, por su alta capacidad específica teórica (289 mAh/g en baterías recargables y 3750 F/g en supercondensadores).11
El hidróxido de níquel como material activo para electrodos positivos ha sido ampliamente estudiado en baterías alcalinas secundarias, celdas de combustible, supercondensadores asimétricos, electrolizadores, celdas electro-sintéticas, dispositivos electrocrómicos por ser un material electroquímicamente activo, con la capacidad de oxidarse y reducirse de forma reversible.15
Las ventajas de utilizar el hidróxido de níquel en baterías y supercondensadores incluyen un costo relativamente bajo, un voltaje redox adecuado (cercano al potencial de evolución del oxígeno), buen rendimiento de carga/descarga a alta velocidad y amplios rangos de temperatura de funcionamiento y almacenamiento. Sin embargo, el Ni(OH)2 todavía suele presentar las limitaciones siguientes: escasa estabilidad durante los ciclos de carga/descarga, baja conductividad eléctrica (10-5 a 10-9 S/cm), y su capacidad específica sigue estando muy por debajo del valor teórico.16
Para superar tales limitaciones, se ha estudiado el efecto que ejercen los cambios de composición química, estructura, morfología y propiedades eléctricas en el rendimiento electroquímico del hidróxido de níquel. Por ejemplo, se ha reportado que la coprecipitación de los iones de níquel junto con otras especies metálicas tales como cobalto, hierro, cobre y zinc, pueden incrementar la capacidad de descarga, mientras que el área superficial específica con valores entre 75 y 100 m2/g propicia buena interconectividad entre las partículas del hidróxido y de estas con la solución electrolítica, mejorando el comportamiento electroquímico del electrodo de Ni(OH)2.11,12,15,17-24
Los estudios antes mencionados se han realizado con el hidróxido de níquel obtenido a partir de soluciones de sales de níquel grado reactivo, pero en estos momentos están siendo de mayor interés las soluciones generadas en etapas intermedias y residuales de procesos químicos y metalúrgicos para minimizar el costo de procesamiento.23,25-27
Con tal finalidad, se ha evaluado la posibilidad de obtener el hidróxido de níquel (II) a partir de las soluciones producidas durante la lixiviación del sulfuro de níquel, proveniente del proceso de la Empresa Comandante Ernesto Che Guevara de Moa, las cuales están compuestas por diversos iones metálicos. La obtención de hidróxido de níquel a partir de este licor industrial se ha analizado en estudios precedentes, fundamentalmente para evaluar el efecto de las condiciones de síntesis sobre algunas de las características físico químicas del hidróxido. Sin embargo, no se han particularizado sus diferencias con respecto al hidróxido que se obtiene a partir de un licor no industrial, ni se ha brindado información sobre las propiedades eléctricas del producto obtenido.23,28
Por tal motivo, en este trabajo se propone evaluar las características físico químicas y eléctricas del hidróxido de níquel preparado a partir de soluciones acuosas producto de la lixiviación del sulfuro de níquel y compararlas con el hidróxido obtenido con soluciones no industriales. Se analizarán los siguientes aspectos: composición química, propiedades estructurales, térmicas y texturales, así como la conductividad eléctrica de los hidróxidos que constituyen el objeto de estudio.
Materiales y métodos
Obtención del licor para el desarrollo de la experimentación
Para obtener el hidróxido de níquel (II), se empleó el licor industrial de sulfato de níquel que se preparó a partir de la lixiviación del sulfuro de níquel producido por el proceso Caron en la Empresa Comandante Ernesto Che Guevara (ECG). El licor de sulfato de níquel obtenido presenta una concentración de 57,8 g/L de níquel y concentraciones inferiores a 1 g/L de otras especies metálicas.28 La presencia de estas especies en las referidas concentraciones, constituyó un rasgo distintivo con respecto a las soluciones preparadas a partir de compuestos de níquel con pureza igual o superior al 98,0 %, empleadas tradicionalmente para obtener el hidróxido de baterías recargables o supercondensadores.
Se preparó también una solución de sulfato de níquel de calidad reactivo, con concentración de níquel similar a la del licor de trabajo. Esta solución se empleó para la síntesis del hidróxido de níquel (II), que se utilizó como referencia para comparar con los resultados del hidróxido preparado con el licor industrial.
Reactivos químicos
Los reactivos que se utilizaron en todos los experimentos fueron:
Hidróxido de amonio (25 % en peso, Merck, Alemania)
Hidróxido de sodio (98 % de pureza, Merck, Alemania)
Sulfato de níquel hexahidratado NiSO4*H2O (98 % de pureza, Merck, Alemania)
Se utilizó agua destilada para preparar las soluciones de hidróxido de amonio y sodio con las concentraciones previstas en los experimentos, y para la etapa de lavado del sólido obtenido.
Procedimientos de caracterización aplicados
La síntesis del hidróxido de níquel (II) se realizó en un reactor cilíndrico de un litro de capacidad, provisto de un agitador de paletas y conectado a un termostato para garantizar la temperatura de trabajo. Las disoluciones se alimentaron al reactor con bombas peristálticas, y para el control del pH se utilizó un medidor marca Hanna con electrodo de vidrio.
Para determinar las composiciones químicas de las soluciones de sulfato de níquel (industrial y de calidad reactivo) y de los productos obtenidos, se empleó un espectrofotómetro de absorción atómica, con llama y generador de hidruros, modelo SOLAR 929, UNYCAM. Se utilizó llama y aire-acetileno (Para Ni, Co, Fe, Cu, Zn, Mg, Mn), llama y acetileno-óxido nitroso (para Ca) y emisión atómica (para Na). Se emplearon lámparas de cátodo hueco para cada elemento.
Las fases mineralógicas presentes en el producto precipitado se analizaron por difracción de rayos X (DRX) en polvo en un difractómetro X’PERT3 de PANalytical. Se emplearon las siguientes condiciones: barrido tipo Gonio en [°2θ] registro angular desde 4,004 hasta 79,996 con distancia de paso en o 2θ de 0,008, radiación de cobre (λ= 1,54 045 A) y filtro de níquel. La diferencia de potencial fue de 40 kV y corriente de 30 mA. La calibración del equipo se chequeó con patrón externo de silicio. Para identificar las fases, se utilizó el programa Crystallographica Search-Match.
Los termogramas se obtuvieron en un equipo de la firma alemana NETZSCH, modelo STA 449 F3, utilizando crisoles de Al2O3 (tamaño estándar). Se realizaron a velocidad de calentamiento de 10 ºC/min en atmósfera de Argón, desde temperatura ambiente hasta 800 ºC.
Los espectros infrarrojos con transformada de Fourier (FTIR) se obtuvieron en un espectrómetro Perkin Elmer, modelo Frontier provisto de fuente MIR y detector MIR TGS. Se empleó la técnica de transmisión en pastillas de KBr de 13 mm de espesor. Los registros se efectuaron en el modo fotométrico, transmitancia de 4 000 a 300 cm-1, con 16 barridos por punto, y 4 cm-1 de resolución. El intervalo entre datos fue de 1 cm-1.
Se empleó un espectrómetro Raman modelo SPECTRA (NT-MDT), con láseres: 785 nm, (He-Ne) 633 nm, 473 nm; detector: CCD40-11; resolución espacial: XY < 200 nm; Z < 500 nm; resolución espectral 0,025 nm/0,007 nm; el cual permite analizar muestras sólidas, líquidas y polvos. Inicialmente se depositaron las muestras en una cinta doble de carbono, la cual estaba pegada a su vez en un porta-muestras de vidrio.
Se empleó un equipo ASAP 2020 de Micromeritics para el estudio de superficies, mediante la determinación de adsorción física (fisisorción) de N2 por el método volumétrico. Las áreas superficiales específicas y la distribución del tamaño de los poros se calcularon mediante los modelos BET (Brunauer -Emmet- Teller) y BJH (Barrett-Joyner-Halenda).
Metodología para evaluar la conductividad eléctrica del hidróxido de níquel (II) obtenido
La instalación experimental para determinar la conductividad eléctrica estuvo conformada por un módulo porta-muestra y un multímetro digital de banco marca Keysight, habilitado para medir directamente la resistencia en ohmios.
En el estudio de la conductividad eléctrica las muestras de los polvos de hidróxidos de níquel se sometieron a diferentes presiones para conformar las muestras compactadas o pastillas y se determinó la presión óptima de compactación.29,30 Se calculó la densidad de los polvos a partir de la masa y el volumen de cada muestra compactada. Para las mediciones eléctricas se colocó polvo de grafito por fricción sobre la superficie de las pastillas (previamente lijada y limpiada con alcohol). Posteriormente se calentaron las pastillas a 70 oC durante media hora y se enfriaron a temperatura ambiente. Los contactos de cobre del soporte también se lijaron y limpiaron con alcohol antes de realizar la medición verificando que la resistencia del soporte era de 0,193 Ω. Finalmente se utilizó el método de dos puntas por presión sobre la superficie del material, con el cual se determinó la resistencia de las muestras y se calcularon los valores de resistividad y conductividad.
Resultados y discusión
Composición química
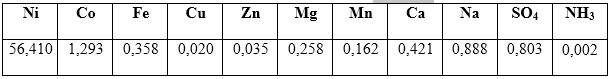
Como resultado de la síntesis del hidróxido de níquel en las condiciones establecidas, se obtiene un producto fino de color verde. Los resultados promedios de los análisis químicos se muestran en la tabla 1.
Como se puede observar en la tabla 1, el contenido fundamental del hidróxido de níquel, obtenido a partir del licor industrial, es alrededor de 56 % y 1,3 % de níquel y cobalto, respectivamente.24,28 Se evidencia, además, la presencia de iones sulfato que no fueron eliminados totalmente con el proceso de lavado. De acuerdo con lo reportado por otros autores, el contenido de cobalto en el hidróxido puede influir de forma positiva en las propiedades eléctricas y electroquímicas del material, cuando se evalúa como electrodo redox. Los demás elementos presentes en la muestra con un contenido total de alrededor del un por ciento o inferior, también pudieran aportar mejoras en las propiedades eléctricas.31
Análisis por difracción de rayos X
En la figura 1 se muestran los patrones de difracción del hidróxido de níquel (II) sintetizado, a partir del licor de sulfato de níquel grado reactivo (A), y preparado a partir del licor de sulfato de níquel industrial (B).
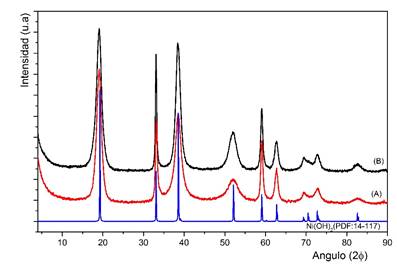
Fig. 1 Difractogramas de las muestras de hidróxido de níquel obtenidas a partir del sulfato de níquel del (A) licor sintético y del (B) licor industrial
Ambos difractogramas muestran, que los productos obtenidos mediante el método de síntesis en las condiciones establecidas, presentan características cristalográficas similares entre ellas, respecto a la posición angular y la intensidad de los picos de difracción. Las intensidades relativas son variables, lo cual es consecuente con diferencias en la cristalinidad.
Del análisis cualitativo de fases de las muestras se pudo precisar, que la fase principal corresponde al β-hidróxido de níquel. Las difracciones que se producen a valores de 2θ de 19,81º, 33,06º, 38,44º, 51,82º, 59,07º, 62,63º, 69,45º, 72,78º y 82,53º son típicas de la fase hexagonal del Ni(OH)2 (JCPDS: 14-0117) y se refieren a los planos (001), (100), (101), (102), (110), (111), (200), (201) y (202), respectivamente, lo que confirma la formación de la fase β-Ni(OH)2.1,9,17 La elevada intensidad y el ancho de los picos de difracción indican que el material es nanocristalino, lo que favorece sus propiedades en los supercondensadores y las baterías de Ni/Fe 32. No se observan otros picos asociados a la fase α-Ni(OH)2. Como el contenido de cobalto es inferior al 2,5 %, no se aprecian cambios significativos en el patrón de difracción del producto obtenido, con respecto al patrón de difracción reportado en la JCPDS No. 01-1047. De la misma forma, se puede apreciar que no hay otras fases mineralógicas en la muestra que puedan estar asociadas a la formación del β-Co(OH)2, lo que permite afirmar que el cobalto coprecipita en la estructura cristalina del hidróxido de níquel (II).
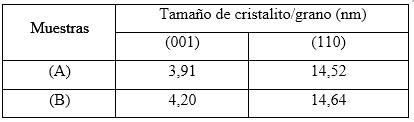
El tamaño del cristalito/grano de las muestras de hidróxidos obtenidas se reporta en la tabla 2, el cual fue calculado de acuerdo a la ecuación de Scherrer33 para las direcciones cristalográficas (001) y (110), respectivamente.
Como se puede observar de los valores reportados en la tabla 2, el tamaño de los cristalitos está en el orden de los nanómetros, en la dirección del plano cristalográfico (001) de las muestras sintetizadas a partir de los licores industriales (B), cuando se emplea disolución de amoniaco e hidróxido de sodio. Este resultado es similar al obtenido para las muestras sintetizadas con licores no industriales (A) y puede ser un efecto directo de la formación de aminos complejos de níquel, donde los iones Ni2+ se mantienen atrapados dentro de la esfera de coordinación del complejo, los cuales van a ser liberados lentamente en la medida que se incrementa el pH del medio con la disolución de NaOH.16
Evaluación térmica
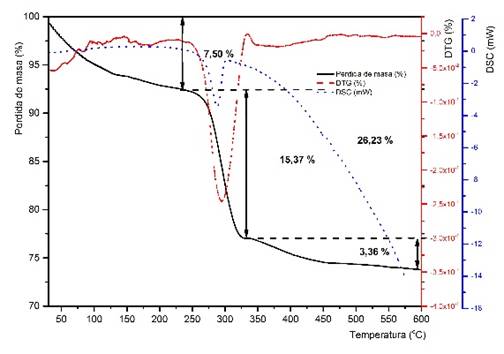
Los análisis termogravimétricos (TG) apoyan los datos de la DRX y se presentan en las figuras 2 y 3. Para el hidróxido de níquel (II) obtenido a partir del licor producto de la lixiviación del NiS, que contiene ( 1,3 % de cobalto, se muestran además las curvas de termogravimetría derivada (TGD) y de calorimetría diferencial de barrido (DSC), que permiten definir mejor las etapas asociadas a las transformaciones térmicas (figura 3).
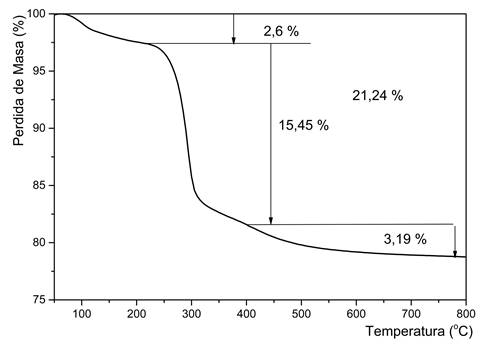
Como se puede observar en las figuras 2 y 3, durante el tratamiento térmico de las muestras, hasta los 600 ºC, se producen tres etapas de pérdida de masa, hasta su descomposición y transformación a óxido de níquel (II). La primera pérdida de masa se atribuye a la pérdida del agua de humedad y el agua intercalada, para ambas muestras de hidróxidos se produce entre los 100 y 250 ºC.34,35 En el caso del hidróxido de referencia representa esta pérdida representa el 2,6 % de la masa inicial (figura 2), mientras que para el hidróxido obtenido a partir de licor industrial (figura 3), representa el 7,50 %, y se produce en un intervalo de temperatura entre 100-235 ºC.34 Se produce una segunda etapa de pérdida de masa en el intervalo de temperatura entre 250 y 400 ºC para la muestra patrón y entre 235 ºC y 330 ºC para el hidróxido industrial, con pérdidas similares en ambos hidróxidos (muestra A: 15,45 % y muestra B: 15,37 %), producto a la eliminación del agua estructural (OH), con la descomposición del hidróxido y su transformación en el correspondiente óxido.
Para la muestra B obtenida con licor industrial este resultado se confirma mediante el análisis DSC que muestra un único pico endotérmico a 288 °C. Desde 330 ºC hasta 600 ºC se produce otra pérdida gradual de masa que corresponde a 3,36 %, sin que se produzcan cambios significativos en la curva de DSC. La pérdida de masa involucrada a temperaturas superiores a 330 ºC puede estar asociada a la presencia de impurezas como sulfatos o carbonatos. En total, la descomposición térmica del hidróxido hasta los 600 ºC experimenta una pérdida de masa de 21,24 % para la muestra de referencia y 26,23 % para el hidróxido obtenido con licor industrial.
Análisis por espectroscopia infrarroja con transformada de Fourier
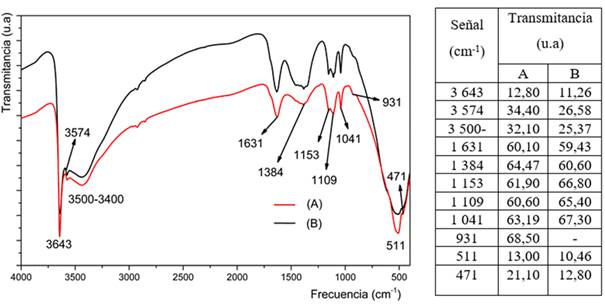
El espectro FTIR del Ni(OH)2 obtenido a partir de licores reactivos, se presenta en la figura 4. La intensa y aguda banda de adsorción situada en torno a los 3 643 cm-1 es característica para la fase β del hidróxido de níquel (II), y se asigna a los modos de estiramiento O-H de las moléculas de agua entre capas y de los grupos OH unidos por H en la fase β. El espectro FTIR sugiere la presencia de iones carbonatos y moléculas de agua en la estructura de capas de los hidróxidos dobles laminares (LDH) de Co-Ni. La banda ancha en torno a 3 500-3 400 cm-1 y la banda en 1 631 cm-1 se asignan a las vibraciones de estiramiento O-H del enlace de hidrógeno y al modo de flexión de las moléculas de agua, absorbidas en la superficie estructural del β-Ni(OH)2.
Las bandas de baja intensidad, observadas a 1 455 cm-1, 1 384 cm-1, 1 153 cm-1, 1 109 cm-1 y 1 041 cm-1, se deben a la vibración del ion carbonato (CO3 2-), que proviene, principalmente, de la disolución del CO2 atmosférico durante la síntesis y de los iones sulfatos que no se eliminaron durante el lavado.4,9,16 Además de las bandas características del agua, se observan por debajo de 1 000 cm-1, centradas a 511 y 471 cm-1, se asocian a vibraciones de estiramiento de los enlaces νNi-O y de flexión de los enlaces νNi-O-H, respectivamente. Al comparar este espectro con el hidróxido obtenido a partir del licor producto de la disolución del sulfuro de níquel de la ECG (figura 4), se observan las mismas bandas de infrarrojo con similares intensidades.17
Análisis por espectroscopia RAMAN
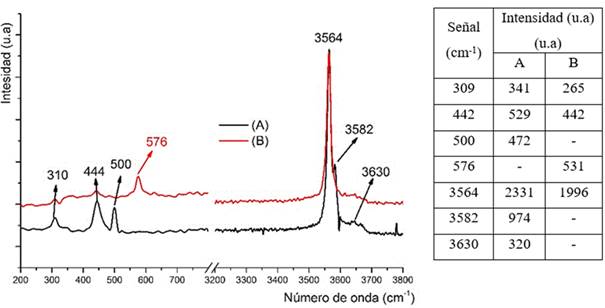
Las características estructurales del Ni(OH)2 se confirmaron además mediante espectroscopia Raman. Como se ilustra en la figura 5, el hidróxido de níquel (II) obtenido a partir de licor sintético y el licor industrial presentan casi el mismo espectro Raman, mostrando a bajas frecuencias, tres picos asociados con el β-Ni(OH)2 bien cristalizado a 500, 444 y 310 cm-1. Además, a altas frecuencias se aprecia un pico agudo e intenso a 3 564 cm-1 y una pequeña banda a 3 582 cm-1 que se atribuyen, principalmente, al estiramiento simétrico de los grupos hidroxilo. El pico que se produce a 3 582 cm-1 es característico en los hidróxidos fase β cristalinos. La banda de 444 cm-1 se asignó al estiramiento Ni-O (νNiO), y la señal de 310 cm-1 se ha atribuido a una vibración de la red del hidróxido, debido a los modos de estiramiento Ni-OH y Ni-O, respectivamente.3,9,10 A excepción de los tres picos del β-Ni(OH)2 que indica un sólido bien cristalizado, el espectro Raman mostró dos picos adicionales a 500 y 3 630 cm-1, obtenidos para un hidróxido β-Ni(OH)2 desordenado. El pico a 3 630 cm-1 aún no ha sido atribuido a modos de vibración concretos, pero probablemente esté asociado al estiramiento del OH- de los grupos hidroxilo libres y a la existencia de defectos estructurales y de cierta porosidad. El pico en torno a los 500 cm-1 puede estar asociado a las vibraciones de los enlaces Ni-O y Co-O.
Cuando se incrementa el contenido de cobalto en el hidróxido a 1,3 %, ocurren cambios estructurales que se manifiestan en el espectro Raman (figura 5), por ejemplo, desaparece el pico en torno a 3 630-3 640 cm-1, asociado posiblemente al estiramiento del OH- de los grupos hidroxilo libres. Cabe destacar que el espectro Raman del compuesto Ni/Co(OH)2 presenta un pico 570 cm-1, que puede asignarse a las vibraciones de red del β-Ni(OH)2.3
Análisis de área superficial y específica, tamaño y volumen de poros
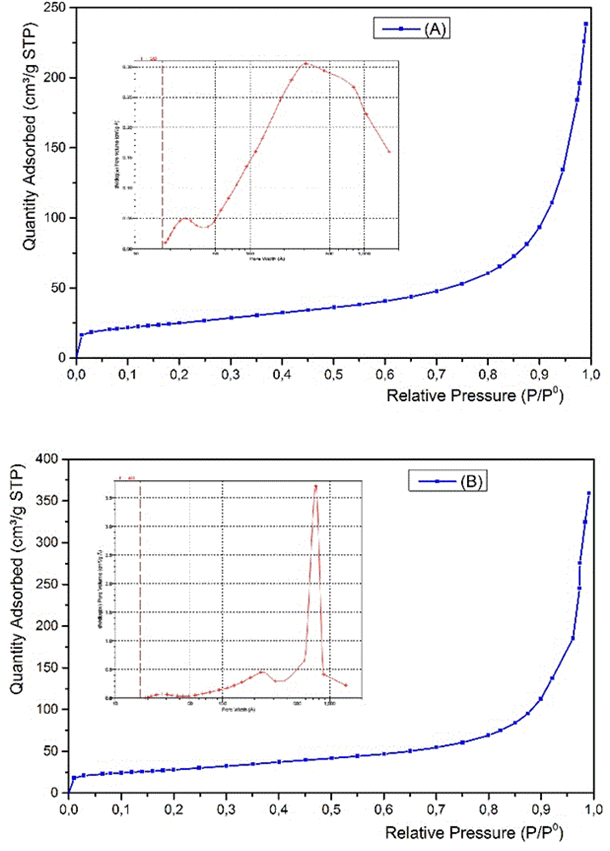
En la figura 6 se presentan las isotermas de adsorción de nitrógeno de los hidróxidos de níquel (II) preparados y se insertan las curvas de distribución de poros. Los hidróxidos obtenidos presentan isotermas de tipo IV, lo que sugiere que todos los hidróxidos preparados son materiales mesoporosos.10
El área superficial del hidróxido obtenido a partir de licores sintéticos y licores industriales es de 89 y 80,5 m2/g, respectivamente, lo que corresponde a volúmenes de poros de 5,7 • 10-3 y 5,1 • 10-3 cm3/g, respectivamente y tamaño de poros entre 12,7 y 14 nm, valores muy similares. Estas propiedades texturales sugieren la presencia de un material nanoestructurado con excelentes propiedades que favorecen el proceso electroquímico en la evaluación como material de electrodo para baterías recargables y supercondensadores.1,10
Evaluación de la conductividad eléctrica
Las muestras en polvo de hidróxido de níquel (II) con masa aproximada de 0,2 g fueron sometidas previamente a diferentes presiones de compactación. Los resultados obtenidos se muestran en la tabla 3.
Tabla 3 Evaluación de la densidad y conductividad del hidróxido de níquel (II) de referencia sometido a diferentes presiones de compactación
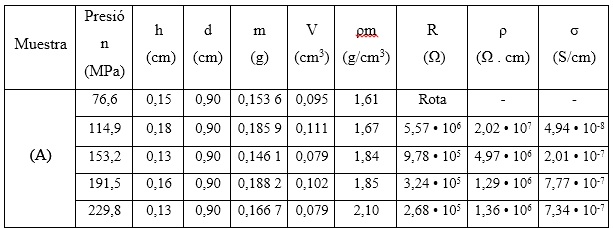
donde:
h, d, m, V, ρm: altura, diámetro, masa, volumen y densidad másica de las pastillas compactadas
R: resistencia
ρ: resistividad
σ: conductividad eléctrica
Los resultados que se presentan en la tabla 3 demuestran que las muestras de Ni(OH)2 obtenidas a partir de sulfato de níquel grado reactivo, compactadas a una presión de 191,5 MPa y con contactos de grafito presentan valores de conductividad en el orden de 10-7 a 10-6 S/cm, los cuales se encuentran en el intervalo (de 10 -5 a 10 -9 S/cm) reportado por otros autores para el Ni(OH)2.16,29,30,36 La presión de compactación igual a 191,5 MPa resultó ser el valor más favorable y se utilizó para realizar todas las mediciones, que permiten determinar la densidad de las muestras compactadas y las propiedades eléctricas como se muestra en las tablas 4 y 5.
Tabla 4 Densidad másica y propiedades eléctricas de las muestras de hidróxido de níquel (II), de referencia. Presión de compactación: 191,5 MPa
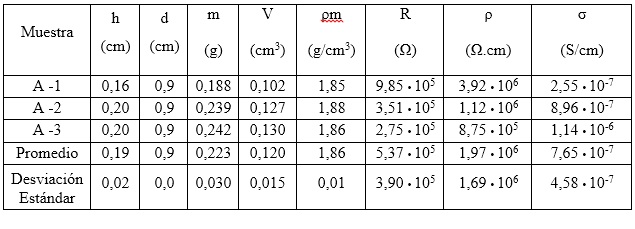
Tabla 5 Densidad másica y propiedades eléctricas de las muestras de hidróxido de níquel (II), obtenido a partir de licor industrial. Presión de compactación: 191,5 MPa

El valor promedio de conductividad eléctrica (9,70 • 10-7) mostrado en la tabla 5 para el hidróxido de níquel obtenido con licor industrial, es cercano al alcanzado para Ni(OH)2 de referencia (7,65 • 10-7), lo que significa que no se logra una mejora sustancial de esta propiedad. Sin embargo, con los resultados presentados en este trabajo se demuestra que el hidróxido de níquel (II) obtenido con el licor producto de la lixiviación del sulfuro de níquel de la Empresa Comandante Ernesto Che Guevara de Moa, posee características químicas, físicas y eléctricas similares a las alcanzadas con el Ni(OH)2 de referencia, precipitado a partir del sulfato de níquel grado reactivo. Este hecho pudiera ser conveniente para el proceso de obtención del hidróxido de níquel (II), teniendo en cuenta que se utiliza una materia prima más barata que la empleada tradicionalmente en los procesos comerciales de producción de baterías y supercondensadores.
Conclusiones
Se confirmó que el hidróxido obtenido a partir del licor industrial, producto de la lixiviación del sulfuro de níquel de la Empresa Comandante Ernesto Che Guevara de Moa, posee contenidos de níquel y cobalto iguales a 56,4 % y 1,3 %, respectivamente. Con la caracterización físico química y eléctrica realizada, se demostró que el compuesto formado es nanocristalino, mesoporoso, y corresponde a la fase β-Ni(OH)2, sin que se observaran otras fases mineralógicas asociadas al cobalto. Su conductividad eléctrica fue igual a 9,70 • 10-7 S/cm, y está en el intervalo reportado por otros autores. Se encontró similitud en las características estructurales, texturales y eléctricas del hidróxido de referencia y el hidróxido de origen industrial evaluado en el presente trabajo, por lo que se considera un candidato potencial para fabricar electrodos de baterías recargables y supercondensadores electroquímicos.