Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Tecnología Química
versión On-line ISSN 2224-6185
RTQ vol.35 no.2 Santiago de Cuba Mayo.-ago. 2015
ARTÍCULO ORIGINAL
Mejoras en la etapa de conformación del ingrediente farmacéutico activo de la estreptoquinasa recombinante
Improvements in the recombinant streptokinase active pharmaceutical ingredient conforming stage
MSc. Sadiely Sánchez-LabañinoI, MSc. Niurka Seuret-HernándezI, Dr. Orestes Mayo- AbadII
I: Centro Nacional de Biopreparados, Bejucal, Mayabeque, Cuba.
II: Facultad de Ingeniería Química, Instituto Superior Politécnico "José Antonio Echeverría", La Habana, Cuba. omayo@quimica.cujae.edu.cu
RESUMEN
La obtención de la estreptoquinasa por vía recombinante se logró en el Centro de Ingeniería Genética y Biotecnología (CIGB) en 1989 y luego de la transferencia tecnológica al Centro Nacional de Biopreparados (BioCen) en el 2002, se ha podido producir establemente este medicamento. Gracias al carácter efectivo y económico de esta proteína es muy utilizada en algunos casos, bajo indicaciones médicas, para disolver coágulos sanguíneos en infartos del miocardio, la trombosis venosa profunda, infarto cerebral isquémico, embolismo pulmonar, etcétera. En este trabajo se utiliza la Metodología del Análisis de Procesos para aplicar medidas técnicas y organizativas entre las que se destacan: la creación de un grupo de trabajo y la sustitución de parte del equipamiento principal. De esta manera se logró robustecer la etapa de Conformación del IFA, con la aplicación de un sistema cerrado, la introducción de bolsas plásticas flexibles de etil vinil acetato y las cápsulas Sartorius en la filtración final, haciendo más operativo, rápido y aséptico el proceso. El impacto logrado de reducción de las pérdidas hasta un 3 % fue evaluado, demostrando la factibilidad económica de las medidas tomadas.
Palabras clave: No conformidades, pirógenos, Ingrediente Farmacéutico Activo (IFA), sistema cerrado.
ABSTRACT
The Streptokinase way recombinant engineering was obtained at the Center of Genetic Engineering and Biotechnology (CIGB) in 1989 and after the technology transference to the National Center for Bioproducts (BioCen) in 2002, it has been possible to stably produce this medicament. Thanks to the effective and economic character of this protein it is widely used in some cases, under medical indications, to dissolve blood clots in myocardial infarction, deep venous thrombosis, ischemic brain infarction, lung embolisms, etc. In this work the Methodology of Process Analysis is used in order to find technical and organizational measures among which stand out; the formation of a work group, the substitution of part of the main equipment. That way, it was possible to strengthen the stage of API Conformation, with the application of a closed system, the introduction of flexible plastic bags of ethyl vinyl acetate and Sartorius capsules in the final filtration, allowing the process more operative, fast and aseptic. The impact achieved in the reduction of losses up to a 3 % was evaluated, demonstrating the economic feasibility of the measures taken.
Keywords: Non conformities, pyrogens, Active Pharmaceutical Ingredient (API), closed system.
INTRODUCCIÓN
La estreptoquinasa recombinante es una proteína obtenida a partir del Estreptococo ![]() hemolítico del grupo C, desarrollada en el CIGB. Introducida en el mercado cubano con el nombre de Heberkinasa®, se comercializa por HEBER BIOTEC y fue comprobada clínicamente por el grupo de investigación TERIMA. Luego de la transferencia tecnológica al BioCen, en el año 2002, se han encontrado diferentes puntos vulnerables que afectan la estabilidad y el rendimiento de su producción.
hemolítico del grupo C, desarrollada en el CIGB. Introducida en el mercado cubano con el nombre de Heberkinasa®, se comercializa por HEBER BIOTEC y fue comprobada clínicamente por el grupo de investigación TERIMA. Luego de la transferencia tecnológica al BioCen, en el año 2002, se han encontrado diferentes puntos vulnerables que afectan la estabilidad y el rendimiento de su producción.
El proceso de fabricación del ingrediente farmacéutico activo (IFA) comprende las etapas siguientes: Fermentación a una escala de 450 L, Ruptura Celular, Extracción, Purificación Cromatográfica y Conformación del IFA. Esta investigación se enfoca en el área de Purificación, específicamente en la etapa de Conformación del IFA, debido a que en ella se definen los resultados de toda la producción de estreptoquinasa, obteniéndose el producto intermedio final, el IFA de estreptoquinasa recombinante. Otras áreas han sido objeto de estudio de diferentes trabajos, pero la que nos ocupa, a pesar de no requerir de mucho equipamiento y contar con un solo paso cromatográfico, no es menos importante y requiere de mucha atención, pues una pérdida a este nivel significa desechar todo el trabajo desempeñado en las etapas anteriores con un costo económico elevado.
En la producción de este medicamento, ocurrió un 15 % de lotes rechazados en el año 2007 por no cumplir con el nivel de endotoxinas, lo que ha merecido la atención de la dirección del centro. En este proceso se obtienen lotes No Conformes, debido a lo cual han sido reprocesados, pero cada reproceso implica la pérdida del 60% de las dosis iniciales de cada lote, lo cual constituye una pérdida económica significativa.
FUNDAMENTO TEÓRICO
La estreptoquinasa
La estreptoquinasa (SK) además de ser producida de forma natural a partir del Streptococcus hemolíticos ha sido expresada y excretada en Escherichia coli partiendo del ADN genómico de la cepa H46A del Streptococcus equisimilis y con la utilización del bacteriófago lambda. También ha sido aislada a partir del Streptococcus pyogenes y del Streptococcus uberis. Actúa como agente fibrinolítico, capaz de convertir el plasminógeno humano presente en la sangre en plasmina, una enzima proteolítica que degrada la fibrina que forman los coágulos en productos de degradación solubles [1,3].
Cromatografía en columnas
La cromatografía es una técnica que permite la separación de moléculas diferentes presentes en una misma muestra. El método está basado en la circulación de una fase móvil (que arrastra a la mezcla de compuestos a separar) a través de una fase estacionaria. Dependiendo de la afinidad relativa que por ambas fases tengan los distintos compuestos presentes en la mezcla resultará su separación [4]. El principio de la cromatografía no es más que la aplicación de un criterio de separación a las proteínas que se desplazan a lo largo de una matriz sólida porosa. Este criterio de separación se basa en alguna propiedad que es diferente entre las proteínas que se quieren separar: peso molecular, carga eléctrica, afinidad de una de ellas por alguna otra, entre las que se pueden mencionar. Existen diferentes tipos de cromatografías en columnas, en función del criterio de separación que se aplique.
Endotoxinas
Los pirógenos son sustancias que pueden aumentar la temperatura corporal. Ellos tienen su origen en componentes de la pared de células Gram negativas, pero pueden provenir también de algunos productos químicos, las materias primas, el agua de proceso, los excipientes, los medios de cultivo de células, los aditivos de la fermentación y los medios de cromatografía [5]. Las bacterias Gram negativas se deshacen de porciones de su pared celular y lipopolisacáridos (LPS) en su entorno, aportando endotoxinas (ET). Las endotoxinas son estimulantes potentes del sistema inmune de los mamíferos, causando reacciones pirogénicas y de shock. Su supresión en parenterales es una regulación obligatoria tanto para la Administración de Drogas y Alimentos de los Estados Unidos (conocida por sus siglas en idioma Inglés como FDA), que ha establecido límites críticos del contenido de pirógenos para estos productos y para la organización regulatoria nacional, el Centro Estatal para el Control de Medicamentos (CECMED). Cuando se utilice la E. coli u otras bacterias Gram negativas para producir proteínas recombinantes, es especialmente importante asegurarse que los LPS bacterianos sean suprimidos del producto final [5].
Detección de pirógenos
La Farmacopea de Estados Unidos y la de Europa especifican para detectar pirógenos, el ensayo en conejos y el ensayo LAL (Lisado de Amebocitos del Limulus). Sin embargo, el ensayo LAL detecta solamente LPS y resultan falsos negativos en ciertos productos. Técnicamente, el ensayo en conejos es una técnica de toxicidad aguda [6]. Un contaminante propio de origen bacteriano en estos medicamentos son las endotoxinas, provenientes de las bacterias Gram negativas [7]. Por más de 40 años el ensayo de pirógenos mediante la determinación de la respuesta febril en conejos, permaneció prácticamente invariable y su efectividad fue escasamente cuestionada. En la actualidad, para la aprobación y comercialización de gran parte de los productos farmacéuticos y biotecnológicos diseñados para ser administrados por vía parenteral, las principales instituciones reguladoras internacionales exigen el control de pirógenos por el método del LAL. Este ensayo es un método in vitro que detecta con alta sensibilidad la presencia de endotoxinas bacterianas [8].
El ensayo de pirógenos en conejos es capaz de detectar cualquier sustancia pirogénica y consiste en medir el aumento de temperatura en el conejo, provocado por la inyección intravenosa de una disolución estéril de la sustancia a examinar [9,10]. En las diferentes farmacopeas se describe el ensayo de pirógenos en conejos, la prueba de pirógenos es diseñada para limitar un nivel aceptable de riesgo de reacciones febriles concerniente al producto objeto de análisis en los pacientes a los que se suministrará. El método que se utiliza en la producción de estreptoquinasa recombinante se realiza según las recomendaciones de la Farmacopea Británica (BP) vigente y consiste en la medición de los incrementos de temperatura corporal en conejos después de una inyección intravenosa de la muestra [10].
Análisis de Procesos
Un proceso es una secuencia de actividades que transforman de manera coordinada unos insumos en productos o servicios, con valor agregado para un beneficiario; un proceso bien diseñado, con información acerca de lo que ocurre y controles de calidad incorporados a lo largo del mismo, producirá calidad en los resultados. El Análisis de Procesos es la evaluación del estado de un proceso con el objetivo de realizar mejoras en su desempeño de manera continua. Es una herramienta aplicable a cualquier producción que contribuye a desarrollar habilidades profesionales como la capacidad de análisis, la de integración y la de trabajo en equipo. Esta herramienta hace énfasis en el desarrollo de la misión, razón de ser de las organizaciones y en todo lo que le es pertinente; se busca la coherencia entre lo que se enuncia, lo que se hace y lo que se obtiene. Las herramientas de Análisis de Procesos son utilizadas para analizar y modelar los procesos y diseñar flujos de trabajo de los mismos. Son fundamentales en la optimización y racionalización de la organización y se utilizan con frecuencia en combinación con la estructura empresarial y con las herramientas de gestión de procesos [11].
Etapas del Análisis de Procesos
Las etapas que componen el Análisis de Procesos son las siguientes: [11]
- Definición del objetivo a alcanzar: definir el problema a resolver.
- Determinación de las causas del problema: herramientas a utilizar.
- Propuesta de alternativas de solución: considerar los requisitos ambientales y sociales.
- Evaluación de las alternativas y selección de la mejor: análisis técnico económico.
- Ejecución y control.
- Evaluación final: ¿se alcanzó o no el objetivo?
- Inicio de un nuevo ciclo.
MATERIALES Y MÉTODOS
Descripción del Proceso
El proceso de obtención de la estreptoquinasa recombinante como Ingrediente Activo consta de las etapas siguientes: Multiplicación, Fermentación, Ruptura Celular, Extracción, Purificación Cromatográfica y la etapa de Conformación del Ingrediente Farmacéutico Activo. Son considerados productos intermedios: la Biomasa Final del proceso de Fermentación, la Biomasa Rota y Lavada, y el Purificado Filtrado; el producto final es el Ingrediente Farmacéutico Activo [12].
En este trabajo sólo se analizará la etapa de Conformación del Ingrediente Farmacéutico Activo, producto que una vez liberado se envía a formular, llenar y liofilizar a la Planta de Productos Parenterales, para su posterior comercialización. En esta etapa se definen los resultados de toda la producción de estreptoquinasa y sus consecuencias definen el cumplimiento o no de los compromisos comerciales de este producto, por lo que desde una óptica económica repercute considerablemente si ocurren reprocesos o pérdidas. Este trabajo va encaminado a un análisis crítico de la producción en el período 2007-2011, de manera que pueda aplicarse el Análisis de Procesos, con vista a la mejora continua de la etapa de Conformación del IFA.
Etapa de Conformación del IFA
El objetivo de esta etapa es producir un producto intermedio denominado Ingrediente Farmacéutico Activo a partir de la unión de 4 a 10 lotes del purificado filtrado que se encuentran en una solución de Tris-HCL 0,02 mol/L, NaCL 0,33 mol/L, pH 8,5, para la obtención de un producto en tampón de formulación final, pero en una concentración mayor, atendiendo a su Actividad Biológica [12]. Debido al poco espacio con que cuentan en la planta y los flujos laminares de techo disponibles, al aumentar la interacción del operador con los contenedores del producto, así como al tamaño del equipamiento, y al uso de muchos frascos de cristal para su procesamiento, las operaciones han tenido que realizarse en varios flujos laminares en un área clase A. Esta etapa consta de tres pasos, cada uno de los cuales se realiza en diferentes flujos laminares: [13]. Filtración en gel G-25 en el flujo laminar P3, concentración por ultrafiltración en el flujo laminar P2 y la filtración final esterilizante en una cabina de flujo laminar.
El Ingrediente Farmacéutico Activo de la estreptoquinasa recombinante se almacena a -20 ºC, en espera de los resultados de los ensayos de calidad [12].
Parámetros de calidad del IFA
Al IFA se le realizan los controles de calidad establecidos para su liberación, siguientes:
- Pureza >= 90 %.
- Actividad Específica >= 35 000 UI/mg.
- Proteínas contaminantes del hospedero <= 1%.
- Esterilidad - Pasa la prueba.
- Pirógenos - Pasa la prueba.
- Características organolépticas - Pasa la prueba.
Reproceso del IFA
Existen dos tipos de reprocesos del IFA ante incumplimientos de las especificaciones de calidad establecidas: [12]. por pirógenos y por contaminante del hospedero. Si no cumple con el ensayo de esterilidad el lote es rechazado.
RESULTADOS
Se analiza el año 2007, detectándose repetidas no conformidades (NC), y por tanto, la disminución de las dosis por concepto de reprocesos que provocaron atrasos en el cumplimiento de los compromisos comerciales. Se pudo determinar que existieron un total de 8 no conformidades, todas relacionadas con la determinación de endotoxinas por pirógeno, las demás especificaciones de calidad no aparecen tabuladas por cumplir con los criterios de aceptación establecidos sin ningún tipo de incidencias. Se obtuvo un recobrado medio de un 60 %. Por este concepto se obtuvieron los resultados siguientes, los cuales se muestran en la tabla 1.
Análisis de las posibles causas de las pérdidas
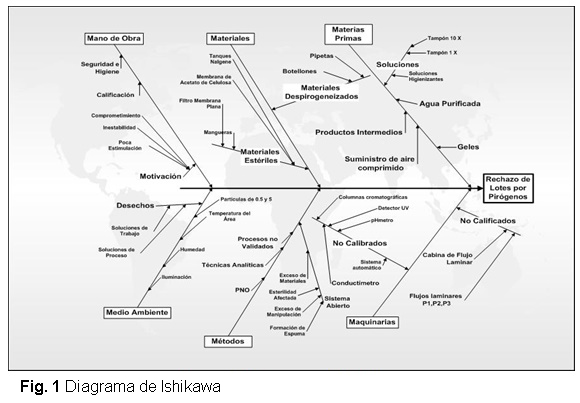
Se realizó una revisión minuciosa de la etapa de Conformación del IFA, siendo difícil detectar las causas reales que provocan estas no conformidades, por lo que se hace uso del diagrama de Causa y Efecto de Ishikawa como una de las herramientas del Análisis del Proceso, para desglosar y mostrar, de una forma clara, las posibles causas que afectan los recurrentes rechazos de lotes por pirógeno en BioCen durante el año 2007. El diagrama se muestra en la figura 1.
El análisis crítico de cada una de las causas mostradas en el diagrama se describe a continuación.
Materias Primas
El agua utilizada no cumple con las regulaciones establecidas para la fabricación de productos parenterales. Se utiliza agua purificada proveniente del sistema Super Q, la cual no está establecida para la etapa final de la producción de Ingredientes Farmacéuticos Activos; donde debe utilizarse agua para inyección.
Materiales
Los materiales utilizados, tienen muchos años de explotación. El sistema de filtración utilizado es por membrana plana de 142 mm con porta filtro. La toma de muestras se realiza mediante pipetas de cristal previamente despirogenizadas.
Métodos
El proceso de Conformación del IFA se puede catalogar como un sistema abierto, debido a que reiteradamente se destapa y tapa el frasco contenedor del eluato de G-25 para realizar las elusiones en él. Se conduce posteriormente el frasco hasta el flujo laminar P1, donde se encuentra el equipo concentrador Amicon y se le introduce la manguera de alimentación para realizar el proceso de concentración. El operador realiza esta manipulación para cada una de las elusiones cromatográficas, atentando con la esterilidad del producto. Se tiene que realizar la prueba de integridad del filtro antes y después de usado.
Medio ambiente
Los locales del área de purificación se clasifican como clase A atendiendo a las exigencias regulatorias. La iluminación y ventilación, en ocasiones, se interrumpen por fallas en el fluido eléctrico.
Mano de obra
El personal del área ha sufrido inestabilidad, por lo que ha sido necesario entrenar a los nuevos operadores en el puesto de trabajo para su mejor desempeño. Se necesita motivar y ampliar los conocimientos de los especialistas y técnicos del área, pues el personal de nuevo ingreso no cuenta con la experiencia ni las habilidades técnicas propias del puesto de trabajo.
Maquinarias
La situación del equipamiento y de los sistemas cromatográficos se puede catalogar en general de críticos, atendiendo al tiempo de explotación, sus piezas de repuesto son de difícil adquisición ya que se encuentran descontinuados en el mercado y su estado técnico no garantiza la seguridad necesaria para la colección de los eluatos.
Para hallar una solución a los problemas citados anteriormente, se propusieron una serie de medidas organizativas y técnicas.
Propuestas de medidas organizativas
1. Crear de un grupo de trabajo con personal capacitado para el análisis y toma de decisiones relacionadas con la producción de estreptoquinasa recombinante.
2. Elaborar un proyecto que sirva de guía para desarrollar mejoras en la etapa de Conformación del IFA [14].
3. Ejecutar actividades de superación a especialistas y técnicos.
4. Planificar la logística de la producción.
5. Asegurar la disponibilidad de geles para el recambio de las columnas cromatográficas según lo orientado por el fabricante.
6. Contactar con diferentes firmas comerciales establecidas en el país, encargadas de suministrar equipamiento a la Industria Biotecnológica.
Propuestas de medidas técnicas
Las medidas técnicas aplicadas no eliminan pero si reducen considerablemente el riesgo por contaminación debido a que se trata de garantizar que el producto transite en todo el proceso de conformación con el mínimo contacto con los materiales que puedan aportar algún tipo de contaminación.
1. Implantación de un sistema cerrado en la etapa de Conformación del IFA
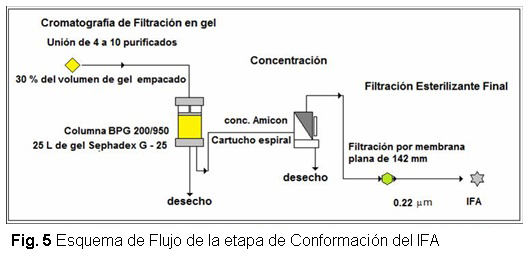
Se instaló un sistema cerrado que sirve para ocupar en menor espacio todo el proceso de aplicación de la muestra, elusión del pico de proteínas, concentración en Amicon y filtración final del IFA de forma continua, garantizando una mayor seguridad, esterilidad y disminución del riesgo de contaminación del producto por pirógenos. Este sistema comienza con la introducción de bolsas desechables de la firma Sartorius Stedim, que sirven para preparar en ellas todas las soluciones de trabajo utilizadas en el proceso como son: la solución tampón 10X, la solución 1X y también se almacena el agua purificada que se usará en la higienización de la columna cromatográfica.
Se confeccionó una pieza partiendo de aditamentos propios de la tapa del reservorio en la que se le insertó un capilar de cristal en forma de L, como lo muestran las figuras 2 y 3.
Al ser roscado este implemento en el concentrador Amicon quedaría en la parte interna, el capilar de cristal y en el otro extremo, la toma rápida que sirve para acoplar en ella la manguera de elusión proveniente del sistema de válvulas de la columna cromatográfica. Esta pieza provoca que al caer el material en el reservorio lo haga sobre la pared del mismo en forma de película fina, en función del flujo impuesto por la bomba del sistema cromatográfico y garantizando que el pico de interés eluido sea colectado sin formar abundante espuma. El operario al cerciorarse en la cromatografía de filtración en gel, que la muestra desalinizada empieza a abandonar la línea base y comienza a aumentar, acciona la válvula del panel iniciando su colección y concluye esta operación cuando vuelve a establecerse la línea base, de manera que toda la muestra proteica que eluye de la columna sea colectada, separada de la solución tampón Tris-HCL 0,02 mol/L, NaCL 0,33 mol/L, pH 8,5. Este procedimiento permite comenzar la concentración en el Amicon una vez que el volumen alcanzado en el reservorio sea de 1 L, realizando esta operación conjuntamente con la elusión cromatográfica repetidas veces como cantidad de corridas en la columna se tengan que realizar, haciendo más operativo, rápido y estéril el proceso. Al culminar la concentración y haber llegado al volumen deseado se desconecta y tapa la pieza de acoplamiento y se conduce el concentrador Amicon hasta el área de filtración final.
Para realizar la filtración esterilizante se le acopla a la manguera de salida del concentrador otra manguera que pasa a través de la bomba peristáltica y que presenta en el otro extremo una cápsula Sartorius (Sartobran 150 ó 300) al que le continúa la bolsa FLEXBOY que recepcionará el material a filtrar como lo muestra la figura 4.
Al concluir la filtración se desconectan las mangueras de acoplamiento y a través de la toma sanitaria de la bolsa se realiza la extracción de las muestras con la utilización de jeringuillas apirogénicas. Finalmente se almacena el IFA a -20 ºC en el congelador del área. En la figura 5 se muestra el esquema de flujo de la etapa de Conformación del IFA.
2. Introducir las cápsulas listas para el uso en el paso de filtración estéril del IFA.
3. Introducir las bolsas plásticas flexibles de etil vinil acetato en el proceso de Conformación del IFA.
4. Introducir las jeringuillas para la toma de muestras en el proceso de Conformación del IFA.
5. Modificar el Sistema de agua Super - Q. Instalación del cartucho Pirogard.
6. Monitorear diariamente por LAL el agua purificada que se utiliza en esta etapa, para determinar su influencia en el nivel de endotoxinas en ese punto de uso.
7. Sustituir el equipamiento de los sistemas cromatográficos. Valorar la factibilidad de adquirir sistemas modulares, de no ser factible sustituir los componentes del sistema actual, incluido el sistema de adquisición de datos.
8. Realizar el diseño, compra e instalación de un sistema para la producción, almacenamiento y distribución de agua con calidad inyectable (API), que satisfaga la demanda de esta, en las diferentes etapas del proceso de producción.
9. Validar la etapa de Conformación del IFA, incluida la limpieza, conservación, reutilización de geles, y el recobrado de proteínas.
10. Incluir en el financiamiento previsto en el Proyecto "Aumento de la capacidad productiva de la estreptoquinasa recombinante en el BioCen", las compras necesarias para aplicar las medidas que sean aprobadas.
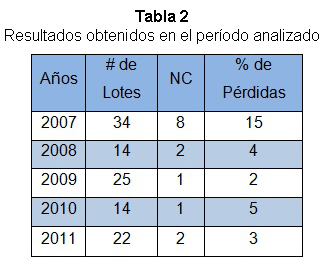
Ver a continuación la tabla 2.
Como se observa en la tabla 2, se alcanzó un 15% de pérdidas en el año 2007 y luego de la aplicación de las medidas técnicas y organizativas se logró reducir este índice, hasta obtener en el año 2011 un resultado muy positivo de un 3% de pérdidas, lo que evidencia un resultado cuantitativo muy favorable que se justifica con las inversiones realizadas y las medidas tomadas.
Impacto económico por la aplicación de las medidas técnicas y organizativas
Este procedimiento se utiliza sobre todo para decidir la viabilidad de los proyectos cuyo desarrollo implica una gran incertidumbre; en estos casos lo más importante es la recuperación rápida del capital invertido y en el caso que nos ocupa es muy favorable, al obtenerse un plazo de recuperación de 0,15 año, lo que asegura el éxito de todo el proceso de mejoras ejecutadas en la etapa de Conformación del IFA. También cabe señalar, que los valores obtenidos del VAN y la TIR son muy elevados propios de los productos de un alto valor agregado, como se muestra en la tabla 3.
CONCLUSIONES
- Mediante la aplicación de la Metodología de Análisis de Procesos se evaluaron las posibles causas que provocaron los rechazos de lotes por No Conformidad en el ensayo de pirógenos, los cuales se estima provocaron pérdidas de dosis por reproceso de Lotes de IFA de la estreptoquinasa recombinante en el BioCen.
- Se introdujeron soluciones técnicas y organizativas con el objetivo de disminuir las No Conformidades en la etapa de Conformación del Ingrediente Farmacéutico Activo.
- Se instaló un sistema cerrado que garantiza una mayor seguridad, esterilidad y mínimo riesgo de contaminación del Producto, para la realización de todo el proceso de aplicación, elusión, concentración y filtración final del IFA de forma continua.
- La factibilidad económica de las mejoras técnicas y organizativas aplicadas, permitió que disminuyeran considerablemente las pérdidas, en la etapa de Conformación del IFA, desde un 15% hasta un 3%, mostrando parámetros de efectividad técnico - económica muy favorables.
BIBLIOGRAFÍA
1. Baltazares, L. et al ."Fibrinólisis con microdosis de estreptoquinasa en embolismo pulmonar". Rev Inst Nal Enf Resp Mex. 2000, vol. 13, n 2, pp. 110-116.
2. Buck, F., Boggiano E. "Interaction of streptokinase and human plasminogen.Function of the streptokinase moiety in the activator complex". J Biol Chem. 1971.vol. VI. 246, n. 7, pp. 2091-2096.
3. Baldarraín, A. et al. Multidomain structure of a recombinant streptokinase. A differential scanning calorimetry study. J Protein Chem. 2001 vol. 20, n. 1, pp. 9-17.
4. Páez, R. "Separación de proteínas por Cromatografía de Exclusión Molecular". Curso de Purificación de Biomoléculas para la Industria Biotecnológica. 2007. Centro de Ingeniería Genética y Biotecnología. La Habana. Cuba.
5. Márquez, G. "Introducción a la Purificación Cromatográfica de Proteínas". Curso de Purificación de Biomoléculas para la Industria Biotecnológica. 2007. Centro de Ingeniería Genética y Biotecnología. La Habana. Cuba.
6. Bourg, V. Los pirógenos en las producciones farmacéuticas parenterales. Avances y perspectivas. 2012. Centro Nacional de Biopreparados (BIOCEN).
7. Liners, F. "Distribution of pectic polysaccharides throughout walls of suspension-cultured carrot cells An immunocytochemical study". Protoplasma, 1992, vol. 170, n. 1-2, pp. 10-21.
8. Galanos, C. et al. "Biological Activities of Lipopolysaccharides and Lipid A". Infect Immun. 1977, vol. 16, n 2, pp. 407-412.
9. Parent, J., "Pyrogen Testing of Parenteral Products-Status Report". Sci Technol. 1984, vol. 38, n. 1, pp. 24-29.
10. Perdomo, R. "Ensayo del lisado de amebocitos del Limulus (LAL)". Rev Cubana Farm, 2004, vol. 38, n. 1.
11. Álvarez, S. Análisis de Procesos. Curso de Análisis de Procesos, Maestría en Análisis y Control de Procesos. 2007. La Habana. Cuba.
12. Llópiz, D. Expediente Maestro de Estreptoquinasa Recombinante. Centro Nacional de Biopreparados, Mayabeque, Cuba.
13. Llópiz, D. Paso a Paso de la Producción de Estreptoquinasa Recombinante. 2005, Centro Nacional de Biopreparados, Mayabeque, Cuba.
14. Llópiz, D. Cumplimiento de la Producción de Estreptoquinasa Recombinante del año 2007. 2007, Centro Nacional de Biopreparados, Mayabeque, Cuba.
Recibido: Noviembre 2014
Aprobado: Febrero 2015
MSc. Sadiely Sánchez-LabañinoI. Centro Nacional de Biopreparados, Bejucal, Mayabeque, Cuba.