My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Cirugía
Print version ISSN 0034-7493
Rev Cubana Cir vol.53 no.1 Ciudad de la Habana Jan.-Mar. 2014
PRESENTACIÓN DE CASOS
Resección hepática asistida con radiofrecuencia bipolar: primeras experiencias con el Surtron SB
Bipolar radiofrequency-assisted liver resection and first experiences with Surtron SB equipment
Dr. José Luis González González, Dr. José Antonio Copo Jorge, Dr. Joaquín Menéndez Núñez, Dr. Jesús González Villalonga
Grupo de Cirugía Hepatobiliopancreática. Servicio de Cirugía General, Hospital "Hermanos Ameijeiras". La Habana, Cuba.
RESUMEN
Las resecciones primarias y secundarias del hígado tienen como uno de sus mayores dilemas el sangrado transoperatorio. La introducción de los equipos de radiofrecuencia, en particular el Surtron SB, comienza a dar resultados alentadores. Se presentan las primeras 8 experiencias cubanas con resecciones menores y mayores realizadas con este equipo. Siete de estos pacientes tenían metástasis y uno un hepatocarcinoma. Se practicaron 2 resecciones regladas y 6 atípicas, durante las cuales no hubo complicaciones y solo un paciente necesitó transfusión sanguínea.
Palabras clave: resección hepática, radiofrecuencia, Surtron SB.
ABSTRACT
Primary and secondary liver resections have transoperative bleeding as one of its major dilemmas. The introduction of radiofrequency equipment, mainly Surtron SB, begins to bring about encouraging results. The first eight cases of minor and major resections in Cuba by using this piece of equipment were presented. Seven patients had metastasis and one hepatocarcinoma. Two standard and 6 atypical resections were performed with no complications and just one patient needing blood transfusion.
Keywords: liver resection, radiofrequency, Surtron SB equipment.
INTRODUCCIÓN
La resección constituye el tratamiento de elección para los tumores primarios y secundarios del hígado. En la actualidad es la única opción terapéutica curativa contra metástasis hepáticas de origen colorrectal que permite por sí misma obtener una sobrevida a mediano y largo plazo. Es un método eficaz y alcanza tasas de sobrevida a los 5 años del 26 al 45 %, cuando es casi nula en otros pacientes. En el mundo se documentan unos 700 000 casos nuevos anuales.
El tratamiento no está exento de morbilidad y mortalidad .Varios han sido los progresos en materia de anestesia y comprensión de la anatomía y fisiología hepáticas, pero la pérdida sanguínea transoperatoria aún persiste como uno de los mayores problemas por resolver, y está directamente relacionada con las complicaciones y la mortalidad. Con la intención de reducir el sangrado se han utilizado varias maniobras, como la de Pringle, la exclusión vascular total, la reducción de la presión venosa central y otras.
En el año 2002, Habib1 describió una técnica revolucionaria mediante el uso de radiofrecuencia monopolar (RF) para realizar resecciones hepáticas en cuña con mínimo sangrado. En el 2007, P. Rossi2 publicó sus primeras experiencias con la utilización del Surtron SB, un equipo generador de radiofrecuencia con tensión de incremento que, a modo de peineta, utiliza 6 agujas en línea (electrodos) que crean una línea de coagulación por efecto de la RF, lo cual permite una resección segura.
Este equipo tiene una frecuencia de trabajo de 470 KHz, una potencia de 150 W, opera con 160 V y cuenta con 5 circuitos bipolares. Tiene la ventaja sobre sus predecesores de alimentar a los diferentes electrodos de la peineta de manera tal que la diferencia —y no la suma de las corrientes que fluyen por el tejido atravesado por los electrodos— converge en cada electrodo intermedio. Ello se ha logrado al administrar a cada electrodo un voltaje superior al que le precede en secuencia (tensión en incremento).
De esta manera, la corriente fluye en los electrodos más alejados y en toda la impedancia de la porción de tejido comprendida entre los electrodos, mientras que no hay corriente entre los electrodos intermedios. El calor más acentuado en la vecindad de los electrodos más alejados determina la prioridad de coagulación y desecación para esos electrodos. La corriente que no puede continuar fluyendo a través de los electrodos más alejados se transfiere primero a los electrodos adyacentes y, una vez desecado el tejido alrededor de estos, la corriente se transfiere a los más internos hasta que se completa la coagulación.2
Para reducir la adhesión de los electrodos a los tejidos coagulados y, sobre todo, evitar la carbonización una vez obtenida la desecación, un microprocesador interrumpe automáticamente la corriente entre los electrodos, al censar el aumento de la impedancia entre ellos, y pasa a la siguiente pareja de electrodos.
A pesar de que el sistema utilizado para alimentar a los electrodos reduce las posibilidades de adherencia de estos a los tejidos, siempre se producen adherencias, por lo que los electrodos se recubren con capas sucesivas de CrN y NbN (microaleaciones nitrogenadas de cromo y niobio).2
DESCRIPCIÓN
El equipo es muy fácil de utilizar pues cuenta con un programa automatizado que permite analizar la impedancia entre el tejido por coagular y desencadenar automáticamente la secuencia de trabajo; cuando se obtiene el objetivo deseado, se detiene automáticamente. Es menester aclarar que no sustituye para nada el conocimiento cabal de la anatomía intrahepática y sus principios quirúrgicos; es meramente una herramienta muy útil para facilitar el trabajo de cirujanos bien entrenados en este tipo de técnica quirúrgica.
Puede utilizarse tanto para realizar resecciones mayores y menores regladas, como para resecciones atípicas o en cuña. Los electrodos siempre deben alejarse de las estructuras biliovasculares, las que se deben presillar o ligar independientemente, si fuera necesario. Es importante hacer una movilización adecuada del hígado para poder tener un control adecuado de la introducción de la peineta.
En esta pequeña serie de 8 pacientes, la técnica fue utilizada con éxito en 2 resecciones regladas y en 6 resecciones atípicas. Seis de los pacientes tenían metástasis hepáticas de un carcinoma colorrectal, uno tenía una recidiva hepática de una metástasis de carcinoma de mama, y otro paciente tenía un hepatocarcinoma.
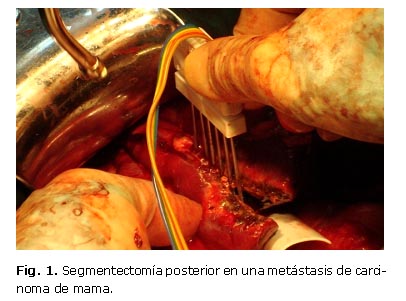
En la primera paciente de la casuística, que tenía una recidiva metastásica de un carcinoma de mama del segmento posterior, la metástasis se localizó mediante ultrasonido (US) transoperatorio simple y con Doppler en color. Previa identificación de la lesión y determinación de su relación con las estructuras vasculares, se completó la movilización del hígado y se marcó toda la cápsula de Glisson a modo de guía para delinear el segmento que se deseaba resecar. Se introdujo la peineta sucesivamente en el parénquima, haciendo una doble línea de coagulación entre la cual se fue seccionando el tejido con un bisturí frío, paulatinamente y con cuidado de no seccionar estructuras vasculares o biliares. Se obtuvo un espesor de 1,2 mm de coagulación. Los pedículos glissonianos se pinzaron con grapas o se ligaron individualmente (Fig. 1).
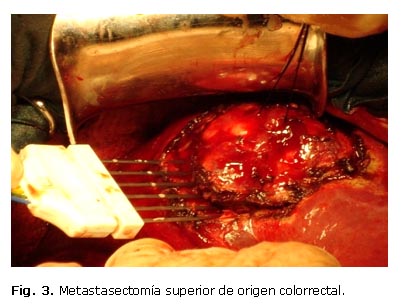
Otro de nuestros pacientes tenía múltiples metástasis hepáticas por un carcinoma colorrectal y se sometió a varias resecciones no regladas (Fig. 2). En las lesiones múltiples, que llegan a la superficie hepática, pero no incluyen todo su espesor, cuando se quiere economizar o conservar hígado sano, se puede tirar de la lesión mediante un punto por transfixión y la introducción paulatina de la peineta dando un ángulo que permita su resección con el margen oncológico adecuado (Fig. 3).
Datos como los diagnósticos, número de lesiones resecadas, tipo de resección, utilización de control vascular o no, complicaciones y cuantía de la transfusión sanguínea en los casos que la requirieron se muestran en la tabla.
DISCUSIÓN
Los principales problemas de la cirugía hepática, con repercusión negativa en la evolución de los enfermos, son la pérdida sanguínea, las fístulas biliares y la insuficiencia hepática. La pérdida sanguínea está directamente relacionada con un aumento de la morbilidad y una reducción de la supervivencia a largo plazo pues produce un efecto adverso en la función inmunitaria.
Múltiples han sido los medios desarrollados para controlar el sangrado durante la transección hepática: bisturí armónico, disector ultrasónico, sistema de sellado vascular de Ligasure, jet-disector, electrocauterio bipolar húmedo, clips y grapadoras laparoscópicas, y también los métodos para realizar la hemostasia del borde hepático remanente: argón, goma de fibrina, floseal®, tachosil®, peróxido de hidrógeno al 3 %, etc. Todos estos medios generalmente se utilizan combinados, así como las técnicas de control vascular y exclusión portal, como la maniobra de Pringle, el control glissoniano hiliar descrito por Launois3 y la oclusión temporal o el control preventivo de la cava inferior o superior, o de las venas hepáticas.
Sin duda, unos de los aportes más significativos, y que han permitido el desarrollo de la cirugía hepática per se, fueron los estudios anatómicos de Healy y Schroy (1953), Goldsmith,4 Couinaud5 y Bismuth,6 los cuales hicieron posible una resección a través de planos anatómicos, conservando los pedículos glissonianos, lo cual hizo que la cirugía fuera menos sangrante y se economizara parénquima sano. Por último, la utilización del ultrasonido transoperatorio con Doppler se ha convertido en rutina en todos los grupos que practican cirugía hepática. Este permite no solo la identificación de lesiones en muchas ocasiones insospechadas o no palpables, sino la identificación de la anatomía intrahepática, lo que posibilita realizar resecciones sin afectar las estructuras biliovasculares.
Habib1 fue el primero en usar la radiofrecuencia monopolar en las resecciones hepáticas utilizando un electrodo sencillo, el cual introdujo varias veces alrededor del área que pretendía resecar. Posteriormente utilizó electrodos múltiples en aras de disminuir el tiempo quirúrgico, y obtuvo igualmente buenos resultados. Este autor y Zacharoulis7 realizaron desde resecciones limitadas hasta hepatectomías derechas exitosas. Gananadha y Morris8 publicaron sus experiencias con un prototipo que utilizaba 11 electrodos bipolares, y luego 6, con profundidad variable, y un generador RITA1500® (Mountain View, EE. UU.) con el que obtuvieron experiencias similares.
En Cuba, lamentablemente, no contamos con muchos de estos artificios técnicos, por lo que, básicamente, las resecciones hepáticas se realizan utilizando la tradicional técnica de Kelly-clasia o digitoclasia, la cual suele ser muy rápida, pero sangrante. Sin embargo, algunos autores como Lasurtel,9 quien realizó un estudio comparativo entre la Kelly-clasia con oclusión portal temporal y la utilización de CUSA®, Hidrojet y Ligasure® (las cuatro técnicas por separado), sin oclusión portal, encontró superior a la primera por ser más rápida, menos sangrante y requerir menos transfusiones.
Ocurre que en muchas ocasiones el control vascular no es posible o conveniente, y estos pacientes cada vez son más numerosos, pues se trata de los pacientes más complejos. Esta es la situación de los enfermos con hipertensión portal, con circulación colateral o con cirugía abdominal previa, donde la disección hiliar puede ser peligrosa.
El Surtron SB es un equipo desarrollado por los laboratorios LEDSpA en colaboración con la Universidad de Tor Vergata, de Roma (Italia). Permite crear un área de coagulación en línea a través del parénquima hepático, lo cual facilita la resección y disminuye de forma segura el sangrado. Su utilización es bien sencilla y no necesita de un entrenamiento previo para el cirujano hepatobiliar. Puede usarse tanto para resecciones menores como mayores, y además disminuye las necesidades de transfusión, la presentación de fístulas biliares y, posiblemente, la aparición de recidivas tumorales en el área de resección.
Los resultados de nuestra pequeña serie fueron muy alentadores (tabla). Solo a dos de los ocho pacientes intervenidos se les practicó una resección reglada (segmentectomía posterior por una recidiva metastásica de un carcinoma de mama y una hemihepatectomía derecha por un hepatocarcinoma). Los restantes pacientes con metástasis de adenocarcinomas colorrectales recibieron desde dos hasta cinco resecciones atípicas, que no tuvieron complicaciones y facilitaron la resección al cirujano.
Este trabajo no incluye el seguimiento a largo plazo pues solo interesaban los aspectos perioperatorios atribuibles al uso del Surtron SB. Como sugiere la bibliografía,10-15 se deberán analizar estudios controlados en series más numerosas para conocer el verdadero lugar de este equipo en el arte de la cirugía hepática.
En conclusión, estas primeras experiencias con el uso del Surtron SB fueron muy satisfactorias y permitieron un ahorro significativo de sangre al seccionar sobre tejido eficientemente coagulado. La recuperación de los pacientes transcurrió sin morbilidad y con mortalidad cero, por lo que recomendamos su uso en este tipo de resección. Entre las deficiencias o inconvenientes que señalan los diseñadores del equipo se encuentra las adherencias del tejido a los electrodos, las cuales fueron fáciles de desprender con el rocío de solución salina y una tracción suave de la peineta. El mayor inconveniente surge al tener que hacer resecciones hacia los segmentos posteriores, donde es difícil introducir y posicionar la peineta puesto que esta no presenta articulación.
REFERENCIAS BIBLIOGRÁFICAS
1. Weber JC, Navarra G, Jiao L, Nichols J, Jensen SL, Habib NH. New technique of liver resection using heat coagulative necrosis. Annals of Surgery. 2002;236(5):560-563.
2. Rossi P, de Majo A, Muti A, Quattrini V, Mattei M. Bloodless hepatic resection with automatic bipolar radiofrequency generator and multielectrode device. Minimally Invasive Therapy. 2007;16:1;66-72.
3. Launois B, Jamieson GG. The posterior intrahepatic approach for hepatectomy or removal of segments of the liver. Surgery Gyneacology and Obstetrics. 1992;174:155-8.
4. Goldsmith NA, Woodburne RT. Surgical anatomy pertaining to liver resection. Surgery Gyneacol Obstetrics. 1957;105-310.
5. Couinaud C. Le Foie. Paris: Masson et Cie; 1957.
6. Bismuth H. Surgicalanatomy and anatomical surgery of the liver. World J. Surg. 1982;6:3-9.
7. Zacharoulis D, Tvovaras G, Rountas C, Poultsidis A, Sioka E, Hatzitheofilou C. How I do it. Modified radiofrequency-assisted liver resection: a new device. Journal of Surgical Oncology. 2007. DOI 10.1002/jso 1-4.
8. Gananadha S, Morris DL. Novel in line multielectrode radiofrequency ablation considerably reduces blood loss during liver resection in animal model. ANZ. Jornal of Surgery. 2004;74:482-5.
9. Lesurtel M, Selner M, Petrowsky H, McCormack L, Clavien PA. How should transection of the liver be performed?: a prospective randomized study in 100 consecutive patients : comparing four different transection strategies. Annals of Surgery. 2005;242(6):814-22, discussion 822-3.
10. Galizia G, Castellano P, Pinto M, Zamboli A, Orditura M, De Vita F, Lieto E. Radiofrequency-assisted liver resection with a comb-shaped bipolar device versus clamp crushing: A Clinical Study. Surgical Innovation. 2012;19(4):407-414.
11. Pai M, Frampton AE, Mikhail S, Resende V, Kornasiewicz O, Spalding D R, Habib NA. Radiofrequency assisted liver resection: analysis of 604 consecutive cases. European Journal of Surgical Oncology (EJSO). 2012;38(3):274-80.
12. Percivale A, Griseri G, Benatti E, Gastaldo A, Benasso M, Giovanni S, Pellicci R. Radiofrequency-assisted liver resection: Analysis of the operative strategy for oncological liver resection. European Journal of Surgical Oncology. 2012;38(10):991-2.
13. Li M, Zhang W, Li Y, Li P, Li J, Gong J, Chen Y. radiofrequency-assisted versus clamp-crushing parenchyma transection in cirrhotic patients with hepatocellular carcinoma: A Randomized Clinical Trial. Digestive Diseases and Sciences. 2012:1-6.
14. Ihnat P, Vavra P, Rudinska L, Ostruszka P, Dostalik J. Radiofrequency-assisted liver resection: short-term results in a single institution. Bratislavske Lekarske Listy. 2012;114(1):19-22.
15. Alexiou VG, Tsitsias T,Mavros MN, Robertson GS, Pawlik TM. Technology-Assisted Versus Clamp-Crush Liver Resection A Systematic Review and Meta-analysis. Surgical innovation. 2012;20(4):414-28.
Recibido: 23 de abril de 2013.
Aprobado: 16 de mayo de 2013.
Dr. José Luis González González. Grupo de Cirugía Hepatobiliopancreática. Servicio de Cirugía General, Hospital "Hermanos Ameijeiras". Calle Padre Varela y San Lázaro, Centro Habana. La Habana, Cuba. Correo electrónico: joseluis@infomed.sld.cu