My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Estomatología
Print version ISSN 0034-7507
Rev Cubana Estomatol vol.49 no.2 Ciudad de La Habana Apr.-June 2012
ARTÍCULO ORIGINAL
Efeito antifúngico de tinturas de própolis e romã sobre espécies de Candida
Efecto antimicótico de las tinturas a partir de propóleo y pomegranate contra las especies de Candida
Antifungal effect of tinctures from propolis and pomegranate against species of Candida
MSc. Leopoldina de Fátima Dantas de Almeida, Bachiller Yuri Wanderley Cavalcanti, Bachiller Ronaldo Lira Júnior, Dra. Edeltrudes de Oliveira Lima, Dr. Ricardo Dias de Castro
Universidade Federal da Paraíba, Brasil.
RESUMO
A utilização de produtos naturais na odontologia tem se mostrado como uma fonte alternativa no combate às patologias orais, incluindo as infecções fúngicas, causadas, geralmente, por Candida spp. Avaliar a ação antifúngica de tinturas de própolis Apis milifera e romã Punica granatum sobre Candida albicans (ATCC 76618), Candida krusei (ATCC 6538) e Candida tropicalis (ATCC 13803). A ação antifúngica das tinturas foi avaliada pelo método da Concentração Inibitória Mínima em meio de cultura sólido Ágar Saburaud Dextrose (Difco®). Foram confeccionados poços, com 6 mm de diâmetro, destinados a inserção de 50 µL das tinturas. Foram avaliadas seis concentrações seriadas das tinturas, sendo a concentração inicial para a tintura de própolis 200 mg/mL e 300 mg/mL a concentração inicial para a tintura de romã. Posteriormente, as placas de Petri foram incubadas em estufa bacteriológica por 48 h a 37 ºC. A análise dos dados para a Concentração Inibitória Mínima foi feita através da mensuração dos halos de inibição, sendo considerados quando iguais ou superiores a 10 mm de diâmetro. Para a tintura de romã observou-se que as Concentração Inibitória Mínima sobre Candida albicans, Candida krusei e Candida tropicalis foram 9,37 mg/mL, 9,37 mg/mL e 18,75 mg/mL, respectivamente. Em relação à tintura da própolis, constatou-se que apenas em sua forma pura apresentou ação antifúngica sobre Candida krusei e Candida tropicalis, entretanto a mesma ação não foi observada sobre Candida albicans. As tinturas avaliadas apresentam ação antifúngica sobre as cepas avaliadas, exceto a tintura da própolis sobre Candida albicans.
Palavras chave: Candida albicans, Apis mellifera, Punica granatum.
RESUMEN
Se ha demostrado que el uso de productos naturales en Estomatología es una fuente alternativa contra las enfermedades orales, incluyendo las infecciones micóticas, generalmente causadas por Candida spp. El objetivo de este trabajo fue evaluar la acción antimicótica de las tinturas a partir del propóleo (Apis milifera) y a partir de pomegranate (Punica granatum) sobre Candida albicans (ATCC 76618), Candida krusei (ATCC 6538) y Candida tropicalis (TCC 13803). La actividad antimicótica de las tinturas fue evaluada por el método Minimum Inhibitory Concentration en Aagar Dextrosa Saburaud (Difco®). Se crearon 6 orificios con un diámetro de 6 mm para la inserción de 50 µL de tinturas. Se evaluaron 6 concentraciones seriadas donde la concentración inicial para las tinturas a partir de propóleo fue de 200 mg/mL y de 300 mg/mL como concentración inicial para la tintura a partir de pomegranate. Posteriormente, los discos de Petri fueron incubados durante 48 h a 37ºC. El análisis de los datos para Minimum Inhibitory Concentration fue realizado midiendo las zonas de inhibición, se consideró inhibición cuando es igual o mayor de 10 mm de diámetro. En el caso de la tintura de pomegranate, se comprobó que la Minimum Inhibitory Concentration en Candida albicans, Candida krusei y Candida tropicalis fueron de 9,37 mg/mL, 9,37 mg/mL y 18,75 mg/mL respectivamente. Para las tinturas a base de propóleo, la acción antimicótica fue verificada solo en la concentración pura sobre Candida krusei y Candida tropicalis, pero no fue observada en Candida albicans. Las tinturas a base de pomegranate y propóleo tuvieron actividad antimicótica sobre las cepas evaluadas, excepto en el caso de la tintura a base de propóleo sobre Candida albicans.
Palabras clave: Candida albicans, Apis mellifera, Punica granatum.
ABSTRACT
The use of natural products in Dentistry has been shown as an alternative source against oral diseases, including fungi infections, generally caused by Candida spp. The aim was to evaluate the antifungal action of tinctures from propolis (Apis milifera) and from pomegranate (Punica granatum) on Candida albicans (ATCC 76618), Candida krusei (ATCC 6538) and Candida tropicalis (ATCC 13803). The antifungal activity of tinctures was evaluated by Minimum Inhibitory Concentration method on Saburaud Dextrose Agar (Difco®). Six wells were confectioned, with 6 mm of diameter, to the insertion of 50 µL of tinctures. Six serial concentrations were evaluated, been 200 mg/mL the initial concentration for tincture from propolis and 300 mg/mL the initial concentration for tincture from pomegranate. Later, the Petri plates were incubated in bacteriological incubator for 48 h on 37 ºC. Data analysis for Minimum Inhibitory Concentration was conducted by measurement of inhibition zones, been considered inhibited when equal or bigger than 10 mm of diameter. For tincture from pomegranate, was verified that the Minimum Inhibitory Concentration on Candida albicans, Candida krusei and Candida tropicalis were 9.37 mg/mL, 9.37 mg/mL and 18.75 mg/mL, respectively. For tinctures from propolis, the antifungal action was verified only in pure concentration on Candida krusei and Candida tropicalis, but it was not observed on Candida albicans. The tinctures from pomegranate and propolis had antifungal activity on evaluated strains, except for tincture from propolis on Candida albicans.
Key words: Candida albicans, Apis mellifera, Punica granatum.
INTRODUÇÃO
A candidíase é definida como infecção fúngica bucal, mais prevalente, sendo geralmente diagnosticada por meio da descamação do epitélio bucal, além de seu aspecto eritematoso com presença de placas brancas destacáveis sobre a mucosa; sensação de ardência e prurido.1 A Candida albicans é citada como a espécie de maior patogenicidade, predominantemente encontrada em lesões de candidíase na mucosa bucal, no entanto, observa-se o aumento no número de espécies não albicans no curso da infecção, a exemplo: C. tropicalis, C. krusei, C. parapsilosis e C. guilliermondii.2
Em indivíduos imunocomprometidos, especialmente os acomeditos pelo HIV/AIDS, cerca de 74 % apresentam lesões na mucosa bucal ocasionados por infecções causadas por Candida spp.3,4 Ressalta-se que nestes indivíduos a candidíase bucal pode funcionar como um marcador da progressão da doença e preditivo para o aumento da imunossupressão. Diante desse contexto, a pesquisa de novos agentes terapêuticos torna-se uma medida relevante.5
Mesmo com o emprego de diversos medicamentos existe a possibilidade de cepas resistentes, conforme apresentado por Rex e outros,2 no qual se verificou relatos de casos referentes à resistência medicamentosa da C. albicans frente a derivados azólicos, em pacientes HIV positivos com diagnóstico de candidose bucal. Assim, diante do evidente crescimento do número de patógenos resistentes aos antimicrobianos atualmente utilizados na clínica, verifica-se emergente necessidade de introduzir novos agentes antimicrobianos no arsenal terapêutico.6
No que se refere à resistência de cepas de Candida aos antifúngicos sintéticos azólicos, como fluconazol, miconazol e intraconazol, diversos mecanismos contribuem para o fenômeno de resistência, entre eles destacam-se: a superexpressão ou mutação do gene ERG11, que codifica a enzima alvo dos azóis, a lanosterol 14-á-desmetilase;7 a superexpressão de genes CDR1, CDR2 e MDR1 que codificam bombas de efluxo;8-10 alterações do gene ERG-3 que codifica a enzima 5-6 esterol dessaturase, importante na síntese do ergosterol,11 bem como alterações na composição lipídica da membrana plasmática fúngica, o que dificulta o influxo do fármaco na célula.12 Ressalta-se que estes mecanismos podem ocorrer simultaneamente, contribuindo para ampliar o fenômeno de resistência.
Diante do exposto, verifica-se a necessidade de estudos sobre a atividade de produtos naturais, na tentativa de obter-se melhor desempenho sobre tais microrganismos.5,13 A utilização de plantas medicinais, devido às suas propriedades anti-sépticas, é verificada desde a antiguidade. Entretanto, evidências clínicas e laboratoriais sobre a efetividade desses elementos ainda são escassas na literatura.14,15
A utilização destes produtos naturais, visando à produção de substâncias com atividade antimicrobiana capaz de interferir no desenvolvimento do biofilme bucal, se faz uma alternativa válida. Além disto, outras patologias bocais, como a candidose bucal, podem receber como terapêutica o emprego de produtos naturais16 dentre esses estão substâncias a base de Apis milifera (própolis) e Punica granatum (romã).
Relatos sobre a ação antibacteriana e antifúngica de extratos de Apis milifera (própolis) e Punica granatum (romã) têm sido descritos por vários estudos.17-21 Um dos principais componentes responsável pela ação antimicrobiana desses produtos é o glicosídeo flavanóide, o qual tem propriedades anti-sépticas e antiinflamatórias.21 Diante disto, objetivou-se avaliar a ação antifúngica das tinturas de própolis (Apis milifera) e romã (Punica granatum Linn), nas concentrações de 20 g/mL e 30 g/mL, respectivamente, sobre C. albicans (ATCC76618), C. tropicallis (ATCC13803) e C. krusei (ATCC 6538).
MÉTODO
Realizou-se um estudo laboratorial de natureza experimental e descritiva. As tinturas foram preparadas por meio da maceração das matérias primas secas. Foram selecionadas concentrações de 200 mg/mL e 300 mg/mL, para tinturas de própolis e romã, respectivamente. A partir da concentração inicial, foram obtidas cinco concentrações seriadas decrescentes das tinturas de própolis (100 mg/mL a 6,25 mg/mL), e da romã (150 mg/mL a 4,68 mg/mL). Assim, seis concentrações tiveram seu potencial antifúngico avaliados. A fim de compararmos a ação antifúngica das tinturas, foi utilizado como controle a Nistatina® (100,000 UI/mL suspensão oral), em sua formulação pura, já que se apresenta pronta para uso clínico.
Foram utilizadas cepas padrão de C. albicans (ATCC76618), C. tropicallis (ATCC13803) e C. krusei (ATCC 6538). Foram preparadas suspensões, em solução salina estéril, das cepas de C. albicans, C. tropicallis e C. krusei, de forma que foram comparados à escala de Mac Farland (1,5 x 106 microrganismos/mL).
A ação antifúngica das tinturas foi determinada por meio da metodologia da difusão em meio sólido, utilizando-se Agar Saburaud Dextrose (Difco®). Assim, as placas foram semeadas através da técnica do esgotamento. Em seguida, foram perfurados sete poços, com 6 mm de diâmetro destinados à inserção das substâncias diluídas e puras. Após, a inserção de 50 µL das amostras, as placas foram incubadas em estufa bacteriológica a 37 ºC por 48 horas.20
A análise dos dados para a Concentração Inibitória Mínima (CIM) foi efetuada pela mensuração dos halos de inibição, considerados quando iguais ou superiores a 10 mm de diâmetro.13 Os testes foram realizados em triplicata com o objetivo de dar maior confiabilidade ao estudo. Em seguida, foram extraídas as médias aritméticas dos valores dos diâmetros dos halos de inibição.
RESULTADOS
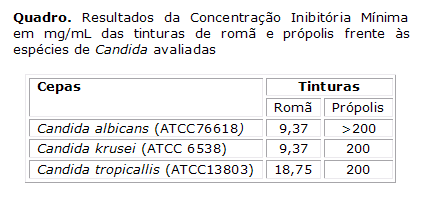
As CIM dos produtos testados sobre as cepas C. albicans, C. tropicalis, e C. krusei são apresentados no Quadro. A tintura de Romã apresentou atividade antifúngica nas concentrações 9,37 mg/mL e 18,75 mg/mL. A tintura de própolis não apresentou atividade sobre C. albicans (CIM>200 mg/mL) e apresentou CIM nas concentrações 200 mg/mL frente C. krusei e C. tropicalis. Observou-se sensibilidade de todas as leveduras frente à Nistatina® (100,000 UI/mL suspensão oral), utilizada como controle (quadro).
DISCUSSÃO
Atividade antimicrobiana de extratos de Apis milifera (própolis) e Punica granatum (romã) tem sido investigada por vários autores.17-20 Entretanto, não se observam dados à cerca de estudos com tais produtos na formulação de tintura, meio mais viável e de baixo custo para produção, os quais devem ter sua atividade antimicrobiana documentada.
Constatou-se que a tintura de própolis frente à C. albicans não apresentou eficácia, não corroborando com estudo realizado por Dias e outros,22 que investigaram a ação de extratos etanólico e aquoso de própolis frente à C. albicans (ATCC 18804), C. tropicalis (ATCC 750), C. glabrata (ATCC 2001), C. parapsilosis (ATCC 22019), C. krusei (ATCC 2340) e C. guilliermondii (ATCC 201935). Entretanto, frente às demais espécies estudadas, observou-se efetividade da tintura de própolis, concordando com o referido estudo.22
O resultado controverso frente às leveduras de mesma espécie pode ser explicado pela presença de fatores de virulência distintos, já que não apresentam a mesma especificação. Outra hipótese seria a diferença fenotípica entre as espécies, de forma que a resposta frente ao uso de produtos à base própolis pode ser distinta, conforme observado no presente ensaio.
A composição e forma de manipulação dos produtos naturais podem interferir na ação antifúngica, já que Dias e outros22 relataram que existem diferenças de resultados frente ao uso de extratos etanólicos e aquosos sobre cepas de Candida. Assim destaca-se que estes requisitos técnicos, bem como os veículos utilizados e as formas de extração do princípio ativo, neste caso a produção de extrato ou tintura, poderia interferir na ação antifúngica, pois haverá diferença na concentração do princípio ativo responsável pela atividade antifúngica.
A atividade da tintura de romã foi observada em baixas concentrações (9,37 mg/mL), frente as cepas C. albicans e C. krusei, o que indica ação antimicrobiana dos produtos em baixas concentrações. Entretanto, Nascimento e outros23 relatam que atividade antifúngica da fração hidroalcoólica do extrato de romã não inibiu o crescimento de C. albicans, quando se investigou a CIM do produto por meio da difusão em ágar, metodologia utilizada também no presente estudo. O mesmo estudo relatou a ação antibacteriana frente às espécies Pseudomonas aeruginosa e Bacillus subtilis.
Utilizando-se a técnica da microdiluição Holetz e outros24 avaliaram a CIM da P. granatum sobre C. albicans, C. krusei, C. parapsilosis e C. tropicalis, além de algumas espécies bacterianas. Observaram que o extrato foi eficaz frente à maioria das leveduras com CIM de 15,6; 12,5 e 15,6 µg/mL sobre C. krusei, C. parapsilosis e C. tropicalis, respectivamente. Entretanto, sobre C. albicans, o produto não apresentou atividade efetiva, sendo a CIM superior a 1000 µg/mL. Considerando-se as diferenças metodológicas entre o estudo de Holetz e outros24 e a presente investigação, observou-se atividade bem sucedida frente C. krusei e C. tropicalis.
Entretanto é valido destacar as diferenças de CIM dos estudos, observando-se que Holetz e outros24 utilizaram um extrato etanólico de romã, enquanto no presente ensaio utilizou-se uma tintura, assim justificando a discrepância nas CIM. Diante do exposto, considerando-se as limitações do estudo in vitro, sendo o mesmo de base experimental, observa-se o potencial antifúngico dos produtos avaliados nas devidas concentrações. Desta forma, se faz necessário a aplicação de outros testes de atividade antifúngica in vitro e in vivo, em concentrações diferenciadas, para que a utilização clínica dos produtos possam ser validada e realizada de forma segura e eficaz. Concluíram-se as tinturas estudadas apresentaram ação antifúngica sobre as cepas avaliadas, exceto a tintura da própolis sobre C. albicans.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Neville BW, Damm DD, Allem CM, Bouquot JE. Patologia oral e maxilofacial. São Paulo: Guanabara Koogan; 2009.
2. Rex JH, Walsh TJ, Sobel JD, Filler SG, Pappas PG, Dismukes WE, Edwards JE. Practice guidelines for the treatment of candidiasis. J Infect Dis. 2000;30(4):662-78.
3. Gabler IG. Incidence and anatomic localization of oral Candidiasis in patients with aids hospitalized in a public hospital in Belo Horizonte, MG, Brazil. J Appl Oral Sci Bauru. 2008;16(4):247-50.
4. Gasparin AB. Prevalence of oral lesions in persons with HIV and associated factors in a southern Brazilian city. Cad Saúde Pública. 2009;25(6):1307-15.
5. Siddiqui M, Khan AU. Antimicrobial activity of five herbal extracts against multi drug resistant (MRD) strains of bacteria and fungus of clinical origin. Molecules. 2009;14(2):586-97.
6. Pozzatti P, Scheid LA, Spader TB, Atayde ML, Santurio JM, Alves SH. In vitro activity of essential oils extracted from plants used as spices against fluconazole-resistant and fluconazole-susceptible Candida spp. Can J Microbiol. 2008;54(11):950-60.
7. Khan R, Islam B, Akram M, Shakil S, Ahmad AA, Ali SM, et al. Antimicrobial activity of five herbal extracts against multi drug resistant (MRD) strains of bacteria and fungus of clinical origin. Molecules. 2009;14(2):586-97.
8. Marichal P, Koymans L, Willemsens S, Bellens D, Verhasselt P, Luyten W, et al. Contribution of mutations in the cytochrome P450 14á-demethylase (Erg11p, Cyp51p) to azole resistance in Candida albicans. Microbiology. 1999;145(1):2701-13.
9. Basso-Junior LR, Gast CE, Mao Y, Wong B. Fluconazole transport into Candida albicans Secretory Vesicles by the Membrane Proteins Cdr1p, Cdr2p, and Mdr1p. Eukaryotic Cell. 2010;9(6):960-70.
10. Manoharlal R, Gorantala J, Sharma M, Dominique S, Prasad R. PAP1 [poly(A) polymerase 1] homozygosity and hyperadenylation are major determinants of increased mRNA stability of CDR1 in azole-resistant clinical isolates of Candida albicans. Microbiology. 2010;156(1):313-26.
11. White TC, Marr KA, Bowden RA. Clinical, cellular and molecular factors that contribute to antifungal drug resistance. Clinical Microbiology Reviews. 1998;11(2):382-402.
12. Howell SA, Mallet AI, Noble WC. A comparison of the sterol content of multiple isolates of the Candida albicans. Darlington strain with other clinically azole-sensitive and resistant strains. J Appl Microbiol. 1990;69(5):692-6.
13. Castro RD, Lima EO. Atividade antifúngica dos óleos essenciais de sassafrás (Ocotea odorifera Vell.) e alecrim (Rosmarinus officinalis L.) sobre o gênero Candida. Rev Bras Pl Med. 2011;13(2):203-8.
14. Almeida LF, Cavalcanti YW, Viana WP, Lima EO. Screening da atividade antifúngica de Óleos Essenciais sobre Candida Albicans. Revista Brasileira de Ciências da Saúde. 2011;14(4):51-6.
15. Silveira PF, Bandeira MAM, Arrais PSD. Farmacovigilância e reações adversas às plantas medicinais e fitoterápicas: uma realidade. Revista Brasileira de Farmacognosia. 2008;18(4):618-26.
16. Cavalcanti YW, Almeida LDF, Padilha WWN. Anti-adherent activity of Rosmarinus officinalis essential oil on Candida albicans: an SEM analysis. Rev Odonto Cienc. 2011;26(2):139-44.
17. Soares DGS, Olievira CB, Leal C, Drumond MRS, Padilha WWN. Susceptibilidade in vitro de bactérias bucais a tinturas fitoterápicas. Rev Odonto Ciênc. 2006;21(53):232-8.
18. Almeida RVD, Castro RD, Pereira MSV, Paulo MQ, Santos JP, Padilha WWN. Efeito clínico de solução anti-séptica a base de própolis em crianças cárie ativas. Pesq Bras Odontop Clin Integr. 2006;6(1):87-92.
19. Schreiner F. Uso do chá de Punica granatum (romã) no controle da aderência de bactérias orais em ligaduras ortodônticas. Robrac. 2009;18(45).
20. Molina FP. Própolis, sálvia, calêndula e mamona-atividade antifúngica de extratos naturais sobre cepas de Candida albicans. Cienc Odontol Bras. 2008;11(2):86-93.
21. Pereira JV, Pereira MSV, Sampaio FC, Sampaio MCC, Alves PM, Araújo CRF, et al. Efeito antibacteriano e antiaderente in vitro do extrato da Punica granatum Linn sobre microrganismos do biofilme dental. Rev Bras Farmacogn. 2006;16(1):88-93.
22. Dias SMD, Gomes RT, Santiago WK, Paula AMB, Cortés ME, Santos VR. Antifungal activity of commercial ethanolic and aqueous extracts of Brazilian propolis against Candida spp. Rev Ciênc Farm Básica Apl. 2007;28(3):259-63.
23. Nascimento GGF, Locatelli J, Freitas PC, Silva GL. Antibacterial activity of plant extracts and phytochemicals on antibiotic resistant bacteria. Braz J Microbiol. 2000;31(1):247-56.
24. Holetz FB, Pessini GL, Sanches NR, Cortez DA, Nakamura CV, Dias Filho BP. Screening of some plants used in the brazilian folk medicine for the treatment of infectious diseases. Mem Inst Oswaldo Cruz. 2002;97(7):1027.
Recibido: 31 de mayo de 2011.
Aprobado 20 noviembre de 2011.
Dra. Leopoldina de Fátima Dantas de Almeida. Universidade Federal da Paraíba, Brasil. Correo electrónico: leopoldinalmeida@hotmail.com