My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Farmacia
On-line version ISSN 1561-2988
Rev Cubana Farm vol.31 no.2 Ciudad de la Habana Jan.-Aug. 1997
Variantes del método de Berthelot
Lilliam Valdés Diez,1 Ángela Iliana González García,2 María Elena Rodríguez Párraga,3 Omaira Rodríguez Villar4 y Mariela Sijó Yero51 Licenciada en Química. Investigadora Auxiliar.
2 Licenciada en Bioquímica.
3 Licenciada en Química.
4 Técnica en Química.
5 Licenciada en Ciencias Farmacéuticas.
RESUMEN
Se ensayaron 3 métodos para la determinación de urea en suero, basados en la reacción de Berthelot, utilizando fenol, timol y salicilato de sodio, y se compararon con el método de la diacetil monoxima, con vistas a seleccionar el más adecuado. Se evaluó la imprecisión, inexactitud y linealidad de cada uno de ellos. En todos los ensayos realizados se obtuvo linealidad desde 4,9950 hasta 24,9750 mmol/L de urea; en la evaluación de la imprecisión los valores en coeficiente de variación fueron menores de 7 y en el estudio de inexactitud se obtuvieron valores del coeficiente de correlación mayores de 0,98 en todos los casos.Descriptores DeCS: COLORIMETRIA/métodos; JUEGO DE REACTIVOS PARA DIAGNOSTICO; UREA/sangre; QUIMICA CLINICA; FENOLES; TIMOL; SALICILATO DE SODIO; HIPOCLORITO DE SODIO; CALIBRACION; ESTANDARES DE REFERENCIA.
La determinación de urea reviste gran importancia para el diagnóstico clínico de diversas afecciones generalmente de origen renal; por lo que contar con un juego de reactivos que permita obtener valores confiables en esta determinación es un objetivo básico en la producción de reactivos para química clínica.
Por la estructura de la molécula de urea, diversos autores han encaminado los métodos para su determinación en 2 grandes grupos: métodos directos y métodos indirectos.
En los métodos directos la reacción transcurre con la molécula sin previa transformación, especialmente por los grupos amino de ésta, según la ecuación de la figura 1.
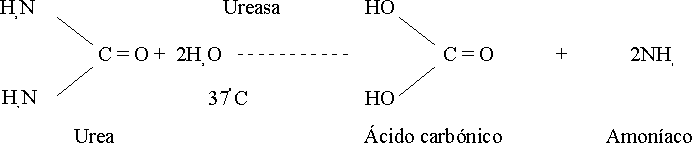
Así ocurre la reacción de Fearon con la diacetil monoxima-tiosemicarbazida (DAM-TSC) en un medio ácido fuerte y con un agente oxidante,1 y es en la década de los 70 que se introduce el empleo de la antipiridina.
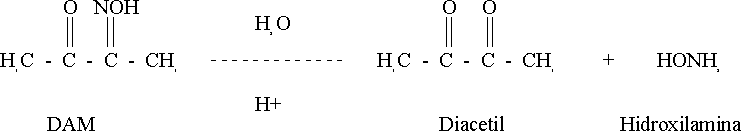
La cuantificación colorimétrica en los métodos indirectos es utilizada por Cam, Barrier y Lawny,2 quienes estudiaron una selección de derivados fenólicos capaces de formar un reactivo estable con la ureasa y su aplicación en química clínica, como son: timol, m-cresol, ácido salicílico y sus derivados.
Hanadas y Yamanishi,3 por una parte, y Tabacco, Meiattini y Moda4 estudiaron la reacción colorimétrica para cuantificar urea con un reactivo que contiene fenol o sus derivados como cromógenos y agentes oxidantes.
Un estudio de la espectrofotometría y la cinética de la reacción en estos métodos se plantea por Patton y Crouch;5 la reacción transcurre según la ecuación general de la figura 2.
La coloración del producto final (indofenol) de la reacción depende del derivado fenólico utilizado.

MÉTODOS
Los ensayos de imprecisión e inexactitud se realizaron en muestras de suero control liofilizado lote 7010, producido en el Departamento de Investigaciones de la Empresa de Productos Biológicos "Carlos J. Finlay". Se utilizaron soluciones de referencia de urea para la curva de calibración en un rango de concentraciones desde 4,9950 hasta 24,9750 mmol/L. Las lecturas se efectuaron en un equipo Pye-Unicam, modelo PU 8745 (UV-VIS).Se utilizó como método de referencia el de la diacetil monoxima (DAM).1
Preparación de los reactivos
- Reactivo 1: Solución reactivo de tungstato de sodio 0,303158 mol/L.
- Reactivo 2: Solución reactivo de ácido sulfúrico 0,08332 mol/L.
- Reactivo 3: Solución reactivo de ácido fosfórico 6,1224 mol/L.
- Reactivo 4: Solución reactivo de DAM-TSC.
- RT1-2: Se mezclaron 9 mL de la solución reactivo 2 con 1 mL de la solución reactivo 1, justamente antes de usar.
- RT3-4: Se mezclaron 10 mL de la solución reactivo 3 y 2 mL de la solución reactivo 4, justamente antes de usar. La solución no es estable por más de 1 h.
Las muestras se desproteinizaron con el RT1-2 y se prepararon diluciones de 1:10 para las soluciones de referencia de urea.
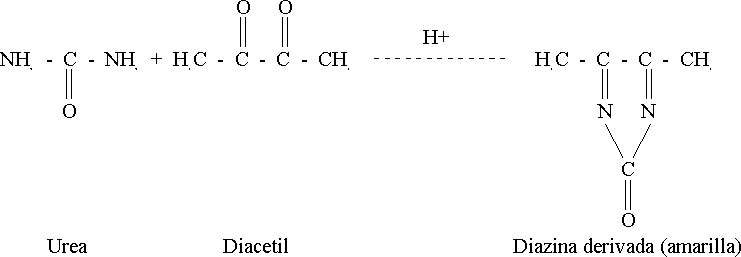
Reacción de coloración
| | | | |
| Solución de referencia | | | |
| Suero | | | |
| Agua destilada | | | |
| RT3-4 | | | |
Método de Berthelot y sus modificaciones
La preparación de los reactivos se presentó de la manera siguiente:
- Reactivo 1: Solución de referencia de urea (urea, para análisis, estabilizada).
- Reactivo 2: Ureasa liofilizada 5 U/mL (enzima extraída de Jack Bean Meal, desgrasada, estabilizada y liofilizada).
- Reactivo 3: Solución reactivo de fenol 0,11 mol/L y nitroprusiato de sodio 0,17 mmol/L.
- Reactivo 4: Solución reactivo de timol 3,3284 mmol/L y nitroprusiato de sodio 3,3562 mmol/L.
- Reactivo 5: Solución reactivo de salicilato de sodio 52 mmol/L y nitroprusiato de sodio 2,83 mmol/L.
- Reactivo 6: Solución reactivo de hipoclorito de sodio 11 mmol/L en hidróxido de sodio 0,125 mol/L.
- RT1: Listo para usar.
- RT2: Se restituyó un bulbo con 20 mL de una solución buffer de fosfato y EDTA pH 7,0. La solución es estable a la temperatura ambiente por un período de 12 h.
- RT3 ó RT4 ó RT5: Se tomó el contenido de un frasco del reactivo 3 ó 4 ó 5 y se llevó a 500 mL con agua destilada en un frasco volumétrico.
- RT6: Se tomó el contenido de un frasco del reactivo 6 y se llevó a un frasco volumétrico de 500 mL.
| | | | |
| Agua destilada | | | |
| RT1 | | | |
| Suero | | | |
| RT2 | | | |
RT3 ó RT4 ó
RT5 1,5 mL 1,5 mL 1,5 mL
RT6 1,5 mL 1,5 mL 1,5 mL
Se mezcló e incubó por 15 min a 37 oC.
La longitud de onda varía de acuerdo con el derivado fenólico utilizado (RT3 620 nm; RT4 600 nm; RT5 580 nm).
Estudio de la linealidad y selección del tiempo óptimo de lectura
Se utilizó la curva de calibración en un rango de concentraciones de urea desde 4,9950 hasta 24,9750 mmol/L, evaluando distintos tiempos de reacción, y se calculó el coeficiente de correlación.
Imprecisión
Se evaluaron cada uno de los métodos descritos en 80 muestras de suero control lote 7010. Se estudió en todos los casos la imprecisión, calculando el coeficiente de variación entre los valores obtenidos en el día para conocer la repetibilidad y entre las corridas para determinar la reproducibilidad.
Inexactitud
Se determinó el coeficiente de correlación entre cada uno de los métodos ensayados mediante el análisis de 15 muestras durante 5 d. Los valores obtenidos fueron comparados con los de DAM, método que se utilizó como referencia para llevar a cabo este estudio.
RESULTADOS
En la tabla 1 se muestran los resultados de los coeficientes de correlación (r) con los distintos métodos y tiempos de lecturas.| | | | | | | | |
| | | | | | | | |
| | | | | | | | |
| | | | | | | | |
| | | | | |
| Métodos | | | ||||
| | | | | | ||
| DAM | | | | | | |
| Fenol-hipoclorito | | | | | | |
| Timol | | | | | | |
| Salicilato de sodio | | | | | | |
DISCUSIÓN
Como se mostró en la tabla 1, los valores del coeficiente de correlación de los métodos estudiados fueron muy cercanos a 1, por lo que en el rango de concentraciones estudiado el comportamiento fue adecuado, señalando que para el salicilato de sodio se presentó una buena estabilidad en el tiempo.El comportamiento de los 3 métodos estudiados nos permite utilizarlos indistintamente en la determinación de urea en suero.
De estos datos se pudo concluir que la coloración era estable hasta 1 h, y se definió que el tiempo óptimo para cada ensayo se obtenía en:
- Método de la DAM: 10 min.
- Método fenol-hipoclorito: 5 min.
- Método con timol: 10 min.
- Método del salicilato de sodio: 20 min.
En los sistemas estudiados se pudo apreciar que los valores del coeficiente de correlación obtenidos para los 3 métodos y tomando como referencia el de la DAM, eran buenos ya que estaban muy cercanos a 1, lo que nos indicó que los 3 métodos eran adecuados para la determinación de urea en suero.
En todos los casos estudiados la manipulación es sencilla, aspecto fundamental para el trabajo de rutina del laboratorio clínico, siendo el más práctico entre ellos el del salicilato de sodio.
Se recomienda evaluar el método menos complejo para su elaboración industrial.
SUMMARY
Three different methods for the determination of serum urea were assayed, based on the Berthelot reaction using phenol, thymol, and sodium salicylate, and were compared with the method of diacetyl monoxima with the aim of selecting the best and more adequate. Lack of precision, non-accuracy, and lineality of each of them were also evaluated. In all assays performed a lineality from 4.9950 to 24.9750 mmol/L of urea was obtained; when assessing imprecision the values of variation coeficient were found to be lower than 7 and when studying lack of accuracy values of the variation coeficient higher than 0.98 were observed in all cases.Subject headings: COLORIMETRY/methods; REAGENT KITS, DIAGNOSTIC; UREA/blood; CHEMISTRY, CLINICAL; PHENOLS; THYMOL; SODIUM SALICYLATE; SODIUM HYPOCHLORITE; CALIBRATION; REFERENCE STANDARDS.
REFERENCIAS BIBLIOGRÁFICAS
- Coulombe JJ, Fravreau L. A new simple semi micro method for colorimetric determination of urea. Clin Chem 1963;9(1):102-5.
- Cam G, Barrier JL, Lawny F. Selection of phenolic derivates capables of forming a stable mixture with urease in an aqueous solution and its use in an urea determination. Francia patent 2544, 742; 1984 Oct 26.
- Hanadas T, Yamanishi K. Colorimetric determination of Ammonio. Japan patent (61, 138, 162) (CI. GO1 N33/50). 1986 Jun 25.
- Tabacco A, Meiattini F, Moda E, Tarli P. Simplified enzymic colorimetric serum urea nitrogen determination. Clin Chem 1979;25: 336-7.
- Patton CJ, Crouch SR. Spectrophotometric and kinetics investigation of the Berthelot reaction for determination of Ammonio. Anal Chem 1977;49:464-9.
Li. Lilliam Valdés Diez. Empresa de Productos Biológicos "Carlos J. Finlay". Infanta No. 1162, municipio Centro Habana, La Habana, Cuba.














