Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Farmacia
versión On-line ISSN 1561-2988
Rev Cubana Farm v.32 n.2 Ciudad de la Habana Mayo-ago. 1998
Universidad de La Habana. Facultad de Farmacia y Alimentos
Hidrólisis enzimática de carboximetilquitina y carboximetilquitosana
Sol A. Fernández Monagas1RESUMEN
Se estudió la actividad de la lisozima sobre la carboximetilquitina y la carboximetilquitosana mediante el empleo de la viscosimetría y se encontró que ambas son hidrolizadas en condiciones fisiológicas.Descriptores DeCS: QUITINA/analogos & derivados; HIDROLISIS; MURAMIDASA/fisiología.
Los derivados de la quitina solubles en agua resultan de gran interés por sus diversas aplicaciones biomédicas y farmacéuticas. Entre estos derivados se encuentran la carboximetilquitina y la carboximetilquitosana.1-5
Con estas sustancias hemos encontrado buenos resultados en el tratamiento de lesiones erosivas de la mucosa bucal y de algunas afecciones dermatológicas.
Algunos autores han estudiado la hidrólisis enzimática de derivados solubles de quitinas que presentan características quimicofísicas diferentes a las encontradas para la quitina empleada como material de partida en este trabajo (Nordtveit RJ, Varum KM, Smidrod O. Degradación of O-carboxymetyl chitin with lysosyme. Fukamizo T. Interaction of partially acetylated chitotri saccharides with hen egg white lysozyme. Kurita K, Ishii S, Nishimura S, Yoshino H, Hashimoto S. Lysozyme susceptibility and some other characteristic properties of 2-mercapto and 6-mercapto chitins. Extended Summaries of International Symposium on Chitin Enzymology, Senigallia, 1993).
Para demostrar que los 2 derivados carboximetilados de quitina, obtenidos en nuestros laboratorios, son hidrolizados por la lisozima presente en los tejidos y fluidos biológicos, hemos seguido la actividad de dicha enzima mediante el empleo de la viscosimetría, que resulta particularmente versátil y rápida para el análisis de soluciones de macromoléculas.6
MÉTODOS
La carboximetilquitina y la carboximetilquitosana fueron obtenidas por reacción de quitina alcalina con ácido monocloroacético en diferentes condiciones de temperatura y tiempo de reacción.Ambos compuestos fueron identificados mediante espectroscopia IR, con un espectrofotómetro Nicolet 205 FT-IR.
Para la hidrólisis enzimática fue empleada lisozima de albúmina de huevo (Calbiochem). Una alícuota de solución al 5 % w/w de la muestra fue introducida en la copa del viscosímetro, a la cual se le añadió 1 mL de solución de lisozima 5 mg/mL. El equipo utilizado fue Haake Rotovisco RV-20 controlado mediante computadora con programa Rotation Haake. La temperatura fue de 37 ± 0,01 oC. La hidrólisis de la carboximetilquitina se realizó a pH 5,5 y 7 y la correspondiente a la carboximetilquitosana a pH 7. Para determinar el orden de la reacción y la velocidad específica, se utilizó el método de las propiedades físicas o método de las lambdas, para lo cual se tomó como propiedad física la viscosidad de la solución y se construyó el gráfico de log (viscosidad en el tiempo t-viscosidad final) vs. tiempo.7
RESULTADOS
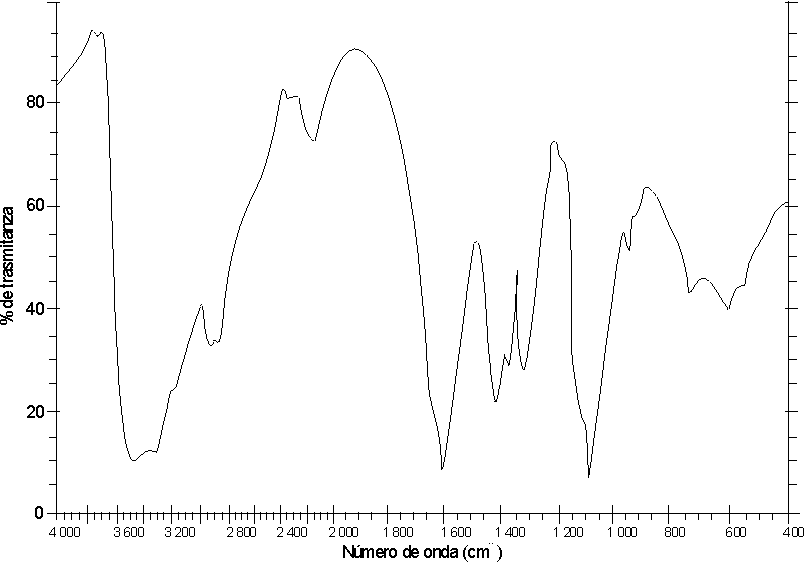
Las figuras 1 y 2 muestran los espectros IR de los 2 derivados obtenidos. Nótese las bandas a 1 600 y 1 400 cm-1, correspondientes al grupo -COO-. En el espectro de la figura 1 aparecen las bandas características para las amidas secundarias a 1 555 cm-1 (banda II, correspondiente al doblaje N-H) y 1 655 cm-1, correspondiente al grupo carbonilo, mientras que en el espectro IR (figura 2) se observa la ausencia de la banda II de amida secundaria y la disminución de la intensidad de la banda a 1 555 cm-1.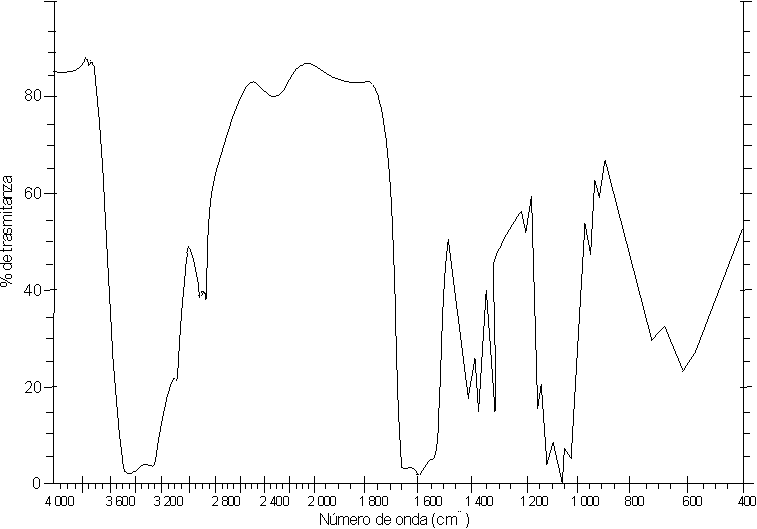
En las figuras 3 y 4 se presentan el comportamiento de la viscosidad en el tiempo para las soluciones tratadas con lisozima.
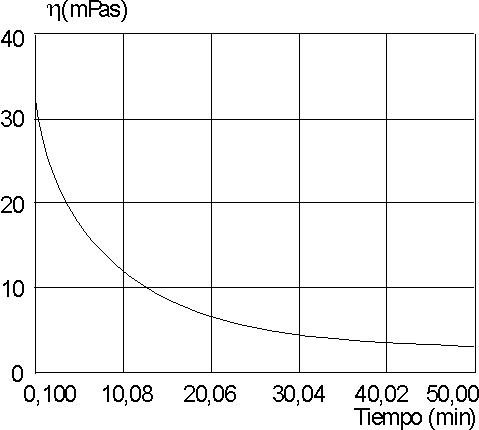
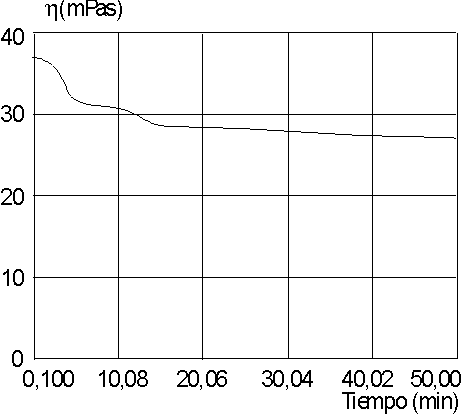
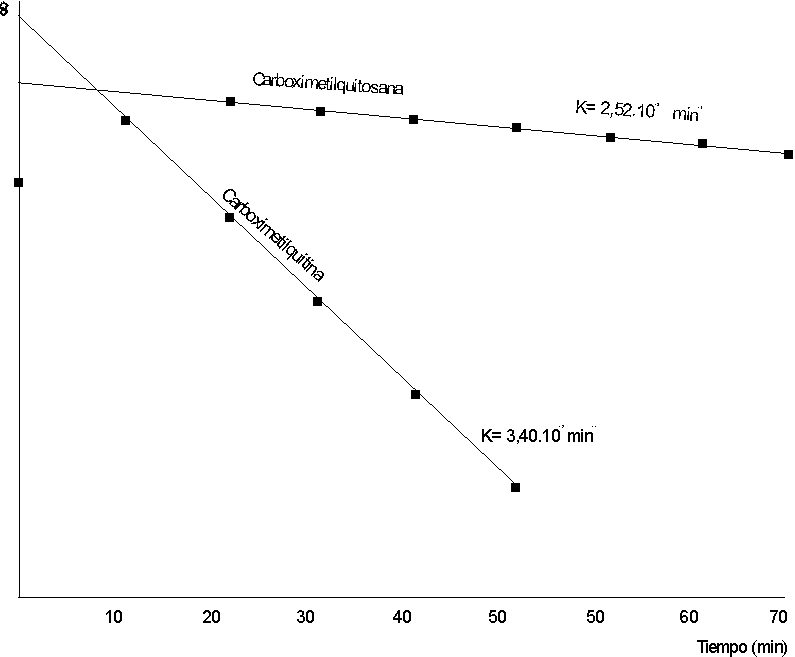
Al utilizar el método de las lambdas, se pudo comprobar que la degradación enzimática responde a una cinética de primer orden (figura 5), con valores de velocidad específica aparente, a pH 7, de 0,034 1/min para la carboximetilquitina y de 0,0025 1/min para la carboxime-tilquitosana.
DISCUSIÓN
Al analizar los espectros IR obtenidos, podemos decir que éstos corresponden a una carboximetilquitina (figura 1) y a una carboximetilquitosana (figura 2).La disminución de la viscosidad en las soluciones tratadas con lisozima muestra que ambos compuestos son degradados por la enzima a 37 oC y pH 7, con una degradación mucho más rápida para la carboximetilquitina.
La variación del pH no afecta de modo significativo la velocidad de degradación de la carboximetilquitosana (k = 0,027 1/min).
En conclusión, la lisozima hidroliza a la carboximetilquitina y la carboximetilquitosana en condiciones similares a las fisiológicas.
La carboximetilquitosana es degradada mucho más lentamente que la carboximetilquitina, lo cual puede explicar la mayor efectividad terapéutica de la primera en el tratamiento de algunas lesiones y afecciones dermatológicas.
SUMMARY
The activity of lysozime an carboxymethylchitin and carboxymethyl-chitosan was studied by viscosimetry. It was found that both are hydrolized under physiological conditions.Subject headings: CHITIN/analogs & derivatives; HIDROLYSIS; MURAMIDASA/physiology.
REFERENCIAS BIBLIOGRÁFICAS
- Nishimura S, Nishi N, Tokura S. Bioactive chitin derivatives. Activation of mouse-peritoneal macrophages by O-(carboxymethyl) chitins. Carbohydr Res 1986;146:251-8.
- Muzzarrelli RAA, Tanfani F, Muzzarelli MG. La quitina e isuoi derivati: ricenti ricerche applicate. Chim Industr 1982;64(1):18-25.
- Gross P, Konrad E, Mager H. Investigations on chitosan as a natural film forming ingredient in hair cosmetic products under the consideration of ecological aspects. Sonderdr Parfum Kosmet 1983;64:367-71.
- Hirano S, Moriyasu T. N-(carboxyacyl) chitosans. Carbohydr Res 1981;92:323-7.
- Muzzarelli RAA, Ilari P, Petrarulo M. Solubility and structure of N-carboxymethyl chitosan. Int J Biol Macromol 1990;16(4):177-80.
- Sashiwa H, Uraki Y, Saimoto H, Shigemasa Y, Tokura S. Lysozyme susceptibility and substitution site by chemical modification. Int J Biol Macromol 1990;12:295-6.
- Frost AA, Pearson RG. Kinetics and mechanism. La Habana: Instituto del Libro, 1968:28-35.
Lic. Sol A. Fernández Monagas. Universidad de La Habana. Facultad de Farmacia y Alimentos. San Lázaro y L, El Vedado, municipio Plaza de La Revolución, Ciudad de La Habana, Cuba.














