My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Farmacia
On-line version ISSN 1561-2988
Rev Cubana Farm vol.37 no.3 Ciudad de la Habana Sept.-Dec. 2003
Centro de Estudios de Biotecnología Industrial
Facultad de Ciencias Naturales, Universidad de Oriente
Restauración de la inmunocompetencia en ratones malnutridos
con la administración de un hidrolizado de microalgas
Humberto Joaquín Morris Quevedo,1 Leonardo Borges Quintana,2 Clara Esther Martínez Manrique3 y Olimpia Carrillo Farnés4
Resumen
Se evaluó el efecto de la administración intraperitoneal de un hidrolizado proteico de la microalga Chlorella vulgaris en una dosis de 500 mg/kg de peso durante 6 días, como complemento de la dieta convencional en la recuperación de la inmunocompetencia de ratones Balb/c con malnutrición proteico-energética inducida experimentalmente por restricción dietética. La intervención con el hidrolizado implicó la restauración del conteo de leucocitos totales a valores similares a los del grupo control; a un incremento en los niveles de linfocitos en sangre periférica; estimuló la proliferación de las células del sistema fagocítico mononuclear y el metabolismo de los macrófagos, expresado por una mayor actividad de la enzima fosfatasa ácida lisosomal y al aumento del peso relativo y actividad hematopoyética del bazo. Estas acciones moduladoras permiten considerar al producto como un preparado inmunológicamente activo capaz de inducir un estado incrementado de resistencia no específica en el organismo.
DeCS: DESNUTRICION PROTEICO-ENERGETICA; INMUNOCOMPETENCIA; ALGAS; CHLORELLA; ANIMALES DE LABORATORIO; RATONES CONSANGUINEOS BALB C.
Dentro de los programas de utilización de las microalgas en la nutrición, las especies dulceacuícolas han recibido una atención especial, en particular las incluidas en el género Chlorella, como fuente de proteínas, vitaminas, minerales y sustancias con efectos bioestimulantes.1
Los efectos promotores de la salud humana atribuidos a las microalgas han sido relacionados con la activación de los mecanismos de protección inmunitaria del organismo por sustancias naturales de elevado potencial terapéutico.2
La relación entre el estado nutricional y el sistema inmune ha cobrado una importancia relevante en los últimos años, teniendo en cuenta que una amplia variedad de nutrientes esenciales para garantizar una adecuada salud, tienen un impacto sobre la inmunocompetencia del huésped.3
En el tratamiento de la malnutrición proteica energética (MPE) se dedica una atención especial a la terapia nutricional y las modificaciones del patrón normal de alimentación resultan esenciales. En este sentido, se ha experimentado un considerable avance en los últimos años en la comprensión de las propiedades inmunoestimulantes detectadas en diferentes péptidos, lo cual ha revolucionado este campo de investigación,4,5
La evaluación de las propiedades inmunoestimulantes de péptidos aislados e hidrolizados proteicos constituye una línea donde hay mucha información por obtener y se vislumbran amplias posibilidades a productos de fuentes no exploradas aún, como las microalgas.
Al respecto, Morris y otros6 demostraron que la administración intraperitoneal de un hidrolizado proteico de Chlorella vulgaris (Chlorophyta, Chlorophyceae) en una dosis de 500 mg/kg de peso a ratones de la línea Balb/c como intervención complementaria durante la recuperación de la MPE conllevó al restablecimiento de la homeostasis del organismo y a la estimulación del funcionamiento hepático y de la mucosa yeyunal. La composición bioquímica de este hidrolizado se caracteriza por el 5,7 % de aminoácidos libres y 3 fracciones peptídicas mayoritarias con pesos moleculares comprendidos entre 1 000-5 000 Dalton y por otra parte, el patrón aminoacídico evidencia la presencia de los 8 aminoácidos esenciales desde el punto de vista nutricional.7
Tomando en consideración estos antecedentes, en el presente trabajo se investigan los efectos inmunoestimulantes del hidrolizado proteico de Chlorella vulgaris en un biomodelo experimental de MPE con el objetivo de evaluar sus aplicaciones potenciales en la nutrición farmacológica.
Métodos
Obtención del hidrolizado proteico. La hidrólisis enzimática de una suspensión al 10 % de la biomasa proteica de Chlorella vulgaris se realizó con un preparado comercial de pancreatina (MERCK), para lo cual se emplearon 20 unidades proteolíticas/g de biomasa a pH 7,5 y una temperatura de 37 °C durante 4 h en condiciones de agitación continua.7
Animales y dietas. Se emplearon 20 ratones Balb/c hembras, de 9 semanas de edad y 18-20 g de peso corporal, procedentes del Laboratorio de Anticuerpos y Biomodelos Experimentales (LABEXÒ) de Santiago de Cuba. A los animales se les garantizaron condiciones ambientales estables y un suministro de agua ad libitum. Se cumplieron las disposiciones nacionales acerca del cuidado y el uso de animales de laboratorio. A 15 de los animales se les impuso un régimen de restricción dietética hasta la pérdida de aproximadamente el 25 % del peso corporal inicial, para favorecer el desarrollo de la MPE. Esta condición se alcanzó al cabo de los 3 días de depleción alimentaria, procediendo al sacrificio de 5 animales (grupo M) y los restantes fueron distribuidos al azar en los grupos experimentales M-DC y M-HP que fueron alimentados ad libitum con pienso comercial para ratones durante un período de repleción de 6 días. A los animales de la variante M-HP se les administró, adicionalmente, 0,2 mL del hidrolizado proteico por la vía intraperitoneal, equivalente a una dosis de 500 mg/kg de peso. El grupo control (C) fue alimentado con la dieta convencional durante todo el período de experimentación.
Conteo total y diferencial de leucocitos. Las extracciones de sangre se realizaron en cada animal al día siguiente de concluir el período experimental mediante sangramientos por el plexo retroorbital con el empleo de capilares heparinizados. El conteo total y diferencial de leucocitos se realizó según Davidsohn y Nelson.8
Conteo de células del exudado peritoneal y determinación de la actividad fosfatasa ácida lisosomal de macrófagos. Las células del exudado peritoneal se colectaron por lavado de la cavidad con buffer fosfato salino pH 7,4 suplementado con seroalbúmina bovina 1 mg/mL. Se estimó el número total de células mediante conteo directo en cámara de Neubauer.
La determinación de la actividad fosfatasa ácida de macrófagos se realizó por el método descrito por Kiho y otros9 partiendo de suspensiones celulares con 1x105 células adherentes. Se utilizó como sustrato el p-nitrofenilfosfato y la actividad enzimática se expresó como nanomoles de p-nitrofenol liberados por 1x105 macrófagos en 60 min.
Peso relativo y determinación del número de colonias macroscópicas endógenas de tejido hematopoyético en bazo. El peso relativo del bazo en función del peso total del animal se determinó en una balanza analítica (Electronic balance ER-182 A). Para el conteo de las colonias macroscópicas endógenas de tejido hematopoyético en la superficie parietal del bazo se empleó la metodología propuesta por Till y Mc Culloch.10
Análisis estadístico. Los datos fueron procesados mediante un análisis de varianza de clasificación simple (diseño completamente aleatorizado) acoplado a la prueba de rangos múltiples de Duncan para establecer entre cuáles de las medias de las variables analizadas existían diferencias significativas.
Resultados
En el estudio de los parámetros hematológicos (tabla) se observó como resultado de la restricción dietética una profunda leucopenia, reflejada en valores de 3,51 ± 0,55x109 células/L. Si bien la dieta convencional produjo una recuperación ligera en el conteo de leucocitos totales con tendencia a las cifras del grupo control, en los animales suplementados con el hidrolizado se logró la restauración total de este indicador (8,98 ± 0,76x109 células/L) . En el conteo diferencial de leucocitos no se observaron diferencias estadísticamente significativas en la concentración de polimorfonucleares entre los distintos tratamientos; sin embargo, la administración intraperitoneal del hidrolizado microalgal estuvo acompañada de una mayor proliferación de linfocitos (5,44 ± 0,67x109 células/L, p<0,001) y niveles incrementados de monocitos circulantes (0,91 ± 0,29x109 células/L, p<0,01) en la sangre periférica.
TABLA. Conteo total y diferencial de leucocitos en los diferentes tratamientos al término del período experimental
| Leucocitos totales (109/L)** | Control (5) | M (5) | M-DC (5) | M-HP (5) |
| 7,34 ± 0,28a | 3,51 ± 0,55c | 6,36 ± 0,18b | 8,98 ± 0,76a | |
| Polimorfonucleares (109/L)ns | 4,81 ± 1,58 | 2,62 ± 0,39 | 2,87 ± 0,37 | 2,72 ± 0,50 |
| Linfocitos (109/L)*** | 2,32 ± 1,46b | 0,65 ± 0,34c | 3,29 ± 1,02b | 5,44 ± 0,67a |
| Monocitos (109/L)** | 0,28 ± 0,09b | 0,20 ± 0,07b | 0,24 ± 0,15b | 0,91 ± 0,29a |
Letras distintas indican diferencias significativas en la prueba de rangos múltiples de Duncan;
(ns) diferencias no significativas; (**) diferencias significativas; p<0,01, (***) diferencias significativas p<0,001; ( ) número de animales en cada tratamiento.
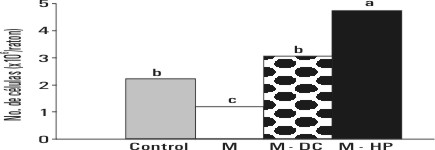
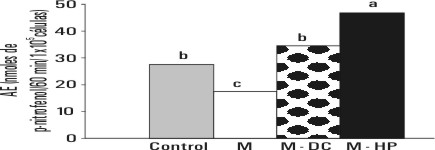
En estrecha asociación con el aumento observado en los niveles de monocitos en sangre en los animales tratados con el hidrolizado proteico, se presentó una elevación en el número de macrófagos residentes en la cavidad peritoneal en comparación con los restantes grupos experimentales (p<0,01) (fig. 1). Desde el punto de vista metabólico, el estado funcional de estas células se caracterizó por una mayor actividad de la enzima fosfatasa ácida lisosomal (p<0,001) (fig. 2). El conteo celular y la actividad metabólica de los macrófagos peritoneales resultaron particularmente afectados en los animales sometidos al régimen de restricción dietética, y en el caso de los alimentados con la dieta convencional, luego de la depleción nutricional, se recuperaron los valores del grupo control.
FIG. 1. Conteo de macrófagos presentes en el exudado peritoneal en los diferentes tratamientos experimentales. Letras distintas indican diferencias significativas en la prueba de rangos múltiples de Duncan para p<0,01.
FIG. 2. Actividad fosfatasa ácida lisosomal en los diferentes tratamientos experimentales.
Letras distintas indican diferencias significativas en la prueba de rangos múltiples de Duncan para p<0,001.
El análisis de las características anatómicas del bazo evidenció notables diferencias entre el grupo malnutrido y las restantes variantes. En los animales tratados con el hidrolizado proteico de Chlorella vulgaris se apreció un incremento en el volumen e intensidad de la coloración del órgano con respecto al grupo control.
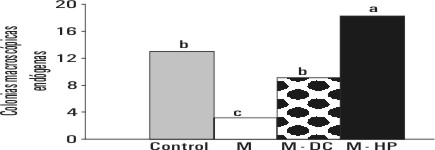
El análisis del peso relativo del bazo (fig. 3) y el número de colonias macroscópicas endógenas de tejido hematopoyético en su superficie parietal (fig. 4) reveló profundas alteraciones en estos parámetros en los animales malnutridos. Al término de la repleción con dieta convencional los animales presentaron valores muy similares a los del grupo control, y se observó una estimulación adicional en el grupo suplementado con el hidrolizado proteico (p<0,001).
FIG. 3. Peso relativo del bazo en las distintas variantes experimentales. Letras distintas indican diferencias significativas en la prueba de rangos múltiples de Duncan para p<0,001.
FIG. 4. Número de colonias macroscópicas endógenas de tejido hematopoyético en la superficie parietal del bazo en las distintas variantes experimentales. Letras distintas indican diferencias significativas en la prueba de rangos múltiples de Duncan para p<0,001.
Discusión
En el análisis de los efectos de las deficiencias nutricionales sobre la respuesta inmune debe tenerse en cuenta la heterogeneidad y complejidad de las células inmunocompetentes, sus subpoblaciones, sus activadores como las citoquinas e interferones, sus sistemas inductores-reguladores y la necesaria interacción entre todos sus componentes para que la respuesta sea fisiológicamente normal.11
Aun en la MPE moderada y marginal se produce una reducción en el número absoluto de linfocitos en el sistema inmune periférico, lo que desempeña una función importante en la disminución de la capacidad de defensa del huésped. Por esta razón, el conteo total de linfocitos ha sido propuesto como un indicador funcional del estado nutricional.12 Nuestros resultados evidencian que en el modelo experimental utilizado, el curso de la MPE estuvo acompañado de una profunda linfopenia y por otra parte, la administración del hidrolizado proteico condujo a una mayor proliferación de esta población celular.
El incremento en el número de monocitos en sangre en los animales tratados con el hidrolizado proteico puede asociarse con su función moduladora, más general, sobre el sistema fagocítico mononuclear, al ser los monocitos las células precursoras de los macrófagos. La administración del hidrolizado proteico estimuló no solo la diferenciación de los monocitos en macrófagos, reflejado en el incremento en el número de estas células residentes en el peritoneo, sino también su estado metabólico expresado por una mayor actividad de la enzima fosfatasa ácida lisosomal. Se conoce que los macrófagos presentan receptores de membrana para el fragmento C3b de la vía alternativa del sistema del complemento y que la enzima fosfatasa ácida es estimulada por dicho fragmento,9 por lo que los resultados obtenidos en el grupo suplementado sugieren que el hidrolizado proteico o alguno de sus componentes individuales pudiera actuar como inductor de la vía alternativa de activación del complemento.
Ha sido demostrado que todos los órganos linfoides disminuyen de tamaño durante la MPE y en el caso del bazo, su volumen y coloración varían de acuerdo con la cantidad de sangre que retiene en su interior y la actividad hematopoyética que realiza.13 El incremento significativo de la actividad hematopoyética del bazo que tiene lugar como resultado del tratamiento con el hidrolizado proteico de Chlorella vulgaris, puede estar relacionado con la proliferación de células de la línea linfoide, fundamentalmente.
Al respecto, con la administración por vía intraperitoneal de diferentes dosis de un extracto acuoso de Chlorella kessleri (Ivastimul) a ratones y ratas irradiados, se refiere un aumento en el número de colonias macroscópicas endógenas de tejido hematopoyético en la superficie parietal del bazo. El extracto estimuló también a los macrófagos y la producción a partir de estas células de factores estimulantes de colonias de granulocitos-macrófagos.14
El efecto obtenido en la evaluación del hidrolizado proteico de Chlorella vulgaris en relación con el peso relativo y función hematopoyética del bazo, conjuntamente con los resultados de la activación metabólica de los macrófagos, permiten establecer una analogía con el mecanismo de acción a este nivel del Ivastimul y sustentar, desde el punto de vista celular, el empleo de suplementos de hidrolizados proteicos como una vía efectiva para modular la hemopoyesis.
Las células inmunocompetentes se caracterizan por presentar un metabolismo muy activo y experimentar expansiones proliferativas con la producción de compuestos solubles, como las citoquinas que modulan diferentes procesos en el huésped. Parte de las alteraciones en la función inmunitaria que acompañan a la MPE pueden atribuirse a la limitada disponibilidad de los aminoácidos necesarios para la síntesis de las proteínas celulares del sistema inmunitario y para el soporte de la respuesta proteica de fase aguda del hígado.15
El hidrolizado proteico de Chlorella vulgaris constituye un suplemento de aminoácidos libres y péptidos de diferentes pesos moleculares, capaz de influir en virtud de su composición bioquímica en los factores que según Reeds y Beckett16 inciden en la capacidad individual de defensa: 1) el mantenimiento de todos los elementos de la protección inmunitaria y 2) el mantenimiento de la barrera para evitar la invasión de microorganismos patógenos.
Nuestros resultados indican que la administración del hidrolizado microalgal contribuyó a la restauración de la inmunocompetencia en los animales tratados, fenómeno que puede estar asociado en gran medida con la estimulación de los mecanismos de resistencia no específica del organismo. Estas acciones moduladoras permiten considerar al producto como un biopreparado inmunológicamente activo.
Summary
The effect of the intraperitoneal administration of a protein hydrolysate of Chlorella vulgaris microalga at a dose of 500 mg/kg of weight during 6 days, as a supplement of the conventional diet in the recovery of the immunocompetence of Balb/c mice with protein-energy malnutrition experimentally induced by diet restriction, was evaluated. The intervention with the hydrolysate led to the restoration of the count of total leukocytes at values similar to those of the control group and to an increase in the levels of lymphocytes in peripheral blood. It also stimulated the proliferation of the cells from the mononuclear phagocytic system and the metabolism of the macrophages, expressed by a higher activity of the lysosomal acid phsosphatase and the rise of the relative weight and the hematopoietic activity of the spleen. These modullating actions allow to consider the product as an immunological active compound capable of inducing an increased state of nonspecific resistance in the organism.
Subject headings: PROTEIN-ENERGY MALNUTRTION; INMUNOCOMPETENCES; ALGAE; CHLORELLA; ANIMALS, LABORATORY; MICE, INBRED BALB C.
Referencias Bibliográficas
- Herrero C, Cabezas B, Abalde J, Fábrega J. Avances en tecnología de microalgas para nutrición animal. Santiago de Compostela: Universidad de Santiago de Compostela; 1985. p.100.
- Pulz O, Koehler E. Microalgae as a source of pharmacologically valuable polysaccharide. 6th European Congress on Biotechnology. Firenze, Italy, June 13-17, 1993.
- Chandra RK. Nutrition and the immune system: an introduction. Am J Clin Nutr 1997; 66(2):4605-35.
- Morinaga Milk Industry Co. Ltd. Immunostimulatory agent. US Patent 5,466,669. 1995.
- Lahov E, Regelson W. Antibacterial and immunostimulating casein-derived substances from milk: casecidin, isracidin peptides. Food Chem Toxicol 1996;34(1):131-45.
- Morris HJ, Borges L, Martínez CE, Carrillo O. Aspectos bioquímicos de la intervención con un hidrolizado enzimático de Chlorella vulgaris durante la recuperación de la malnutrición proteico-energética en ratones Balb/c. Rev Cubana Aliment Nutr 2002;16(1):5-12.
- Morris HJ, Borges L, Martínez CE, Almarales A, Abdala RT. Composición bioquímica y propiedades bioestimulantes de un hidrolizado proteico de la microalga Chlorella vulgaris (Chlorophyta, Chlorophyceae). Rev Cubana Química 2001;13(1).
- Davidsohn I, Nelson DA. Sangre. En: Davidsohn I, Henry JB, eds. Diagnóstico clínico por el laboratorio. La Habana: Editorial Científico-Técnica; 1985:103-317.
- Kiho T, Shiose Y, Nagai K, Ukai S. Polysaccharides in Fungi .XXX. Antitumor and immunomodulating activities of two polysaccharides from the fruiting bodies of Armillariella tabescens. Chem Pharm Bull 1992;40(8):2110-4.
- Till JE, Mc Culloch EA. A direct measurement of the radiation sensitivity of normal mouse bone marrow. Radiat Res 1961;14:213-22.
- Sánchez VM. Inmunocompetencia en la malnutrición proteico-energética. Rev Cubana Aliment Nutr 1999;13(2):129-36.
- Chandra RK. Nutrition and immunoregulation. Significance for host resistance to tumors and infectious diseases in humans and rodents. J Nutr 1992;122:754-7.
- Christian L, Alejo N. Indicadores inmunológicos en la evaluación del estdo nutricional. Rev Cubana Aliment Nutr 1993;7(1):48-51.
- Vacek A, Rotkovská D. Radioprotection of hemopoiesis conferred by aqueous extract from Chlorococcal algae (Ivastimul) administered to mice before irradiation. Exp Hematol 1990; 18:234-7.
- Morlese JF, Forrester T, Jahoor F. Acute-phase protein response to infection in severe malnutrition. Am J Physiol 1998;275(1):112-7.
- Reeds PJ, Beckett PR. Proteínas y aminoácidos. En: Ziegler EE, Filer LJ Jr, eds. Conocimientos actuales sobre nutrición. 7 ed. Organización Panamericana de la Salud; 1997:73-94. (Publicación Científica No. 565).
Recibido: 22 de abril de 2003. Aprobado: 28 de mayo de 2003.
MSc. Humberto Joaquín Morris Quevedo. Agramonte No. 58, entre Veteranos y Correoso, El Cristo, Santiago de Cuba, CP 94 310. E-mail: hmorris@cebi.uo.edu.cu
1Master en Bioquímica de la Nutrición. Investigador Agregado. Centro de Estudios de Biotecnología Industrial, Universidad de Oriente.
2Licenciado en Biología. División de Biotecnología Solar, Centro de Investigaciones de Energía Solar.
3Master en Biotecnología Ambiental. Profesora Auxiliar. Centro de Estudios de Biotecnología Industrial, Universidad de Oriente.
4Doctora en Ciencias Biológicas. Profesora Titular de Bioquímica de la Nutrición. Facultad de Biología. Universidad de La Habana.