My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Farmacia
Print version ISSN 0034-7515
Rev Cubana Farm vol.45 no.3 Ciudad de la Habana July-Sept. 2011
PRODUCTO NATURAL
Caracterización química por cromatografía de gases/espectrometría de masas de dos extractos obtenidos de Phyllanthus orbicularis HBK
Chemical characterization using gas chromatography/mass spectrometry of two extracts from Phyllanthus orbicularis HBK
Yamilet Irene Gutiérrez GaiténI, Migdalia Miranda MartínezII, Adonis Bello AlarcónIII, Saely Verona HernándezIV, Rodny Montes de Oca PortoV
I Máster en Tecnología y Control de Medicamentos. Investigadora Auxiliar. Instituto de Farmacia y Alimentos. Universidad de La Habana. La Habana, Cuba.
II Doctora en Ciencias Químicas. Profesora Titular. Instituto de Farmacia y Alimentos. Universidad de La Habana. La Habana, Cuba.
III Doctor en Química Farmacéutica. Profesor Auxiliar. Instituto de Farmacia y Alimentos. Universidad de La Habana. La Habana, Cuba.
IV Máster en Química Farmacéutica. Laboratorios LIORAD. La Habana, Cuba.
V Máster en Química Farmacéutica. Laboratorios Antidoping. Instituto de Medicina Deportiva. La Habana, Cuba.
RESUMEN
El objetivo del presente trabajo consistió en la caracterización química por cromatografía de gases/espectrometría de masas de 2 extractos obtenidos de Phyllanthus orbicularis HBK, para lo cual se llevó a cabo un método de extracción por maceración con n-hexano y acetato de etilo, a fin de obtener los extractos correspondientes. El estudio del extracto hexánico permitió identificar 17 componentes y resultaron predominantes estructuras del tipo hidrocarbonada, entre ellas, el ciclooctacosano como componente mayoritario. En el extracto de acetato de etilo se identificaron 19 compuestos y constituyeron los terpenoides las estructuras mayoritarias, aunque el más abundante resultó ser el esterol ã-sitosterol. Los compuestos identificados se informan por primera vez para la especie.
Palabras clave: Phyllanthus orbicularis HBK, cromatografía de gases/espectrometría de masas, hidrocarburos, terpenoides.
ABSTRACT
The objective of this paper was the chemical characterization of two extracts from Phyllanthus orbicularis HBK through gas chromatography/mass spectrometry. To this end, maceration with N-hexane and ethyl acetate was used to obtain the respective extracts. The study of the hexane extract identified 17 components in which hydrocarbonate structures prevailed, mainly cyclooctacosane. In the ethyl acetate extract, 19 compounds were detected, being the terpenoids the predominant, although the most abundant was sterol ã-sitosterol. For the first time, the identified compounds are reported for this species.
Key words: Phyllanthus orbicularis HBK, gas chromatography/ mass spectrometry, hydrocarbons, terpenoids.
INTRODUCCIÓN
La extracción, aislamiento e identificación de constituyentes de las drogas vegetales ha fundamentado en gran medida el uso de estas, por lo que ha existido un aumento considerable en las investigaciones de todos los campos relacionados con la medicina natural, encaminadas a la búsqueda de nuevos agentes terapéuticos de menos toxicidad y efectos secundarios. La flora cubana tiene una diversidad tal que justifica el interés de su estudio sistemático, sobre todo de aquellas especies endémicas que han sido poco estudiadas fitoquímicamente y que presentan grandes perspectivas desde el punto de vista terapéutico. Tal es el caso de Phyllanthus orbicularis HBK, conocida con el nombre trivial de "alegría",1 que ha demostrado tener actividad antiviral contra los virus de la hepatitis B, el herpes simple tipo 1 y 2, el herpes bovino,2-4 así como cualidades antimutagénicas, antioxidantes,5,6 entre otras. Desde el punto de vista fitoquímico los reportes son escasos; se destacan los trabajos que refieren la acumulación de níquel a nivel de tejidos de hojas y tallos de la planta7 y otro que revela la presencia de quercetina, rutina kaempferol-3-o-rutinósido, procianidina, catequina, epicatequina, ácido protocatéquico y derivados de ácido gálico en el extracto acuoso.8 Considerando dichos antecedentes el trabajo tiene como objetivo la caracterización química por cromatografía de gases/espectrometría de masas (CG/EM) de dos extractos obtenidos de Phyllanthus orbicularis HBK.
MÉTODOS
La especie vegetal utilizada fue Phyllanthus orbicularis HBK, recolectada en enero de 2008 en la zona de Cajálbana, provincia de Pinar del Río, que correspondió a plantas adultas de aproximadamente 1,73 m de altura. Esta fue depositada y registrada en el Herbario del Jardín Botánico Nacional de Cuba (HFC 85589-HAJB).
Las hojas y ramas finas una vez trituradas y secadas (500 g) fueron sometidas a un proceso de extracción por maceración (por 7 días) con n-hexano (1 500 mL × 3) y acetato de etilo (1 500 mL × 3) para obtener los extractos correspondientes.
Los extractos se analizaron por CG acoplada a EM utilizando un cromatógrafo de gases Hewlett-Packard 6890 acoplado a un espectrómetro de masas 5973. Las muestras se redisolvieron en el mismo disolvente utilizado para la extracción y se inyectaron directamente en el equipo (1 µL, modo "split"). La separación se realizó en una columna SPB-5 (5 m × 0,25 mm × 0,10 µm), utilizando Helio como gas portador a un flujo de 1mL/min, siendo la temperatura del inyector de 280 ºC. La temperatura inicial del horno fue de 60 ºC por 2 min con programación de 4 ºC por min hasta 100 ºC, incrementando a 10 ºC por min hasta 290 ºC, la cual se mantuvo por 5min. El espectrómetro de masas fue operado a 70 eV con un rango de masas desde 45-700 uma, siendo la temperatura de la fuente de 230 ºC. La identificación de los componentes fue asignada por comparación de sus espectros de masas con los ofrecidos por la biblioteca del equipo (Base de datos NIST 98) y los reportados en la literatura.
RESULTADOS
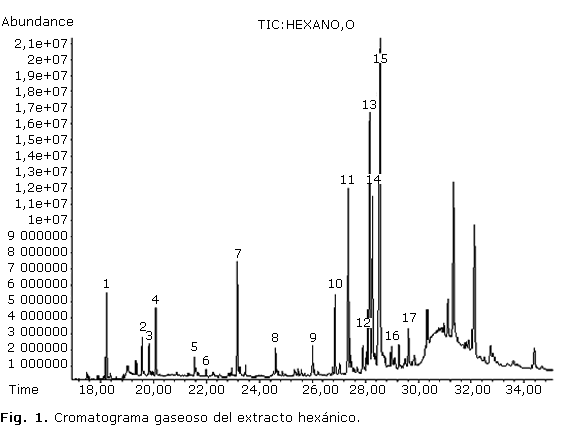
El estudio por CG/EM del extracto hexánico permitió identificar 17 componentes. Se encontraron hidrocarburos, entre ellos 4 alifáticos (picos 3, 5, 7, 9) y uno cíclico (pico 15); alcoholes superiores (pico 2, 8, 13, 17), un diterpeno (pico 4), esteroles (12, 14, 16), vitamina E (11), g-tocoferol (10), una cetona (picos 1) y un compuesto lactónico (6); resultaron predominantes los compuestos hidrocarbonados. En la figura 1 se muestra el cromatograma gaseoso del extracto y en la tabla 1 los metabolitos con sus respectivos tiempos de retención, abundancia relativa, ion molecular y fórmulas química.
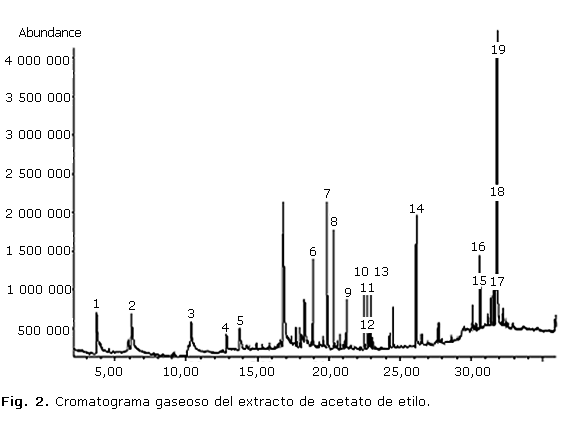
En el extracto de acetato de etilo se identificaron 19 compuestos: fenol (pico 1) y 3 derivados de este (picos 2, 4, 5); una coumarina (3); 5 terpenos, entre ellos, 1 apocarotenoide (pico 6), 1 alcohol terpénico (7), 2 diterpenos (8, 13) y 1 triterpenoide (18); 2 esteroles (17, 19); 2 ésteres de ácidos grasos (9, 12); alcoholes superiores (10, 11); 1 alqueno (14); vitamina E (16) y b-tocoferol (15). En la figura 2 se evidencia el cromatograma gaseoso de dicho extracto y en la tabla 2 se señalan los compuestos con sus valores de áreas relativas, tiempos de retención, ion molecular y fórmulas químicas.
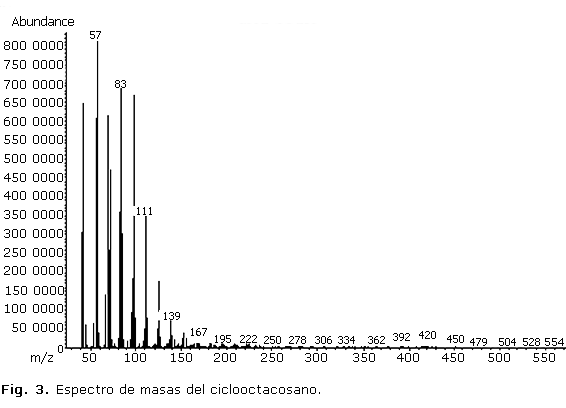
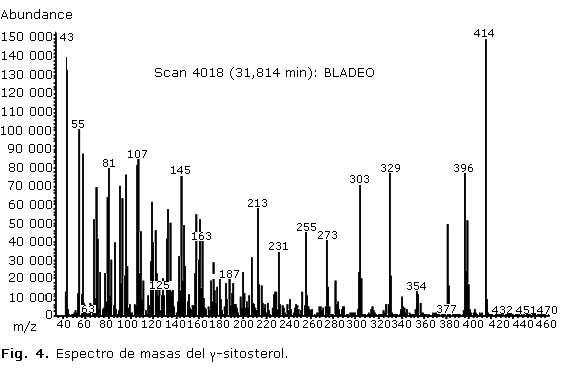
Los espectros de masas de los compuestos mayoritarios en cada extracto se muestran en las figuras 3 y 4.
DISCUSIÓN
En el estudio del extracto hexánico se presentó un cromatograma con gran cantidad de picos de diferentes intensidades a partir de los 18 min; el de mayor abundancia fue el pico 15 que se registró a un tiempo de retención de 28,5 min aproximadamente, el cual correspondió al hidrocarburo ciclooctacosano, que mostró un valor de área relativa de 30,02 %. Este compuesto no ha sido identificado desde otras especies de Phyllanthus, aunque se ha encontrado como componente del aceite esencial de Minuartia meyeri Bornm (Caryophyllaceae).9 El espectro de masas del compuesto (figura 3) evidenció un comportamiento propio de cicloalcanos y similar al de los hidrocarburos saturados alifáticos. El ion molecular a m/z 392 se presentó con un pico de muy baja intensidad, acompañado de un fragmento a m/z 364 en correspondencia con la pérdida del grupo C2H4 desde el ion molecular. Otros fragmentos a m/z 57 relacionado con el grupo C4H9+ que constituye el pico base del espectro y m/z 83 y 167 correspondientes a pérdidas sucesivas desde el ion molecular de varios grupos C2H4 (28), acompañado de la pérdida de hidrógeno, fueron identificados.10
Resulta interesante la presencia de vitamina E con un 10,90 % de área relativa y gamma tocoferol con 4,36 %, los cuales no se han reportado desde extractos apolares de especies pertenecientes a este género.
El análisis del extracto de acetato de etilo también evidenció un cromatograma conformado por gran cantidad de picos de diferentes intensidades, que encontró mayor complejidad a partir de los 15 min aproximadamente. En dicho extracto el mayor porcentaje de compuestos identificados correspondió a estructuras del tipo terpénicas, aunque el metabolito mayoritario fue el ã-sitosterol. Del grupo de los esteroides, este es un fitoesterol tetracíclicos menos frecuente, es común encontrar su isómero â-sitosterol, ampliamente distribuido en la naturaleza y en muchas especies de Phyllanthus, entre ellas, P. carioliniensis; P. corcovadensis; P. engleri; P. flexuosus; P. muellerianu; P. niruri; P. urinari y P. Watsonii, y ha demostrado tener actividad antiinflamatoria y analgésica.11 El espectro de masas de dicho compuesto (Fig. 4) mostró el ion molecular con m/z 414, un fragmento con m/z 396 debido a la pérdida de agua desde el ion molecular, m/z 381 por pérdida de metilo y agua (M+-15-18), m/z 273 originado por la pérdida de la cadena lateral (C10H21) a partir del cual se origina el ion m/z 255 por pérdida de agua, entre otros.
Otro metabolito mayoritario según los valores de áreas relativas es el terpeno vomifoliol con un 9,9 %, el cual no ha sido referido en otras especies de Phyllanthus aunque se ha identificado en especies de Rauwolfia vomitoria, Policourea alpina,12 Picus chlamydocarpa y Picus cordata (Moraceae).13
Se destaca también el compuesto representado por el pico 18 (9,13 %) que eluyó a un tiempo de 31,76 min y según los resultados mostrados por la base de datos del equipo y las referencias bibliográficas consultadas,14-16 se puede sugerir que es un triterpeno pentacíclico del grupo del taraxastano, específicamente del Epi-ø-taraxastanonol, el cual no ha sido identificado en especies de Phyllanthus, aunque se ha estudiado mucho en la familia Anacardiaceae en la especie Mangifera indica;16 también se ha aislado de Euphorbia broteri,17 entre otras, manifestando actividad antiinflamatoria y antitumoral.18
En conclusión, la CG/EM permitió la identificación de los principales metabolitos presentes en los extractos hexánico y de acetato de etilo; en el primero resultó predominante la presencia de hidrocarburos, especialmente el ciclooctacosano. En el segundo extracto, los terpenos constituyeron los compuestos mayoritarios y la estructura más abundante fue el esterol ã-sitosterol. Cabe destacar que los resultados ofrecidos son reportados por primera vez y constituyen aspectos novedosos que contribuirán a ampliar el conocimiento acerca de la composición química de esta planta endémica.
REFERENCIAS BIBLIOGRÁFICAS
1. Roig JT. Diccionario botánico de nombres vulgares cubano. La Habana: Editorial Científico Técnica; 1988. p. 80.
2. Del Barrio G, Parra F. Evaluation of the antiviral activity of an aqueous extract from Phyllanthus orbicularis. J Ethnopharmacol. 2000;72:317-22.
3. Fernández J, Del Barrio G, Romeo B, Gutiérrez Y, Valdés S, Parra F. In vitro antiviral activity of Phyllanthus orbicularis extract againts herpes simples type 1. Phytother Res. 2003;17:980-2.
4. Valdés S, Del Barrio G, Gutiérrez Y, Morier L. Evaluación preliminar de la actividad del extracto acuoso de Phyllanthus orbicularis frente al virus VHS-1. Rev Cubana Med Trop. 2003;55(3):169-73.
5. Ferrer M, Sánchez A, Fuentes J, Barbé J, Llagostera M. Antimutagenic mechanisms of Phyllanthus orbicularis when hydrogen peroxide is tested using Salmonella assay. Short communication. Mut Res. 2002;517:251-4.
6. Sánchez AL, Fuentes JL, Fonseca G, Cápiro N, Ferrer M, Alonzo A, et al. Assessment of the potential genotoxic risk of Phyllantus orbicularis HBK aqueous extract using in vitro and in vivo assays. Toxicol Letters. 2002;136:87-96.
7. Berazaín R, Fuente V, Sánchez D, Rufo L, Rodríguez N, Amils R. Nickel localization on tissues of hyperaccumulator species of Phyllanthus L. (Euphorbiaceae) from ultramafic areas of Cuba. Biol Trace Elem Res. 2007;115:67-86.
8. Álvarez A, Del Barrio G, Kouri V, Martínez P, Suárez B, Parra F. In vitro anti-herpetic activity of an aqueous extract from the plant Phyllanthus orbicularis. Phytomedicine. 2009;16(10):960-6.
9. Nurettin Y, Canan G, Osman Ü, Ahmet Y, Serdar Ü, Kamil C, et al. Composition and Antimicrobial Activities of Volatile components of Minuartia meyeri. Turk J Chem. 2006;30:71-7.
10. Silverstein RM, Bassler CG, Morrill TC. Spectrometric identification of organic compounds. 3rd ed. La Habana: Edición Revolucionaria; 1977. p. 5-38.
11. Calixto JB, Adair RS, Valdir CF, Rosendo AY. A review of the plants of the genus Phyllanthus: Their chemistry, pharmacology and therapeutic potential. Med Res Rev. 1998;18(4):225-58.
12. Stuart KL, Ivonne GW. Further effects of vomifoliol on stomatal apertura ando n the germination of Lettuce and the Growth of cucumber seedlings. Planta (Berl.). 1975;127:21-5.
13. Kuete V, Ngameni B, Fotso Simo C, Kengap R, Tchaleu B, Meyer M, et al. Antimicrobial activity of the crude extracts and compounds from Picus chlamydocarpa and Picus cordata (Moraceae). J Ethnopharmacol. 2008;120(1):17-24.
14. Budzikiewicz H, Wilson JM, Djerassi C. Mass spectrometry in structural and stereochemical problems. XXXII. Pentacyclic Triterpenes.1963;85:3688-99.
15. Hinge VK, Paknikar S K, Das KG, Bose AK. and Bhattacharyya. Terpenoids-LXXXVI. Structure of Epi-ø-Taraxastanonol and Epi-ø-Taraxastanediol. Tetrahedron. 1966;22:2861-8.
16. Anjaneyulu V, Satyanarayana P, Viswanadham K, Jyothi V. Triterpenoids from Mangifera indica. Phytochemistry. 1999;50:1229-36.
17. Pascual TJ, Urones JG, Marcos IS, Basabe P, Sexmero MJ, Fernández RM. Triterpenes from Euphorbia broteri. Phytochemistry. 1987;26(6):1767-76.
18. Toshihiro A, Ken Y, Hirotoshi O, Yoshimasa K, Sakae Y, Michio T, et al. Triterpene alcohols from the flower of compositae and their anti-inflammatory effects. Phytochemistry. 1996;43(6):255-1260.
Recibido: 2 de febrero de 2011.
Aprobado: 29 de marzo de 2011.
MSc. Yamilet Irene Gutiérrez Gaitén. Instituto de Farmacia y Alimentos, Universidad de La Habana. Ave 23 No. 21 425 e/ 214 y 222, La Coronela, La Lisa, CP 13600, La Habana, Cuba. Correo electrónico: ygutierrez@infomed.sld.cu