My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Farmacia
Print version ISSN 0034-7515
Rev Cubana Farm vol.46 no.2 Ciudad de la Habana Apr.-June 2012
ARTÍCULO ORIGINAL
Fosfato de cromo (III) marcado con diferentes radionúclidos para uso en radiosinoviortesis
Chromium (III) phosphate labelled with several radionuclides for use in radiosynoviothersis
MSc. Jorge Cruz Arencibia, Dr. C. José Morín Zorrilla, MSc. Amed Cruz Morales, MSc. Radamés Tamayo Fuente, MSc. Tamara Taylor Delgado, Lic. Milagros Samiñón Medina
Centro de Isótopos (CENTIS). La Habana, Cuba.
RESUMEN
Introducción: la radiosinoviortesis se utiliza en el tratamiento de la sinovitis crónica, complicación frecuente en enfermedades sistémicas como artritis reumatoide y hemofilia. En la práctica clínica internacional se emplean diferentes coloides y suspensiones radiactivas, pero su número es reducido y su disponibilidad limitada.
Objetivo: obtención y caracterización físico-química de suspensiones de fosfato de cromo (III) marcadas con radionúclidos como potenciales radiofármacos para uso en radiosinoviortesis.
Métodos: las suspensiones se obtuvieron por síntesis química, los radionúclidos se añadieron al inicio de la reacción o después de finalizada esta. El tamaño de partículas se estimó mediante microscopia óptica y filtración por membranas. Asimismo se evaluó por espectrofotometría la estabilidad de la suspensión al ser resuspendida en distintos medios. La pureza radioquímica se determinó por cromatografía de papel.
Resultados: se obtuvo y caracterizó una suspensión de fosfato de cromo (III). El producto obtenido presentó un tamaño de partículas predominante entre 0,8-5 µm y que al ser suspendidas en solución de gelatina al 2 % en tampón acetato 1 mg/mL no sedimentó en menos de 3 h. Se estableció la tecnología para la obtención de formulaciones de fosfato de cromo (III) marcado con 32P e 90Y y se demostró la factibilidad de marcar la suspensión obtenida con otros radionúclidos trivalentes como 177Lu y 68Ga.
Conclusiones: los resultados permiten considerar al fosfato de cromo (III) una suspensión base para la obtención de radiofármacos para uso en radiosinoviortesis en diferentes articulaciones, en función de las características físico-nucleares de los radionúclidos que se empleen.
Palabras clave: radiofármacos, radiosinoviortesis, fosfato crómico, sinovitis, artritis reumatoide, hemofilia.
ABSTRACT
Introduction: radiosynoviorthesis is used in treating chronic synovitis, a frequent complication of some systemic diseases as rheumatoid arthritis and hemophilia. There are different colloids and radioactive suspensions recommended in the international clinical practice, but the number is reduced and the availability limited.
Objective: obtaining and physical-chemical characterization of suspensions of chromium phosphate (III) labeled with several radionuclides as potential radiopharmaceuticals for using in radiosynoviorthesis.
Methods: the suspensions were obtained by chemical synthesis. Radionuclides were added at the beginning or after concluding the reaction. The particle size was estimated by means of optic microscopy and membrane filtration. Similarly, the stability of suspension when re-suspended in several media was evaluated by spectrophotometry. The radiochemical purity was determined by paper chromatography.
Results: a suspension of chromium (III) phosphate was obtained and characterized. It was found that the obtained product had a predominant particle size range of 0,8 to 5 µm and that when suspended in 2 % gelatin solution in 1mg/ml acetate buffer, it settled in no less than 3 hours. Technologies for the preparation of radiopharmaceuticals of Chromium (III) Phosphate labeled with 32P and 90Y were described. There was demonstrated the feasibility of labeling the obtained suspension with other trivalent radionuclides such as 177Lu and 68Ga.
Conclusions: the results allow considering the obtained Chromium (III) Phosphate suspension as a matrix for the preparation of radiopharmaceuticals to be used in radiosinoviorthesis aimed at various joints, depending on the physical and nuclear characteristics of the radionuclides.
Key words: radiopharmaceuticals, radiosynoviorthesis, Chromium phosphate, synovitis, rheumatoid arthritis, hemophilia.
INTRODUCCIÓN
La radiosinoviortesis (RSV) se utiliza en el tratamiento de la sinovitis crónica, una complicación frecuente de enfermedades sistémicas como artritis reumatoide y hemofilia. Consiste en la inyección intrarticular de un radiofármaco en forma de suspensión y la reducción de la membrana sinovial inflamada por la acción de las partículas b-, lo que en la mayoría de los casos alivia el dolor, disminuye la hinchazón y favorece el movimiento de la articulación. Se trata de una alternativa que ofrece ventajas sobre la cirugía, como la posibilidad de repetir el procedimiento en caso de recidiva y de no requerir hospitalización.1 Las partículas inyectadas deben ser pequeñas, distribuirse homogéneamente en la articulación para evitar irradiación local innecesaria y ser fagocitadas por las células de la sinovia en proliferación, aunque no tan pequeñas que puedan migrar y producir dosis en los órganos vecinos.2
Los pocos radiofármacos que existen en el mercado se basan en silicato/citrato de 90Y, coloide de azufre de 186Re, citrato de 169Er 2,3 y fosfato de cromo (III) marcado con 32P,4 aunque se continúa la investigación de nuevos productos con estos radionúclidos y 177Lu, 153Sm, 166Ho, entre otros,5-8 ya que con un solo radionúclido no pueden tratarse todas las articulaciones.
Una matriz útil para RSV que pueda marcarse con diferentes radionúclidos favorecería el proceso tecnológico y la comparación evaluativa de la eficacia terapéutica y la seguridad de los radiofármacos, así como su empleo para articulaciones de diferente tamaño. A ello se encamina el presente trabajo.
MÉTODOS
Obtención de la suspensión de fosfato de cromo (III)
La suspensión de fosfato de cromo (III) se obtuvo por modificación de la técnica de Anghileri,9 basada en la reacción:
Los reactivos fueron de calidad analítica. El CrO3 (110 mmol/L) se trató con solución de Na2SO3 (1 190 mmol/L) en presencia de H3PO4 (100 mmol/L) a 70 °C durante 10 min y la suspensión verde azulada se centrifugó (centrífuga Presvac EPF-D, Argentina) a 10 000 rev/min durante 10 min. El 32P y el 51Cr se añadieron al inicio de la reacción junto con H3PO4 o el CrO3, mientras que el resto de los radionúclidos (68Ga; 90Y y 177Lu) se añadieron al inicio de la reacción o a la suspensión de fosfato de cromo (III) obtenida previamente en dependencia del objetivo del experimento. En el último caso se agitó 5 min (agitador horizontal), se centrifugó y lavó con agua para inyección. El producto final se lavó con agua para inyección y se suspendió en solución de gelatina al 2 % en tampón acetato; pH 4-4,5. La actividad varió entre 550 y 1 850 MBq para el 32P; 3,7 y 925 MBq para el 90Y; 3,7-7,4 MBq para el 68Ga y 37 y 185 MBq para el 177Lu. Las cantidades añadidas de 32P e 90Y se corresponden con los tamaños máximos de lotes previstos hasta el momento y que pueden alcanzar entre 10 y 15 bulbos.
El 51Cr se utilizó en forma de Na251CrO4; el 32P como ácido ortofosfórico, ambos de la firma Polatom, Polonia; el 90Y y el 68Ga de CENTIS, Cuba y el 177Lu de NPI, República Checa, todos en forma de sales de MCl3, en solución ácida. Los preparados se esterilizaron en autoclave (Raypa AE-12, España) a 100 °C durante 30 min y se conservaron a temperatura ambiente en contenedor de plomo con protección adicional de acrílico. La pureza radioquímica se determinó por cromatografía ascendente sobre papel, utilizando agua destilada como fase móvil para la suspensión marcada con 32P; solución de NaCl 0,9 % para las suspensiones marcadas con 51Cr; 68Ga y 177Lu y metanol 80 %:citrato de sodio 0,05 mol/L para la suspensión marcada con 90Y.
Sedimentación en distintos medios
Una vez centrifugado el precipitado de fosfato de cromo (III) no radiomarcado fue suspendido con agitación durante 5 min en 5 mL de soluciones tampones a las que se añadieron polivinilpirrolidona (PVP) y gelatina a diferentes concentraciones. El proceso de sedimentación se siguió por medición de la densidad óptica en un espectrofotómetro Spectronic Genesys 5 (EE. UU.) a 400 nm, en la zona de mayor absorbancia en el espectro de una suspensión de fosfato de cromo (III) en agua.10 Se registraron disminuciones de absorbancia de hasta un 75 % con respecto al valor inicial a los efectos de disponer de un criterio a la vez objetivo y práctico de este proceso.
Estimación del tamaño de partículas
- Microscopia óptica
Cinco frotis en portaobjetos de una gota de cinco suspensiones no radiomarcadas diferentes se observaron en microscopio óptico (Olympus CH-2 Japón) con aumento de 40X y micrómetro ocular de escala 5:100 mm. Se tomaron tres fotos por cada frotis (cámara digital con zoom óptico (PENTAX, Japón)) y se procesaron mediante el programa Image Tool11 y en hoja de cálculo de Excel diseñada para estos fines. Para el conteo las fotos se dividieron en cuatro partes y se contaron las partículas presentes (150 como mínimo por foto) midiéndose sus ejes de mayor longitud.
- Filtración por membranas
A 200 µL de la suspensión radiomarcada se adicionaron 800 ìL de agua destilada y se determinó la actividad relativa inicial (A0) mediante aplicación de 5 ìL de esta última preparación en papel Whatman 3MM. La actividad se midió en contador de centelleo líquido (Wallac-LKB, Inglaterra o de NaI (Tl) Berthold LB 2040 (Alemania) según el radionúclido. Toda la suspensión diluida se tomó con jeringa de 1 mL, se acopló esta a soportes con filtros de policarbonato (Nuclepore, EE. UU.) y se hizo pasar la solución a través del filtro y se recogió en un bulbo 15R al vacío por medio de una aguja hipodérmica G21. Para determinar la actividad relativa del filtrado Af se procedió de igual manera que para obtener A0. La porción de partículas que atraviesa el filtro se calculó como la razón entre Af y A0. Para realizar una distribución del tamaño de partículas, el filtrado obtenido después de tomar la alícuota correspondiente para la medición se filtró de manera similar por un filtro de tamaño de poro inferior y así sucesivamente. Se emplearon filtros de 5; 2; 0,8 y 0,2 µm. Se realizaron tres réplicas para cada suspensión (n= 5).
Para la comparación de los resultados encontrados por ambos métodos, los datos de microscopia óptica se agruparon en los intervalos de tamaño de poros de los filtros y se calculó la frecuencia acumulada para cada tamaño.
RESULTADOS
Caracterización de la suspensión de fosfato de cromo (III)
La figura 1 refleja la sedimentación de las partículas en los medios estudiados. La solución de gelatina al 2 % en tampón acetato 1 mg/mL, pH 4,0-4,5, resultó la apropiada para los fines deseados, por lo se empleó en todas las suspensiones de fosfato de cromo (III) estudiadas.
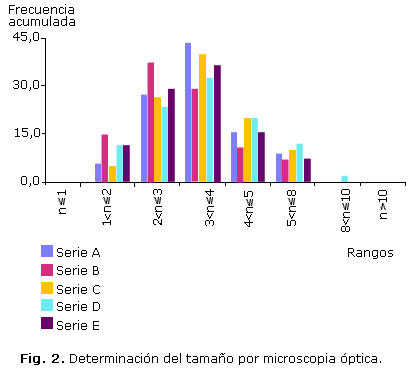
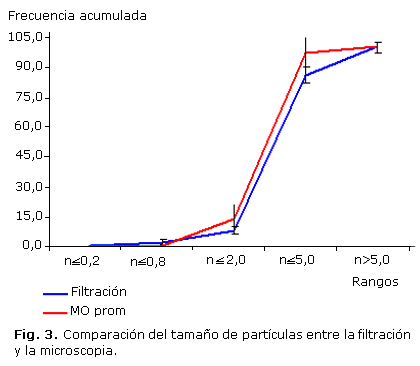
La figura 2 muestra los resultados de la determinación de tamaños por microscopia óptica. El tamaño promedio fue de 3,4 ± 1,2 µm y el 94 ± 8 % de las partículas tienen un tamaño entre 0,8 y 5 µm. El número de partículas o agregados mayores a 5 µm, presentes en todas las preparaciones, es menor del 7 % y no se encontraron partículas o agregados mayores de 10 ìm. En los experimentos de filtración se encontró que menos del 0,5 % de las partículas tiene un tamaño menor de 0,8 µm y que el 91 ± 4 % se encuentra en el rango entre 0,8 y 5 µm. La fracción de radiactividad que pasa a través de todos los filtros varió entre 5 % para el 32P y el 0,5 % para el 51Cr. La figura 3 refleja que existe una adecuada correspondencia entre los tamaños de partículas determinados por microscopia y filtración.
Obtención de fosfato de cromo marcado con diferentes radionúclidos
En la tabla 1 se muestran los resultados de las corridas para la obtención de la suspensión marcada con 32P. La pureza radioquímica fue superior al 95 % y más del 80 % de las partículas se encontraron entre 0,8 y 5 µm. Las suspensiones mantienen sus características de pureza radioquímica y tamaño de partículas al menos por 10 días después de obtenidas. Los resultados con los radionúclidos de elementos trivalentes estudiados (90Y3+; 68Ga3+ y el 177Lu3+) se presentan en la tabla 2. El rendimiento de la reacción fue superior al 97%, tanto si el radionúclido se añade al inicio de la reacción como a la suspensión preformada, y la pureza radioquímica fue superior al 97 % independientemente del radionúclido y de los rangos de actividad añadida. Más del 85% de las partículas se encontraron en el rango entre 0,8 y 5 µm.
Tabla 1. Resultados de la obtención de la suspensión marcada con 32P
| Corrida | Act. inicial | Act. final | Rend. (%) | Pureza radioquímica (%) | Tamaño de partículas | ||
| Rangos | t= 0 días | t= 10 días | |||||
| 1 | 548 MBq | 326 MBq | 59,5 | A: 96,3 ± 0,7 | > 5 µm | 3,2 | 4,3 |
| 5,0-0,8 µm | 85,9 | 82,6 | |||||
| 0,8-0,2 µm | 4,2 | 7,0 | |||||
| < 0,2 µm | 5,5 | 5,9 | |||||
| 2 | 574 MBq | 396 MBq | 69,0 | A: 96,9 ± 0,5 | > 5 µm | 1,6 | 3,5 |
| 5,0-0,8 µm | 90,4 | 84,9 | |||||
| 0,8-0,2 µm | 0,3 | 5,2 | |||||
| < 0,2 µm | 5,7 | 6,1 | |||||
| 3 | 714 MBq | 451 MBq | 63,2 | A: 95,4 ± 0,7 | > 5 µm | 4,5 | 3,9 |
| 5,0-0,8 µm | 88,3 | 85,6 | |||||
| 0,8-0,2 µm | 0,9 | 4,2 | |||||
| < 0,2 µm | 6,4 | 6,0 | |||||
| 4 | 1406 MBq | 759 MBq | 53,9 | A: 95,9 ± 0,8 | > 5 µm | 2,8 | 4,1 |
| 5,0-0,8 µm | 88,2 | 82,9 | |||||
| 0,8-0,2 µm | 1,8 | 6,1 | |||||
| < 0,2 µm | 5,9 | 6,4 | |||||
| 5 | 1865 MBq | 1048 MBq | 56,2 | A: 96,1 ± 0,4 | > 5 µm | 2,6 | 4,5 |
| 5,0-0,8 µm | 89,4 | 86,8 | |||||
| 0,8-0,2 µm | 0,6 | 5,3 | |||||
| < 0,2 µm | 6,1 | 3,1 | |||||
Tabla 2. Resultados de la obtención de la suspensión con marcada con radionúclidos de elementos trivalentes
| Radionúclido/corrida | Act. (MBq) | Rend. (%) | Pureza | Tamaño de partículas | ||
| (I: t=0 días) | Rangos | t= 0 | 1t= n días | |||
| 90Y | ||||||
| 1 | I: 303,4 | 99,3 | I: 99,3±0,2 | > 5 | 6,3 | 6,9 |
| 5,0-0,8 | 92,2 | 89,5 | ||||
| 0,8-0,2 | 0,8 | 2,5 | ||||
| <0,2 | 0,7 | 0,8 | ||||
| 2 | I: 526,5 | 99,1 | I: 99,6±0,1 | > 5 | 6,2 | 7,1 |
| 5,0-0,8 | 92,9 | 89,3 | ||||
| 0,8-0,2 | 0,3 | 2,5 | ||||
| <0,2 | 0,4 | 1,0 | ||||
| 3 | I: 925,0 | 99,4 | I: 99,3±0,2 | > 5 | 7,3 | 6,9 |
| 5,0-0,8 | 92,2 | 89,5 | ||||
| 0,8-0,2 | 0,3 | 2,5 | ||||
| <0,2 | 0,3 | 0,8 | ||||
| 68Ga | ||||||
| 1 | I: 3,70 | 98,2 | I: 97,2±0,3 | >5 | 10,1 | - |
| 5-0,8 | 89,3 | - | ||||
| <0,8 | 0,6 | - | ||||
| 2 | I: 4,07 | 97,1 | I: 96,8±0,4 | >5 | 7,6 | - |
| 5-0,8 | 91,7 | - | ||||
| <0,8 | 0,7 | - | ||||
| 3 | I: 5,5 F: 5,4 | 98,1 | I: 97,4±0,4 | >5 | 7,9 | - |
| 5-0,8 | 91,4 | - | ||||
| <0,8 | 0,5 | - | ||||
| 177Lu | ||||||
| 1 | I: 7,2 | 97,5 | I: 99,5 | >5 | 8,4 | 7,4 |
| 5-0,8 | 88,1 | 91,2 | ||||
| 0,8-0,2 | 1,8 | 1,0 | ||||
| <0,2 | 0,8 | 0,4 | ||||
| 2 | I: 40,7 | 98,8 | I: 98,9 | >5 | 7,4 | 9,3 |
| 5-0,8 | 90,7 | 89,4 | ||||
| 0,8-0,2 | 1,4 | 0,9 | ||||
| <0,2 | 0,6 | 0,4 | ||||
| 3 | I: 183,7 | 98,3 | I: 99,4 | >5 | 9,3 | 8,3 |
| 5-0,8 | 89,4 | 88,1 | ||||
| 0,8-0,2 | 0,9 | 0,8 | ||||
| <0,2 | 0,4 | 1,8 | ||||
fue de 7 días para el 90Y y de 8 días para el 177Lu.
DISCUSIÓN
El problema más crítico en el uso terapéutico de los coloides y las suspensiones radiactivas está dado por la liberación del radionúclido de las partículas o la fuga de estas del sitio de inyección o del órgano blanco, provocando dosis innecesarias de irradiación a los órganos no blanco. Es fundamental, por tanto, asegurar la estabilidad, tanto de la partícula como del producto radiactivo. El radionúclido debe mantenerse unido a la partícula y esta debe permanecer intacta (sin agregación o desintegración) durante su empleo. La liberación del radionúclido de la partícula se puede evitar en alto grado haciendo que este forme parte de la matriz o garantizando una unión estable por enlace covalente o iónico.12 Teniendo en cuenta lo anterior, en el presente trabajo para la caracterización de la suspensión se determinó solo el tamaño de las partículas, la capacidad de resuspensión y la pureza radioquímica, factores que permiten evaluar la seguridad durante el uso del radiofármaco.
Cuando las partículas son suspendidas en soluciones tampones comunes (Fig. 1) la sedimentación es más rápida que en presencia de estabilizadores. A las concentraciones utilizadas la sedimentación en gelatina es más lenta que en PVP, y se observa que cuando se emplea sola se requiere más agitación y tiempo para que las partículas se dispersen totalmente, que cuando se combina con un electrolito. Por tanto, se seleccionó como medio dispersante la solución de gelatina al 2 % en tampón acetato 1 mg/mL. Como se aprecia de la figura 1, en este medio las partículas se mantienen sin depositarse al menos 3 h. Este hecho es de singular importancia en la práctica, pues permite de una parte prolongar el tiempo en que pueden actuar los mecanismos de fagocitosis en la articulación, antes que las partículas se depositen en esta y por otra, favorecer una distribución más uniforme.
Se demostró que más del 75 % de las partículas tiene un tamaño entre 2 y 5 µm por los dos métodos utilizados. Este rango está muy próximo al que se considera óptimo para los preparados destinados a RSV,13 aunque se indica como más apropiado un rango entre 2-10 µm.14 Se observó una adecuada correspondencia entre los tamaños de partículas determinados por filtración y por microscopia óptica, lo que permite considerar que en la suspensión obtenida el radionúclido se encuentra homogéneamente distribuido entre las partículas de diferente tamaño. A partir de estos resultados se recomienda emplear el método de filtración por membranas con filtros Nuclepore como método de control durante la producción rutinaria por su sencillez y rapidez de ejecución.
En los experimentos de filtración se encontró que la fracción que pasa por todos los filtros, o sea, que es menor a 0,2 µm, varía en función del radionúclido, siendo mayor para la suspensión marcada con 32P debido a la presencia de fosfato libre marcado, cuyo contenido osciló entre 4 y 5 % en las preparaciones obtenidas.
Para la suspensión marcada con 32P el rendimiento promedio del proceso fue de 60,5 %, lo que coincide con lo informado antes y que se considera aceptable para esta reacción.9 A partir de la actividad inicial añadida (hasta 1 850 MBq, tabla 1) se puede obtener producto en una magnitud que permite cubrir la demanda estimada. No se encontró influencia de la actividad o el volumen añadidos en el rendimiento, la pureza radioquímica o el tamaño de partículas del producto final, el que es estable por 10 días, tiempo suficiente para su aplicación clínica. La pureza radioquímica es superior al 95% que se establece como límite en la Farmacopea de EE. UU.15
Los resultados con 90Y3+; 68Ga3+ y 177Lu3+ muestran la posibilidad de disponer de suspensiones de CrPO4 marcadas con radionúclidos de elementos trivalentes de forma sencilla, rápida y con rendimientos prácticamente cuantitativos. La pureza radioquímica y los tamaños de las partículas hacen a estas suspensiones potencialmente útiles en RSV. En el caso específico del 90Y la actividad añadida se incrementó hasta 925 MBq, lo que permite, al igual que en el caso de 32P, obtener la suspensión marcada en las cantidades requeridas para su aplicación en la clínica. Se ha informado5 la obtención de [90Y]YPO4 mediante precipitación directa del 90Y3+ en presencia de fosfato para ser usado en RSV y la obtención de Sm[32P]PO4, por precipitación de fosfato de samario, resultado de la interacción de Sm3+ y ácido fosfórico marcado con 32P,7 lo que sustenta la idea de que radionúclidos de elementos trivalentes cuyos fosfatos sean insolubles, deben coprecipitar con fosfato de cromo (III). De esa manera es presumible que se obtengan a partir de fosfato de cromo (III) radiofármacos con otros radionúclidos trivalentes de interés en RSV como 166Ho,169Er,145Dy, no estudiados en este trabajo.
Los resultados y el análisis de la química de elementos de interés con número de oxidación predominante 3+, en particular la solubilidad de los fosfatos, permiten considerar al fosfato de cromo (III) una suspensión base para la obtención de radiofármacos para el tratamiento de diferentes articulaciones en función de las características físico-nucleares de los radionúclidos que se empleen.
REFERENCIAS BIBLIOGRÁFICAS
1. Siegel H, Luck JVJr, Siegel ME. Advances in Radionuclide Therapeutics in Orthopaedics. J Am Acad Orthop Surg. 2004;12(1):55-64.
2. Schneider P, Farahati J, Reiners C. Radiosynovectomy in Rheumatology, Orthopedics, and Hemophilia. J Nucl Med. 2005;46:48S-54S.
3. EANM. Procedure Guidelines for Radiosynovectomy. Eur J Nucl Med. 2003;30:BP7-BP11.
4. Dunn AL, Manco-Johnson M, Busch MT, Balark KL, Abshire TC. Leukemia and P32 Radionuclide Synovectomy for Hemophilic Arthropathy. J Thromb Haemost. 2005;3:1541-2.
5. Pandey U, Ketaki B, Grace S, Haladhar S, Pradeep Ch, Prem D, et al. Evaluation of 90Y Phosphate Particles as a Possible Radiation Synoviorthesis Agent. Nucl Med Commun. 2005;26 (5):459-63.
6. Chakraborty S, Das T, Banerjee S, Haladhar DS, Venkatesh M. Preparation and preliminary biological evaluation of 177Lu-labelled hydroxyapatite as a promising agent for radiation synovectomy of small joints. Nucl Med Commun. 2006;27:661-8.
7. Prabhakar G, Satbir S, Sachdev, Umamaheswaria S, Sivaprasad N, Bhatiaa MH, et al. Development of samarium [32P] phosphate colloid for radiosynoviorthesis applications: Preparation, biological and preliminary clinical studies experience. Applied Radiation Isotopes. 2007;65:1309-13.
8. Melichar F, Kropacek M, Srank J, Beran M, Mirzajevova M, Zimova J, et al. Labelled compounds as radiopharmaceuticals for radiosynoviorthesis. J Radioanal Nucl Chem 2009;280(2):353-8.
9. Anguileri LJ. Rapid method for obtaining colloidal suspension of phosphorus-32 as chromic phosphate. 2nd. Int. Conf. On Peaceful Uses of Atomic Energy, UN, Geneva, Vol 20. 1958. p. 50-2.
10. Tarafdar A, Biswas S, Pramanik NK, Pramanik P. Synthesis of mesoporous chromium phosphate through an unconventional sol-gel route. Micropor. Mesopor Mater. 2006;89:204-8.
11. Image Tool. Last Update: Jun. 2006. [cited 2011 Jun 15] Available from: http://ddsdx.uthscsa.edu/dig/itdesc.html.
12. Arshady R. Microsphere, Microcapsule & Liposome. Radioladeled and Magnetic Particulates in Medicine y Biology. Vol. 3. Londres: Citus Books; 2001. p. 99.
13. Noble J, Jones AG, Davis MA, Sledge CB, Kramer RI, Livni E. Leakage of Radioactive Particle Systems from a Synovial Joint Studied with a Gamma Camera. Its Application to Radiation Synovectomy. J Bone Joint Surg Am. 1983;65(3):381-9.
14. Prabhakar G, Sachdev SS, Sivaprasad N. Radiation synovectomy (RS), an effective radiotherapy using radiopharmaceuticals for the treatment of inflammatory joint disorders. Pharma Times. 2009;41(6):11-4.
15. United State Pharmacopea. Chromic Phosphate P 32 Suspension. 30. ed. National Publishing: Philadelphia; 2007. p. 2945.
Recibido: 24 de noviembre de 2011.
Aprobado: 29 de diciembre de 2011.
Jorge Cruz Arencibia. Centro de Isótopos (CENTIS). Ave. Monumental y Carretera La Rada km 3½, Vallle de la Victoria, Guanabacoa, La Habana, Cuba. Correo electrónico: saul@centis.edu.cu