My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Farmacia
Print version ISSN 0034-7515
Rev Cubana Farm vol.46 no.2 Ciudad de la Habana Apr.-June 2012
ARTÍCULO ORIGINAL
Validación del método de determinación de efecto anestésico local
Validation of the measuring method of local anesthetic effect
MSc. Alicia Lagarto Parra, Lic. Leonid Torres Amaro, Téc. Carmen Carrillo Domínguez, Téc. Tatiana Gabilondo Ramírez
Centro de Investigación y Desarrollo de Medicamentos (CIDEM), UCTB Control Biológico. La Habana, Cuba.
RESUMEN
Introducción: la determinación del tiempo de anestesia local de un medicamento o principio activo en investigación se realiza empleando un ensayo biológico.
Objetivo: validar el método de determinación del tiempo de anestesia local para disponer de un método de ensayo validado para la evaluación de medicamentos genéricos con esta actividad farmacológica.
Métodos: se evaluaron los parámetros de exactitud, precisión, robustez, linealidad, paralelismo y especificidad siguiendo la metodología descrita en la Regulación 41-2007 del Centro para el Control Estatal de la Calidad de los Medicamentos (CECMED) para la Validación de métodos de análisis.
Resultados: en el estudio de exactitud no se observaron diferencias significativas entre los resultados al ensayar la muestra y el material de referencia. En el estudio de la repetibilidad se alcanzaron coeficientes de variación menor del 50 %. No se observaron diferencias significativas entre las precisiones alcanzadas por dos analistas diferentes, en días diferentes, a tres lotes diferentes. El estudio de especificidad mostró que los excipientes o sustancias auxiliares de la formulación no interfieren en la evaluación del producto. El método resultó ser lineal en el intervalo de concentraciones de 50 a 120 % con exactitud y precisión aceptable para cada dilución y mostró paralelismo. El ensayo de robustez mostró que no existen diferencias en las respuestas obtenidas al variar diferentes parámetros.
Conclusiones: el método biológico resultó ser exacto, preciso, específico, lineal y robusto.
Palabras clave: validación, métodos biológicos, lidocaína.
ABSTRACT
Introduction: a biological test is used to measure local anesthesia time of a drug or an active principle under research.
Objective: to validate the measuring method of local anesthesia time for the evaluation of generic drug with this pharmacological action.
Methods: accuracy, precision, robustness, linearity, parallelism and specificity were evaluated according to the methodology described in 41-2007 Regulation of the Center for the State Control of Drug Quality (CEDMED).
Results: in the accuracy test, no significant differences were observed between the results of tested sample and the reference material at the 3 tested doses. Variation Coefficients was less than 50 % in the repeatability test. There were no significant differences between the precision values of two different analysts at different times and in three different batches. The specificity test showed that excipients or auxiliary substances in the formulation did not interfere with the evaluation of the product. The method was linear in a 50-120 % range of concentrations, with acceptable accuracy and precision, and parallelism. The robustness test yielded no differences in the results obtained after changing various parameters.
Conclusions: biological method proved to be accurate, precise, specific, linear and robust.
Key words: validation, biological method, lidocaine.
INTRODUCCIÓN
Como parte del cumplimiento de las Buenas Prácticas de Laboratorio uno de los requisitos exigidos es la validación de los ensayos biológicos empleados para la investigación y el control de calidad de productos farmacéuticos, ya que la validación proporciona un alto grado de confianza y seguridad del proceso productivo o del método analítico, así como también en la calidad de los resultados.
El ensayo biológico para determinar el tiempo de anestesia local se encuentra descrito por Sainz y otros.1 El ensayo se desarrolla en ratas Wistar, jóvenes adultas, que pueden ser de cualquier sexo, en grupos de 10 animales a los que se les administra 0,2 mL del inyectable de lidocaína en una pata trasera. Posteriormente se determina el efecto anestésico explorando la sensibilidad del miembro El ensayo se da como satisfactorio siempre que el efecto anestésico en la pata inyectada supere los 90 min posteriores a la administración.
Dicho ensayo se considera como uno desarrollado en el laboratorio, por lo cual se le realiza una validación exhaustiva teniendo en cuenta los parámetros para ensayos de contenido y actividad biológica, evaluando la exactitud, precisión, robustez, linealidad, paralelismo y especificidad.2 Esta validación se realizó empleando como sustancia de referencia y muestra la lidocaína hiperbárica.
La lidocaína hiperbárica se presenta en preparación parenteral y es utilizada para la anestesia local por infiltración, en la región central por bloqueo epidural, lumbar o caudal, subaracnoideo con dextrosa para obtener solución hiperbárica, bloqueo de nervio periférico, paracervical, anestesia trastraqueal y anestesia regional.3
El objetivo del presente trabajo es validar el método de determinación del tiempo de anestesia local para disponer de un método de ensayo validado para la evaluación de medicamentos genéricos con esta actividad farmacológica.
MÉTODOS
Sustancia de ensayo
Las diferentes sustancias de ensayo empleadas fueron suministradas por el Laboratorio Farmacéutico "Juan R. Franco", las que se describen a continuación:
Lidocaína hiperbárica ámpulas 150 mg/3 mL producto terminado:
|
Lotes | Fecha fabricación | Fecha vencimiento |
| 05008 | 12/05 | 12/08 |
|
05009 | 12/05 | 12/08 |
|
06002 | 04/06 | 04/09 |
Material de referencia: lidocaína clorhidrato, lote MC/LHB/198/07, fecha fabricación 07/07, fecha vencimiento 05/12, procedencia Xylo Chem Ind., India.
Placebo, fecha vencimiento 10/09, que contiene todos los componentes de la formulación excepto el principio activo.
Animales
Se emplearon ratas Wistar, jóvenes adultos, machos, que pesaban entre 150 y 200 g. Todos los animales procedían de la colonia de la UCTB Control Biológico del Centro de Investigación y Desarrollo de Medicamentos (CIDEM, La Habana, Cuba), los cuales se alojaron en sala con temperatura controlada de 22 ± 2 ºC, se alimentaron con dieta estándar para roedores proveniente del Centro Nacional para la Producción de Animales de Laboratorio (CENPALAB) y se les suministró agua acidulada a voluntad. Los animales fueron mantenidos bajo normas de estricto cumplimiento de cuidado y manipulación según lo establece la Convención Europea para el Cuidado Animal. Los protocolos experimentales fueron aprobados por el Comité de Ética del CIDEM.
Validación del método de determinación de tiempo de anestesia local
Tanto la muestra de producto terminado como la sustancia de referencia fueron diluidas en los casos requeridos empleando agua para inyección.
Se conformaron grupos de 10 animales a los que se les administró 0,2 mL del inyectable de lidocaína (o el volumen fijado según la dosis a evaluar) en una pata trasera, con el objetivo de irrigar el nervio ciático y producir la anestesia del miembro. Posteriormente se determinó el efecto anestésico explorando la sensibilidad del miembro mediante estímulos dolorosos de punción, y se comparó la respuesta de la pata anestesiada con la no anestesiada. El ensayo se consideró satisfactorio siempre que el efecto anestésico en la pata inyectada superó los 90 min posteriores a la administración.
Parámetros de validación
Exactitud
El ensayo se realizó mediante la comparación con un material de referencia. Se efectuaron tres ensayos en paralelo comparando el material de referencia con el producto terminado, para lo cual se administaron 0,2 mL del producto en la pata del animal. Se determinó si existían diferencias significativas entre los tiempos de anestesia de las muestras y el material de referencia, mediante la prueba t de Student, tomando un valor de p< 0,05 para la significación estadística.
Precisión
Se evaluaron los parámetros de repetibilidad y precisión intermedia.
Repetibilidad: se evaluaron tres concentraciones (80, 100 y 120 %), empleando como muestra el producto terminado y realizando el ensayo por triplicado. Para cada resultado, en cada nivel de concentración se determinó el valor medio, la desviación estándar y el coeficiente de variación. El coeficiente de variación debió ser menor del 50 %.
Precisión intermedia: se ensayaron tres lotes del producto terminado, se realizaron tres ensayos por cada lote, por dos analistas diferentes y cada uno condujo los ensayos en dos días diferentes. Se determinó el valor medio del resultado para cada lote, cada analista y cada día. Se determinó estadísticamente si existían diferencias entre la precisión alcanzada por los analistas, entre las medias obtenidas por los analistas y se determinaron los límites de confianza para un 95 % de la media. El coeficiente de variación total debió estar entre 50 y 150 %.
Especificidad
Se efectuó el ensayo de especificidad mediante el empleo de un placebo que contenía todos los ingredientes de la muestra excepto el analito. El ensayo se realizó empleando tres grupos experimentales, uno administrado con el placebo, otro administrado con la muestra de producto terminado y otro administrado con el material de referencia. Se realizaron tres ensayos por separado. En la valoración del placebo no se esperó ninguna respuesta cuantificable.
Linealidad
Se realizó el ensayo con cinco soluciones en el intervalo de concentraciones entre el 50 y el 150 % de la concentración teórica del principio activo en la muestra. Todos los ensayos se hicieron por triplicado. Se determinó el coeficiente de correlación y el de determinación. Se calculó la exactitud y la precisión para cada dilución, las cuales debieron ser aceptables para que se considerara lineal. La determinación del intervalo se realizó estableciendo el límite superior e inferior de linealidad (con precisión y exactitud aceptable).
Paralelismo
Se determinó mediante ensayos similares a los realizados para la linealidad, pero empleando un material de referencia. Se realizó de forma concomitante al estudio de linealidad.
Robustez
Para el análisis de la robustez se tuvo en cuenta la variación de siete parámetros que a continuación se describen, especificando los valores normales y alternativos entre paréntesis: peso de los animales (150-200 g/200-250 g), sexo (machos/hembras), temperatura del área de ensayo (20-25 ºC/28-34 ºC), intervalo entre la preparación de la muestra y la inyección (10 min/60 min), hora de realización del ensayo (10:00 a.m.-3:00 p.m.), cantidad de animales (n= 10/n= 5) y temperatura de la sala de hospedaje de los animales (20-25 ºC/28-34 ºC). Se realizaron ocho ensayos de acuerdo con las diferentes combinaciones diseñadas; los resultados fueron evaluados mediante un análisis de varianza de clasificación simple.
Procedimiento estadístico
Todas las variables fueron procesadas en el programa estadístico GraphPad InStat para obtener los valores medios y desviación estándar. Se determinó la homogeneidad de varianza de los datos mediante la prueba de Bartlett. Cuando la varianza fue homogénea se aplicó un ANOVA de una vía. Cuando la varianza no fue homogénea se aplicó la prueba de Kruskal-Wallis (ANOVA no paramétrico) y la prueba de comparación múltiple de Dunnett para determinar las diferencias entre las medias. Para el ensayo de exactitud se empleó la prueba t de Student para comparación de medias; en caso de no cumplir homogeneidad de varianza, se empleó la prueba t de Student aplicando la corrección de Welch. El valor de p para la significación estadística fue menor que 0,05.
RESULTADOS
En la tabla 1 se muestran los resultados del ensayo de exactitud. Se compararon los resultados mediante la prueba t de Student no pareada tomando un nivel de significación de p< 0,05. No hubo diferencias significativas entre la muestra y la referencia en la prueba de homogeneidad de varianza, observándose valores de p> 0,05. Tampoco existieron diferencias significativas entre el tiempo de anestesia obtenido al ensayar la muestra y el material de referencia, obteniéndose valores de p> 0,05.
En la tabla 2 se muestran los resultados del estudio de especificidad del método. Como se observa no se obtuvo respuesta de anestesia en los animales tratados con el placebo, lo cual sí se observó para los animales tratados con la muestra y el material de referencia, cuya respuesta fue superior a los 90 min de anestesia y muy similar entre ellos. De acuerdo con la prueba t de Student realizada no se observaron diferencias significativas entre los resultados para la muestra y el material de referencia (p= 0,5386; t= 0,6186).
En el estudio de la repetibilidad se alcanzaron coeficientes de variación menor del 50 %, lo que demuestra la buena precisión del método según el límite para ensayos biológicos (tabla 2).
Los resultados del estudio de la precisión intermedia realizado aparecen en la tabla 3. De acuerdo con el análisis de varianza se obtuvieron valores de p mayor que 0,05, lo que indica que no hay diferencias significativas en los resultados entre los diferentes analistas, días y lotes ensayados. Tampoco se observaron diferencias significativas en las distintas interacciones analizadas.
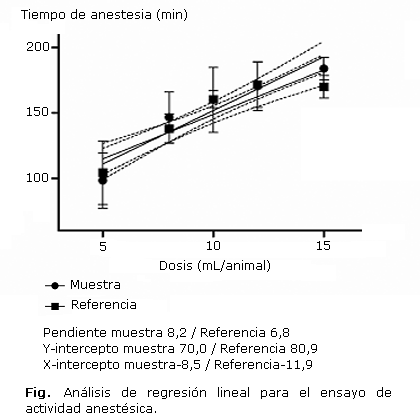
El comportamiento gráfico de los resultados del ensayo de linealidad se muestra en la figura. De acuerdo con el análisis de varianza los valores de p fueron menores que 0,05, lo cual indica que la pendiente es significativamente diferente de cero y por tanto, existe una relación entre la variación de la concentración del producto y la respuesta del tiempo de anestesia. Los valores del coeficiente de determinación fueron de 0,86 para la muestra y de 0,81 para la referencia, los cuales se consideran aceptables para métodos biológicos.
Al comparar los resultados de la regresión lineal de la muestra y la referencia se obtuvo que no existen diferencias significativas entre las pendientes (F= 1,16796; p= 0,2897) y los interceptos (F= 0,475961; p= 0,4961). Por tanto, se puede concluir que existe paralelismo entre la respuesta obtenida para la muestra y la sustancia de referencia.
Los valores medios de tiempo de anestesia para cada concentración, así como la desviación estándar y el coeficiente de variación se muestran en la tabla 4. Para todos los valores de concentración se obtuvieron coeficientes de variación inferior al 50 %, siendo aceptable la precisión para cada dilución de acuerdo con el límite para ensayos biológicos. Los resultados del análisis de varianza no mostraron diferencias significativas entre las desviaciones estándar de la muestra y referencia para cada dilución. La comparación de medias mostró diferencias significativas (p= 0,0078) entre el tiempo de anestesia para la muestra y la referencia en la dilución de 150 %. Por tanto, el intervalo en el que se obtienen precisión y exactitud aceptables para el ensayo de linealidad es de 50 al 120 %.
En la tabla 5 se muestran los resultados de tiempo de anestesia obtenido para cada uno de los ensayos realizados para evaluar la robustez. Los resultados del análisis de varianza no mostraron diferencias significativas entre los tiempos de anestesia obtenidos para cada uno de los ensayos realizados (p> 0,05). Por tanto, no existen diferencias en las respuestas obtenidas al variar los factores de peso de los animales, sexo, temperatura del área de ensayo, intervalo entre la preparación de la muestra y la inyección, hora de realización del ensayo, cantidad de animales y temperatura de la sala de hospedaje de los animales, de acuerdo con los valores alternativos fijados en el diseño.
DISCUSIÓN
La validación es necesaria porque proporciona un alto grado de confianza y seguridad del proceso productivo o del método analítico, así como también en la calidad de los resultados. Esto lógicamente se traduce en la disminución de número de fallos y repeticiones con el consiguiente ahorro de los costos asociados y en la optimización del método para mejorar su practicabilidad y posibilidades de automatización. El objetivo principal de la validación analítica es el de asegurar que un procedimiento analítico seleccionado dará resultados reproducibles y confiables que sean adecuados para el propósito previsto.4
La exactitud indica la capacidad del método analítico para dar resultados lo más próximo posible al verdadero valor.5 Los resultados del ensayo de exactitud muestran que la respuesta obtenida para el producto terminado y la sustancia de referencia es similar, por lo que se considera exacto el método de ensayo.
La precisión es el grado de correlación o cercanía entre los resultados analíticos individuales que se obtienen al aplicar repetidamente el método a varias muestras.5 Los resultados en los ensayos de repetibilidad y precisión intermedia muestran que el ensayo es preciso, en los que se obtuvieron coeficientes de variación por debajo de los límites establecidos para métodos biológicos.
La especificidad se define como la capacidad de un método analítico para medir de forma exacta y específica el analito, sin interferencia de impurezas, productos de degradación, compuestos relacionados o excipientes que puedan estar presentes en la matriz de la muestra.6 El resultado en los ensayos indica que los excipientes o sustancias auxiliares de la formulación no interfieren en la valoración biológica del producto.
La linealidad se considera como criterio inicial de validación y es la capacidad de un método analítico de obtener resultados proporcionales a la concentración de analito en la muestra, dentro de un intervalo determinado.6 De acuerdo con los resultados del presente trabajo, existe una relación entre la variación de la concentración del producto y la respuesta del tiempo de anestesia, por lo que el método de evaluación cumple con la linealidad y paralelismo. Teniendo en cuenta el intervalo con precisión y exactitud aceptable para el ensayo de linealidad, el intervalo para la determinación del tiempo de anestesia estará constituido por el límite inferior de 80 % (135 min de anestesia) y el límite superior de 120 % (162 min de anestesia), tomando para esto la ecuación de regresión obtenida para el material de referencia evaluado.
El estudio de robustez investiga la influencia de pequeños cambios en las condiciones analíticas sobre la fiabilidad del método analítico, localizando los factores que originan fluctuaciones menores y los que necesitan una atención especial por cuanto originan variaciones significativas.6 El método evaluado resultó ser robusto ya que no se obtuvieron diferencias significativas al variar los factores predeterminados. Este resultado brinda la posibilidad de realizar pequeñas variaciones en la realización del ensayo en caso de, por ejemplo, solo disponer de animales con sexo y peso en el intervalo de valores alternativos fijados en el ensayo de validación.
De acuerdo con los resultados, el método biológico validado para la determinación de tiempo de anestesia local resultó ser exacto, preciso, específico y lineal en el intervalo de concentraciones de 50-120 %, además cumplió con el ensayo de paralelismo y es robusto.
REFERENCIAS BIBLIOGRÁFICAS
1. Sainz F, Miyares C, García M. Técnicas de Farmacología Experimental. La Habana: Editorial Ciencia y Técnica; 1972. p.145.
2. CECMED. Validación de Métodos analíticos. Regulación Nº 41-2007. La Habana: MINSAP; 2007.
3. Martindale: The Complete Drug Reference. Lidocaine Hydrochloride. 36th ed. London: The Pharmaceutical Press; 2009. [CD-rom].
4. FDA. Analytical procedures and methods validation chemistry, manufacturing, and controls documentation. Guidance for Industry. Center for Biologics Evaluation and Research. Silver Spring, MD: FDA; 2002.
5. USP 32. General Chapter 1225, Validation of compendial methods, United States Pharmacopeia XXXII, Rockville: United Pharmacopoeial Convention, Inc.; 2009. [CD-rom].
6. International Conference on Harmonization (ICH) of Technical Requirements for the Registration of Pharmaceuticals for Human Use. Validation of analytical procedures: Text and Methodology, Q2(R1).Geneva: ICH; 2005.
Recibido: 24 de noviembre de 2011.
Aprobado: 29 de diciembre de 2011.
Alicia Lagarto Parra. Centro de Investigación y Desarrollo de Medicamentos (CIDEM), UCTB Control Biológico. 17 No. 6208 e/ 62 y 64 Playa, La Habana, Cuba. Correo electrónico: cidem.cb@infomed.sld.cu, alicia.lagarto@cidem.sld.cu