My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Farmacia
Print version ISSN 0034-7515
Rev Cubana Farm vol.47 no.1 Ciudad de la Habana Jan.-Mar. 2013
ARTÍCULOS ORIGINALES
Diseño de una formulación de ciclosporina A solución oral con alto grado de dispersión
Design of a formulation of highly dispersed cyclosporine A oral solution
MSc. Suslebys Salomón Izquierdo, Lic. Iván G. Morales Lacarrere, MSc. Marta Gómez Carril, Dr.C. Orestes D. López Hernández.
Centro de Investigación y Desarrollo de Medicamentos (CIDEM). La Habana, Cuba.
RESUMEN
La ciclosporina A (CsA) por sus propiedades inmunosupresoras es empleada en el transplante de órganos sólidos, médula ósea, así como para determinados estadíos de ciertas enfermedades autoinmunes. En Cuba, se comercializa una solución oral que presenta problemas de absorción gastrointestinal.
Objetivos: lograr una microemulsión preconcentrada conteniendo ciclosporina A con alto grado de dispersión, igual o mayor que la formulación comercial.
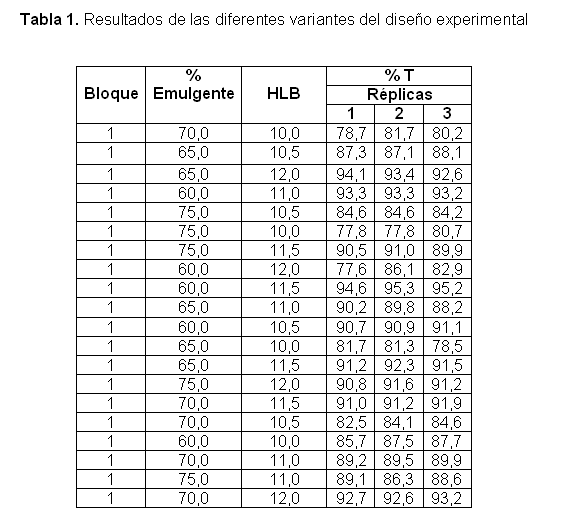
Métodos: se realizó un estudio de porcentajes de los emulgentes y el balance hidrófilo lipófilo (HLB), en los intervalos que permitieran obtener sistemas automicroemulsionables a través de un diseño factorial multinivel. Se empleó el porciento de transmitancia como variable de respuesta en la determinación del grado de dispersión de la formulación. También se realizó la evaluación de las características organolépticas de la formulación seleccionada, el estudio reológico, el conteo microbiano y la efectividad antimicrobiana.
Resultados: los factores estudiados tienen influencia significativa sobre el porcentaje de transmitancia, la formulación con mayor grado de dispersión se logró empleando un 60 % de emulgentes junto a un HLB de 11,5 con valores de transmitancia de 95,03 %, significativamente mayor que el del producto líder en formato de cápsulas blandas que fue de 84,6 %. Organolépticamente el producto cumple con las características de líquido transparente, brillante y sin partículas en suspensión, con comportamiento Newtoniano desde el punto de vista reológico. El conteo de bacterias y hongos cumplió con los requisitos establecidos en la Farmacopea de los Estados Unidos para soluciones orales.
Conclusiones: se logró una microemulsión preconcentrada de CsA en solución bebible con alto grado de dispersión, cumpliendo con los requisitos físicos y microbiológicos establecidos para este tipo de forma farmacéutica.
Palabras clave: Biodisponibilidad, Emulgente, Balance hidrófilo lipófilo, sistemas automicroemulsionables, microemulsión preconcentrada, isotropía.
ABSTRACT
Cyclosporine A (CsA), due to its immunosuppressive properties, is used in the transplantation of solid organs, bone marrow, and in some stages of certain autoimmune diseases. In Cuba, the Cyclosporine A oral solution causes gastrointestinal absorption problems.
Objectives: to achieve a pre-concentrated micro-emulsion containing highly dispersed cyclosporine A that may be equal to or higher than the one in the commercial formulation.
Methods: study of percentages of emulsifiers and of hydrophilic lipophilic balance (HLB), at some intervals that allow obtaining self-emulsifying systems through a multilevel factorial design. The percent transmittance was used as the response variable in determining the formulation dispersion degree. The evaluation of the organoleptic characteristics of the selected formulation, the rheological study, the microbial count and the antimicrobial effectiveness estimation were all performed.
Results: the studied factors have a significant influence on the transmittance percentage, the formulation with the highest degree of dispersion was achieved when using 60% of emulsifiers and an HLB of 11.5, being transmittance values of 95.03%, which were significantly higher than those of the leading product in the form of soft capsules, equal to 84.6%. Organoleptically speaking, the product meets the characteristics of a clear brilliant fluid without suspended particles and Newtonian behavior from the rheological point of view. The bacteria and fungi count met requirements of U.S. Pharmacopoeia for oral solutions.
Conclusions: a pre-concentrate highly dispersed CsA microemulsion was achieved in a drinkable solution meeting the physical requirements and microbiological criteria established for this type of dosage form.
Key words: Bioavailability, surfactant, hydrophilic-lipophilic balance, Self-Micro Emulsifying System, preconcentrate microemulsion, isotropy.
INTRODUCCIÓN
La CsA, es un polipéptido extraído del hongo Tolypocladium inflatum Gams, insoluble en agua, muy soluble en disolventes orgánicos y lípidos. 1, 2 Se emplea a nivel nacional en la terapia inmunosupresora en forma de emulsión preconcentrada en base al producto comercial Sandimmun®, que presenta una absorción incompleta, errática y muy variable de un paciente a otro, e incluso en un mismo paciente debido al metabolismo que puede ocurrir en la luz intestinal y la dependencia de la capacidad para dispersar el fármaco de las enzimas pancreáticas, de los ácidos biliares y de los efectos variables de los alimentos junto al contenido de grasa de los mismos.3,4
Uno de los mayores desafíos de la industria farmacéutica en la actualidad, es el desarrollo de estrategias para mejorar la solubilidad en agua de ingredientes farmacéuticos activos (IFAs) con pronunciadas propiedades lipofílicas, y lograr de forma exitosa formulaciones biodisponibles por vía oral.5,6
Las microemulsiones preconcentradas o sistemas automicroemulsionables (SMEDDS, de sus siglas en inglés Self-MicroEmulsifying Drug Delivery System) son unas de las estrategias más exitosas de las llamadas "técnicas de solubilización" que incrementan la velocidad de solubilización y/o el área superficial disponible favoreciendo la disolución. Los SMEDDS poseen propiedades específicas tales como, ser termodinámicamente estables, transparentes, isotrópicas, con comportamiento de fluido newtoniano, actuando de forma análoga a una solución acuosa. 7-10
Las formulación de CsA conocida como Sandimmun Neoral®, en forma de microemulsión preconcentrada, se comercializa desde 1995 en solución oral y cápsulas blandas. Esta composición, se dispersa, en medio acuoso en forma de gotículas menores de 2 000 Å en forma de microemulsión, imitando así a las micelas mixtas que se forman durante el proceso de absorción. Presenta mayor perfil de biodisponibilidad, no es dependiente de la bilis o la funcionabilidad del tracto gastrointestinal, disminuyendo la variabilidad en la absorción del fármaco intra e interpacientes que presenta la formulación tradicional. 4, 7, 10
El objetivo del presente trabajo fue lograr una formulación conteniendo ciclosporina A del tipo SMEDDS con alto grado de dispersión, igual o mayor que el producto comercial.
MÉTODOS
Materiales y reactivos
Se empleó ciclosporina A (Lugano Branch) L - 050952, monolinoleato de glicerilo (Alquimia), polioxil 40 aceite de castor hidrogenado (Andercol), etanol absoluto (Ampex Chemicals), propilenglicol (Farbe MR) y acetato de DL á tocoferol (Merck).
Preparación de las muestras
Se desarrolló un procedimiento de elaboración (figura 1) siendo el mismo para todos los ensayos tecnológicos del diseño experimental, empleándose para ello una balanza técnica Metler Toledo de 0,1 g de precisión, un electroagitador Ika, y un sistema de filtración por membrana (PTFE) de 0,8 mm. El producto se envasó en frascos de cristal color ámbar, calidad hidrolítica II, de 50 mL de capacidad, con tapones de goma de 20 mm de diámetro y sellos de aluminio.
Diseño experimental
A partir de los componentes seleccionados, teniendo en cuenta las propiedades y características de cada uno de ellos en la formulación, se aplicó un diseño factorial multinivel 11 de 20 corridas completamente aleatorizado en el cual se variaron de forma simultánea a diferentes niveles, el HLB requerido para la emulsificación en 10; 10,5; 11; 11,5 y 12 junto al nivel de emulgentes en 60, 65, 70 y 75 %.
Determinación del HLB
Para el cálculo del HLB requerido de cada formulación, se tuvieron en cuenta los HLB del emulgente lipófilo y del hidrófilo con el objetivo de aumentar la dispersión del fármaco en la formulación, se emplearon las ecuaciones siguientes:
Sistema de ecuaciones para el cálculo del HLB requerido cada formulación
a) HLBx . X + HLBy . Y = HLBr . N
b) X + Y = N
Donde:
HLBx: HLB del emulgente lipófilo (X).
HLBy: HLB del emulgente hidrófilo (Y).
HLBR: HLB requerido para la emulsificación.
X, Y: son las proporciones respectivas de emulgentes utilizados en la formulación expresadas en porcentaje.
N: nivel total de emulgente de la formulación expresado en porcentaje.
Determinación del grado de dispersión
Los ensayos del diseño experimental y el producto comercial Sandimmun Neoral® en cápsulas blandas se prepararon dispersando un 1 g de cada una en 20 mL de agua desionizada a temperatura ambiente. A las microemulsiones resultantes se les midió el porciento de transmitancia en celdas de 1 cm de paso óptico a una longitud de onda de 600 nm en un Espectrofotómetro Digital SpectronicÒ tipo Genesys tm 5, cada medición se realizó por triplicado. Una elevada transmitancia indica tamaños de gotículas reducidos, y por tanto una fina microemulsión.12
Evaluación física
Se realizó la evaluación de las características organolépticas de la formulación seleccionada y el estudio reológico. Este último se realizó en un Rotoviscosímetro: Haake RV 20, con un sistema de medición de cilindros coaxiales M5 y un sensor NV con un gradiente de velocidad comprendido entre 0 y 500 s»1 a 25 0,1 °C, este equipo está acoplado a un ordenador que utiliza el programa Rot 2.3 de la misma firma.
Control microbiológico
Se realizó la prueba de efectividad antimicrobiana y el conteo total de microorganismos según se establece en la United States Pharmacopeial Convention (USP). 33. 13 Para la prueba de efectividad antimicrobiana se realizaron siembras inmediatamente después de contaminado el producto en un medio apropiado y la concentración de microorganismos se determinó inmediatamente después de contaminado y a los 7, 14, 21 y 28 días. El conteo de hongos se realizó según el método de placa vertida, mientras que el contero de bacterias se realizó por el método de tubos múltiples 13, teniendo en cuanta los límites de 103 UFC/g para bacterias, 102 UFC/g para hongos y ausencia de microorganismos patógenos.
Análisis estadístico
Los resultados fueron analizados con la ayuda del Software Statgraphics plus Versión 5.1 1994-2000, a partir del análisis de varianza.14
RESULTADOS
En la tabla 1 se presentan los resultados de las diferentes variantes del diseño experimental. La figura 2 muestra el análisis de varianza de clasificación doble para cada factor estudiado y la interacción entre ambos para el porcentaje de transmitancia como variable respuesta, para un 95 % de confianza.
La influencia del nivel de emulgente sobre el porciento de transmitancia, se muestra en la figura 2 mediante el contraste múltiple de rangos, observándose también gráficamente.
Los resultados de la influencia del HLB sobre el porciento de transmitancia son encontrados en la figura 3 del contraste múltiple de rangos, mostrándose también gráficamente, así como la interacción entre ambas variables.
En la figura 4 se muestra el análisis de varianza y el contraste múltiple de rangos para el % de transmitancia de la variante del diseño experimental seleccionada y el Sandimmun Neoral® para un nivel de confianza del 95 %.
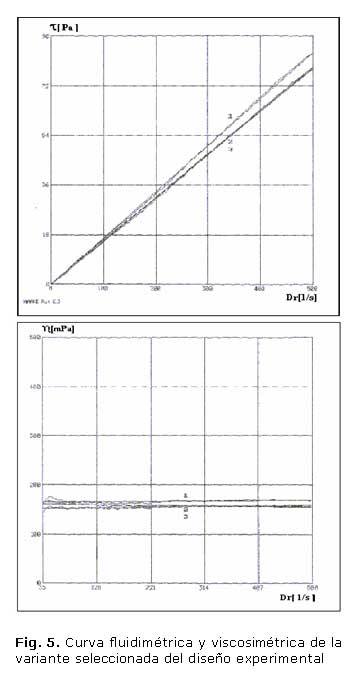
Las figura 5 muestra las curvas fluidimétrica y viscosimétrica respectivamente del estudio reológico realizado a la variante seleccionada del diseño experimental, la primera muestra la relación entre el esfuerzo de cizallamiento y el gradiente de velocidad y la segunda la viscosidad contra el gradiente de velocidad.
DISCUSIÓN
El análisis estadístico para evaluar el efecto del porciento de emulgente y el HLB requerido en el procedimiento de obtención de la microemulsión preconcentrada mostró, como se observa en la figura 2, que ambas variables, al igual que su interacción, influyen sobre el porciento de transmitancia. Esto se evidencia por los valores de probabilidad menores de 0,05.
Al analizar el contraste múltiple de rangos para el porciento de emulgente (figura 2) se observa que a medida que este aumenta, disminuye el valor de la transmitancia. El mejor resultado se logró con un 60 % de emulgentes, para un valor medio de transmitancia de 89,6 %. La menor transmitancia, con un promedio de 86,5 % corresponde al 75 % de emulgentes, siendo homogéneos los niveles intermedios, lo que se evidencia gráficamente en la figura 2.
A través de la figura 3, del contraste múltiple de rangos para el HLB requerido, se observa que todos difieren estadísticamente excepto los de HLB 11 y 12, donde la menor transmitancia con una media de 81,6 %, corresponde al HLB de 10. Lográndose el mejor resultado al emplear un HLB de 11,5 para el cual se obtiene una transmitancia de 92,1 %, lo cual se muestra gráficamente en la figura 3.
Los resultados de la figura 3, demuestran que la interacción de ambos factores es necesaria para lograr una mayor transmitancia, lo cual representa mayor dispersión, seleccionándose la formulación donde se empleó un 60 % de emulgentes, junto a un HLB de 11,5, para los que se alcanza una transmitancia de 95,03 %. Valor este superior al mejor de los resultados del análisis individual de los factores.
Según el análisis de varianza de la figura 4, se puede apreciar que existen diferencias significativas entre la formulación seleccionada del diseño experimental y el Sandimmun Neoral® respecto a la transmitancia, lo cual se evidencia por el valor de probabilidad menor de 0,05. Donde según el contraste múltiple de rangos se observa que la formulación comercial tiene una transmitancia inferior 10,4 veces, con una media de 84,63 % respecto a la formulación desarrollada. (figura 4).
Organolépticamente el producto cumplió con las características establecidas para este tipo de forma farmacéutica al ser un líquido transparente, brillante y sin partículas en suspensión.
Con un tiempo de corrida de dos minutos, el equipo utilizado, pudo graficar el comportamiento del tipo de flujo que presentaba el producto, corroborando que este cumple con la característica de fluido Newtoniano, ya que existe una proporcionalidad directa entre el esfuerzo de cizallamiento y el gradiente de velocidad, siendo la relación entre estos constante, representándose como una línea recta, donde para cualquier gradiente de velocidad la viscosidad es la misma. Esta viscosidad resultó ser de 160 mPa.s como promedio. (figura 5)
Después de 28 días el conteo de microorganismos arrojó que la formulación se encontraba por debajo de los límites máximos permisibles según USP 33. Estos resultados se atribuyen a la ausencia de agua en la formulación, además de la elevada densidad propia de la formulación, la cual le imparte una presión osmótica al sistema, que no permite el desarrollo microbiano.
Se puede concluir que se logró una microemulsión preconcentrada de CsA, que exhibe un alto grado de dispersión, incluso mayor que el producto comercial al obtenerse valores de transmitancia significativamente superiores cuando se emplea un HLB de 11,5 y un 60 % de emulgentes. La formulación desarrollada cumple con los requisitos físicos y microbiológicos establecidos para este tipo de forma farmacéutica.
REFERENCIAS BIBLIOGRÁFICAS
1. Soy D, Brunet M, Roca M, Codina C, Marino E. L, Ribas J. Importancia clínica de los metabolitos de ciclosporina A (CsA) en transplantes de órganos. Determinación analítica por cromatografía líquida de alta eficacia. Farm Hos 1995; 19 (3): 155-160.
2. Faulds D, Goa K, Benfield P. Cyclosporin: a review of its pharmacodynamic and pharmacokinetic properties, and therapeutic use in immunoregulatory disorders. Drugs 1993; 45: 953-1040.
3. Formulario Nacional de Medicamentos. Cuba: Ministerio de Salud Pública Ediciones Espiral Eterna. Ciudad de La Habana. 2003. Fecha de acceso: 20: de febrero de 2011. Disponible en: http://www.dmsgbc.sld.cu/formulario/formulario.htm.
4. Bernard CS, inventor. Solid Pharmaceutical compositions comprising a cyclosporine and an anionic surfactant. United States patent US. 6,197,335 B1. 2001.
5. El-Badry M, Fetih G, Fathy M. Improvement of solubility and dissolution rate of indomethacin by solid dispersions in Gelucire 50/13 and PEG 4000. Saudi Pharmaceutical Journal 2009;17:217-25.
6. Karanth H, Shenoy VS, Murthy RR. Industrially feasible alternative approaches in the manufacture of solid dispersions: a technical report. AAPS PharmSciTech 2006;7(4):87.
7. Garrige Jean- Sebastian. Les sistémes auto-emulsionnansts pour l´administration orale de principies actifs lipofhiles : Influence de la formulation sur les aspects biopharmaceutiques. Thése d` État de Docteur en Pharmacie. Unite de formation et recherche. Faculte de Pharmacie de Chatenay- Malabry. Universite de Paris XI. Diciembre 2002. 120 p.
8. N. H. Shah, W. N. Carvajal, C. I. Patel, and M. H. Infeld. Self-emulsifying drug delivery systems (SMEDDS) with polyglycolyzed glycerides for improving in vitro dissolution and oral absorption of lipophilic drugs. Int J Pharm 1994; 106: 15-23.
9. P. P. Constantinides. Lipid microemulsions for improving drug dissolution and oral absorption: physical and biopharmaceutical aspects. Pharm Res 1995, 12: 1561-1572.
10. Medeiros M, Gómez A, Urizar J, Campos-Sepúlveda A, Saldaña I, Ramírez L, et al. Bioavailavility of two oral formulations of cyclosporin in uremic children before renal transplantation. Pediatr Transplantation 1998; 2: 145-9.
11. De Muth J.E. Basic statistics and Pharmaceutical statistical applications. Marcel Dekker Inc. NY. EUA, 1999.
12. Bernard CS, inventor. Emulsion preconcentrate comprising a cyplosporin, propylene carbonate, and glycerides. United States patent US 6,159,933A. 2000.
13. USP 33 NF 28 United States Pharmacopeia. Versión electrónica. 2010. Disponible en: http://www.uspnf.com/uspnf/login . Fecha de acceso: 20 de febrero de 2011.
14. Ferrán M. SPSS análisis estadístico. Mc. Graw Hill. España, 2001.
Recibido: 12 de septiembre de 2012.
Aprobado: 6 de noviembre de 2012.
MSc. Suslebys Salomón Izquierdo
Centro de Investigación y Desarrollo de Medicamentos (CIDEM). La Habana, Cuba. E-mail: suslebyssi@infomed.sld.cu