My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Farmacia
Print version ISSN 0034-7515
Rev Cubana Farm vol.48 no.1 Ciudad de la Habana Jan.-Mar. 2014
ARTÍCULO ORIGINAL
Estandarización de un método por HPLC para cuantificar diclofenaco en muestras de microdiálisis mediante fotoderivatización precolumna
Standardization of a HPLC method for quantitation of diclofenac in microdialysis samples through precolumn photoderivatization
MSc. Omar de Jesús Correa Cano, DraC. Adriana María Ruiz Correa, MSc. Margarita María Restrepo Garay
Universidad de Antioquia. Medellín, Colombia.
RESUMEN
Introducción: la cuantificación del diclofenaco en muestras de pequeño volumen y baja concentración de analito es compleja y requiere de un método analítico sencillo, altamente sensible y reproducible.
Objetivo: estandarizar un método por cromatografía líquida de alta resolución (HPLC) con fotoderivatización precolumna, para cuantificar diclofenaco en muestras de pequeño volumen y baja concentración de analito.
Métodos: se obtuvieron los fotoproductos del diclofenaco mediante irradiación de muestras a l= 254 nm en celdas de cuarzo, politetrafluoroetileno (PTFE) y polivinilcloruro (PVC), colocadas en diferentes posiciones del área de irradiación durante 6, 24 y 60 min respectivamente. Para la separación de los fotoproductos se utilizó una columna C-18 Agilent Eclipse Plus (5 µm; 150 mm; 4,6 µm id.), usando como fase móvil acetonitrilo (ACN): agua, acidulada con ácido fosfórico hasta pH= 3,0 en diferentes proporciones hasta encontrar la óptima; la temperatura empleada fue de 30 °C, el flujo de 1 mL/min y el volumen de inyección de 20 µL. Se detectaron los fotoproductos por fluorescencia a lambas de excitación y emisión de 286 y 360 nm respectivamente.
Resultados: la fotodegradación del diclofenaco en celdas de PTFE ocurrió en 6 min cuando se irradiaron soluciones a 254 nm en el centro del área de irradiación. La separación de los tres fotoproductos principales se logró utilizando una fase móvil ACN: agua, acidulada con ácido fosfórico hasta pH= 3,0; 65:35. El fotoproducto que eluye a 3,4 min se produjo en concentraciones altas y estables las cuales presentaron una tendencia lineal en un gráfico de respuesta del equipo (área) vs. concentración de diclofenaco en un rango entre 1,25-500 ng/mL.
Conclusiones: se logró estandarizar un método por HPLC para la cuantificación de diclofenaco presente en muestras de pequeño volumen y baja concentración, el cual podrá someterse a proceso de validación.
Palabras clave: PTFE, diclofenaco, fluorescencia, HPLC, microdiálisis.
ABSTRACT
Introduction: the diclofenac quantitation in small volume and low analyte concentration samples is complex and requires a simple, highly sensitive and reproducible analytical method.
Objective: to standardize a high performance liquid chromatography with precolumn photoderivatization to quantitate diclofenac in small volume and low analyte concentration samples.
Methods: diclofenac photoproducts were obtained by irradiating samples at l= 254 nm in quartz polytetrafluoroethylene (PTFE) and polyvinyl chloride (PVC) cells placed in different positions of the irradiation area for 6, 24 and 60 minutes respectively. For the separation of photoproducts, a C-18 Agilent Eclipse Plus column (5 µm, 150 mm; 4.6 µm id.) was used, with a mobile phase containing a mixture of acetonitrile and water pH 3.0 adjusted with ortho-phosphoric acid, in different proportions until the optimal one was found; the flow rate of mobile phase was 1.0 mL/min with column temperature of 30 °C. The sample injection volume was 20 µL. Photoproducts were detected through fluorescence with excitation and emission wavelength at 286 and 360 nm respectively.
Results: diclofenac photodegradation in PTFE cells occurs within 6 minutes when solutions are irradiated at 254 nm in the central part of the irradiation area. The separation of the three major photoproducts was accomplished using a mobile phase of acetonitrile: water adjusted with ortho-phosphoric up to pH= 3.0;65:35. The photoproduct at 3.4 minutes was eluted at high stable concentrations, with a linear trend presented in an area graph versus diclofenac concentration in the range of 1.25-500 ng/mL.
Conclusions: a new HPLC-method for quantitation of diclofenac in small volume and low concentration samples was standardized; it may undergo validation process.
Key words: PTFE, diclofenac, fluorescence, HPLC, microdialysis.
INTRODUCCIÓN
El diclofenaco es un fármaco perteneciente al grupo de los antiinflamatorios no esteroideos (AINE),1-3 utilizado ampliamente a nivel mundial como analgésico, antirreumático y antiartrítico. Este medicamento se utiliza por vía oral, parenteral y tópica. Para esta última vía de administración se comercializan geles de diclofenaco que se aplican sobre la piel con el propósito de disminuir el dolor y la inflamación en casos de lesiones traumáticas musculares y de las articulaciones. El diclofenaco en forma de gel para ejercer su acción debe absorberse a través de la piel; el seguimiento de este proceso puede realizarse tomando muestras en el sitio de administración y determinando la cantidad de principio activo absorbido. La obtención de este tipo de muestras puede hacerse por diferentes métodos entre los que se encuentra la microdiálisis. Esta técnica proporciona volúmenes pequeños de muestra que representan un reto en el desarrollo de un método de cuantificación adecuado.
La concentración de diclofenaco presente en muestras de fluidos biológicos puede cuantificarse por HPLC utilizando diferentes detectores como ultravioleta (UV), masas (MS) y fluorescencia.2,4-9 Sin embargo, los métodos de determinación por UV permiten límites de cuantificación superiores a 10 ng/mL,4,7,9 mientras que por masas se han logrado límites de 1 ng/mL.4 Aunque los límites de cuantificación con detectores UV son aceptables no son adecuados para el trabajo con los volúmenes de muestra que se obtienen por microdiálisis (aproximadamente 100 µL) en las cuales, posiblemente, la cantidad de diclofenaco esté por debajo de los 10 ng/mL. En el caso de los detectores de masas, que ofrecen un límite más bajo, la limitante es los procesos necesarios para la limpieza de la muestra antes de la inyección.
El diclofenaco es una molécula fotolábil cuyos mecanismos de degradación han sido estudiados principalmente en el área ambiental, pues se ha encontrado diclofenaco como contaminante en fuentes de agua y en aguas negras, provenientes del alcantarillado y plantas de tratamiento de aguas.3,10,11 Como consecuencia de su fotodegradación se generan productos fluorescentes,5,6 propiedad que ha sido utilizada por algunos investigadores para realizar cuantificaciones indirectas del diclofenaco por diferentes métodos analíticos.1-3,5,12,13 La irradiación de diclofenaco con luz ultravioleta (LUV) en medio acuoso, produce una pérdida secuencial de los dos cloros con cierre de anillo, para formar inicialmente el derivado ácido 8-clorocarbazol-1-acético, el cual, al continuar recibiendo radiación, se convierte en el producto mayoritario ácido carbazol-1-acético.3,10,14 Adicionalmente, se forman otros derivados minoritarios.2,3,10,14,15 Si el pH de la solución es 2 o menor, el diclofenaco puede formar una cetona que afecta su cuantificación.16 El objetivo de este trabajo es estandarizar un método analítico que permita cuantificar el diclofenaco presente en muestras de bajo volumen (2-100 µL) y baja concentración de analito,4 utilizando la propiedad fluorescente de sus productos de fotodegradación dado que los detectores de fluorescencia también permiten obtener límites de cuantificación alrededor de 1 ng/mL.5
MÉTODOS
REACTIVOS
Sustancia de referencia química de diclofenaco sódico, lote HOB150 (USP, Rockville, EE. UU.); solución de cloruro de sodio 0,9 % (SS), lote S080107-E (Corpaúl, Medellín, Colombia); ácido ortofosfórico al 85 %, lote 8L010188N (Carlo Erba, Milán, Italia); acetonitrilo (ACN), lote I373830 728 y metanol, lote K37008407 711 ambos grado HPLC (Merck, Darmstadt, Alemania); agua grado HPLC, obtenida de un equipo purificador de agua milliQ plus (Bedford, EE. UU.).
MOTORREACTORES
Capilares de poli-tetra-fluoro-etileno- PTFE, 7 cm de longitud x 1,58 mm d.i., con capacidad de 140 µL (Tygon, Paris, Francia); celdas de cuarzo, paso de luz 1 cm (Starna, CA, USA). Jeringas de PVC de 1 mL (Bencton Dickinson, Melbourne Victoria, Australia).
EQUIPOS
Cromatógrafo Agilent (HewLett Packard 1100, Waldbronn, Germany), con bomba cuaternaria G1310A, detector UV/Vis G1314A, detector de fluorescencia FL2000, inyector manual Rheodyne (loop 20 µL) 1328A, desgasificador en línea G1322A, horno para columna G1316A a 30 °C. La separación se realizó en una columna C-18 Agilent Eclipse plus (5 µm; 150 mm; 4,6 µm i.d.), utilizando como fase móvil ACN:agua a pH 3,0, ajustado con ácido fosfórico, 60:40. La detección del diclofenaco se efectuó con el detector de UV a una longitud de onda de 280 nm y la de los fotoproductos con el detector de fluorescencia a longitudes de onda de excitación y emisión de 286 y 360 nm, respectivamente, a una velocidad de flujo constante de 1 mL/min, a temperatura de 25 ºC; cámara de irradiación: UVPV vue cabinet, modelo C-65 (UVP, Upland, EE. UU.), con portalámpara UV, modelo UVLMS-38 (UVP, Upland, EE. UU.) y lámpara UV G875, 8 W, 115 V, 60 Hz, 0.16 AMPS (Sankyo, Sayama, Japón).
ESTANDARIZACIÓN
Solución de trabajo. Se preparó una solución de 128 ng/mL de diclofenaco en solución salina 0,9 % (SS) con 1 % de metanol.
Establecimiento de las condiciones cromatográficas. La solución de trabajo se inyectó en el cromatógrafo; la composición de la fase móvil ACN: agua a pH= 3,0 se varió gradualmente desde 80:20 hasta 60:40. Una vez establecidas las condiciones iniciales para lograr la retención del diclofenaco sobre la columna, se procedió a degradar la muestra, para lo cual la celda de cuarzo se llenó con solución de trabajo y se sometió a irradiación con luz ultravioleta a 250 nm.
Degradación del diclofenaco en diferentes materiales. Para evaluar el efecto del material utilizado para contener la muestra durante la irradiación sobre la producción de los fotoproductos, se utilizaron celdas de cuarzo, PVC y capilares de PTFE. La solución en cada material se sometió a diferentes tiempos de irradiación, hasta un tiempo máximo de 60 min. Las soluciones irradiadas se inyectaron en el cromatógrafo y con los datos obtenidos se elaboraron gráficos área vs. tiempo de irradiación para el diclofenaco y los tres fotoproductos principales, en cada material. El material para realizar las irradiaciones se seleccionó de acuerdo con la información que proporcionó este ensayo.
Determinación del tiempo de irradiación y del pico a utilizar para la cuantificación del diclofenaco. Se llenaron celdas del material seleccionado en el punto anterior con solución de trabajo y se irradiaron, según el material: cuarzo, 6 min; PTFE, 24 min; PVC, 60 min. Se elaboraron los gráficos área vs. tiempo de irradiación para el diclofenaco y los tres fotoproductos principales para cada material. El tiempo de irradiación y el fotoproducto más indicado para realizar la cuantificación indirecta del diclofenaco se establecieron de acuerdo con los resultados de este ensayo.
Efecto de la posición de irradiación de la muestra en la cámara sobre la reproducibilidad del cromatograma. Se irradiaron cinco muestras de solución de trabajo, colocando las celdas a lo largo de los 32 cm de la zona de irradiación. Entre celda y celda, se dejó una distancia constante.
Se hizo una segunda evaluación, irradiando otras cinco muestras de manera individual, colocando la celda en el centro del área de irradiación. Las áreas obtenidas en los cromatogramas para el fotoproducto seleccionado, en cada ensayo se promediaron y se calculó la desviación estándar y el coeficiente de variación. Se eligió el modelo de irradiación que permitió obtener menor variabilidad. Después de realizar el análisis de los resultados de estos ensayos se establecieron las condiciones cromatográficas y de degradación del diclofenaco.
Prueba preliminar de linealidad. Se preparó una solución stock de 1 000 ng/mL de diclofenaco en SS.
Soluciones para la determinación del rango lineal de concentración. Teniendo en cuenta las concentraciones de diclofenaco encontradas en líquidos biológicos periféricos, después de una administración de este principio activo por otras vías diferentes a la dérmica, por autores como Mayer,4 Roskar,7 Siu,8 Swachuk9 y Bender,17 se decidió evaluar un rango de concentración comprendido entre 1,25 y 2 400 ng/mL. A partir de la solución stock, se prepararon patrones de 1,5; 3,1; 6.3; 12,5; 25,0; 50,0; 100,0; 200,0; 400,0; 800,0; 1 600,0 y 2 400,0 ng/mL, por dilución con SS y adición de metanol en cantidad suficiente para alcanzar una concentración del 1 %. Una vez obtenidos los patrones, se filtraron y se mantuvieron en tubos de ensayo tapados a temperatura ambiente y protegidos de la luz hasta el momento de la irradiación y análisis.
Determinación del rango lineal de concentración. Se irradiaron alrededor de 140 µL de cada solución a 254 nm durante 10 min y se inyectaron en el cromatógrafo. Con los datos obtenidos, se construyó una curva (concentración vs. área del pico); por inspección visual se determinó el rango lineal de concentración que posteriormente fue analizado por regresión lineal.
RESULTADOS Y DISCUSIÓN
La fotodegradación de las soluciones de diclofenaco se realizó eficientemente en celdas de diferentes materiales como cuarzo, PTFE y PVC, irradiando la muestra a 254 nm en el centro del área de irradiación. El tiempo de irradiación para degradar el diclofenaco presente en la solución varió con cada material: 3,5 min para el cuarzo y de 6 y 15 min para el PTFE y el PVC.
La separación de los tres fotoproductos principales se logró utilizando una columna C-18 Agilent Eclipse Plus con una fase móvil ACN: agua, acidulada con ácido fosfórico hasta pH= 3,0; 65:35. Su detección se realizó por medio de un detector de fluorescencia con una lambda de excitación de 286 nm y emisión de 360 nm.
El fotoproducto que eluye a 3,4 min se produjo en concentraciones altas y estables las cuales presentan una tendencia lineal en un gráfico de respuesta del equipo (área) vs. concentración de diclofenaco en un rango entre 1,25-500 ng/mL. En el cuadro se presentan los datos obtenidos durante el proceso de estandarización.
Establecimiento de las condiciones cromatográficas. Las condiciones cromatográficas iniciales para lograr la retención del diclofenaco en la columna C18 se establecieron teniendo en cuenta que esta molécula es un ácido débil con un pKa de 4,0; por esta razón se seleccionó una fase móvil con agua acidificada a pH 3,0, en el que el diclofenaco se encuentra parcialmente ionizado. No se disminuyó más el pH debido a que el diclofenaco según Reddersen y Heberer16 es inestable a estos valores de pH, formando una cetona y además, para evitar daños en la columna.
La variación de la composición de la fase móvil de 80:20 a 60:40 produjo un aumento en el tiempo de retención del diclofenaco y se encontró un valor aceptable de 5,427 min con la proporción 60:40. En la figura 1 se muestran los cromatogramas correspondientes a la inyección de solución salina (blanco) y de la solución de trabajo de diclofenaco.
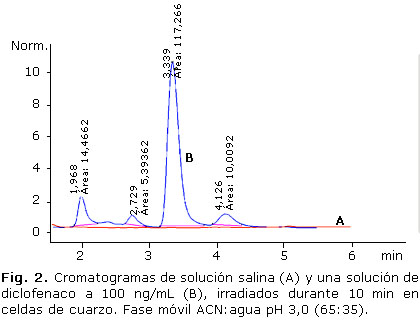
A pesar de que con la composición de fase móvil se logró una separación adecuada de los fotoproductos obtenidos después de la irradiación de la solución de trabajo de diclofenaco en una celda de cuarzo y que con dicha fase móvil se desarrollaron los estudios de fotodegradación, al final se decidió seguir variando la proporción con el objeto de optimizar más el tiempo de corrida, para el proceso de validación, alcanzando una separación óptima con una proporción de fase móvil 65:35, con la cual los tiempos de retención (TR) de los tres fotoproductos variaron a 2,0; 2,5 y 3,2 min. Esta es la razón por la cual los estudios de fotodegradación se presentan con tiempos de retención de 2,7; 3,4 y 4,1 min, mientras que los TR 2,0; 2,5 y 3,2 min se utilizarán para el proceso de validación. En la figura 2, se muestran los cromatogramas de una inyección de solución salina (blanco) y de la solución de trabajo de diclofenaco irradiados como se describió en la parte experimental.
En el cromatograma de la figura 2 (B) se observan los tres fotoproductos principales. De estos se presume que uno corresponde al ácido 8-cloro carbazol-1-acético (TR= 2,7 min), basados en los trabajos de fotodescomposición informados en la literatura3,10,15 en degradaciones tanto con luz solar como ultravioleta. Es posible que otro de los picos corresponda al ácido carbazol-1-acético TR= 3,4 min). Esta sustancia fue encontrada por Poiger y otros3 y Encinas y otros2 en fotodegradaciones de soluciones de diclofenaco en presencia de metanol; y por Koutsouba y otros10 y Encinas y otros2 en soluciones acuosas de diclofenaco irradiadas con luz ultravioleta. En el tratamiento que se da a las muestras en este estudio se utilizan ambas condiciones, metanol (1 %) y descomposición con luz ultravioleta, lo que soporta esta presunción. En relación al tercer pico (TR= 4,1 min), es poco probable que se trate del 8-hidroxicarbazol 1-acético puesto que en todos los estudios, este producto de degradación se forma en la ausencia de metanol; sin embargo, podría tratarse del derivado aldehído o alcohol del carbazol-1-acético. Estos compuestos fueron encontrados por Encinas y otros2 al irradiar una solución metanólica de diclofenaco. No obstante, para confirmar estas presunciones se requiere de estudios adicionales que no están dentro de los objetivos de este trabajo.
Degradación del diclofenaco en diferentes materiales. Los resultados de este ensayo se presentan en la figura 3. En las celdas de cuarzo, el diclofenaco se degradó prácticamente a los 3,5 min, mientras que en las de PTFE y PVC se encontraron concentraciones de este principio activo a los 6 y 15 min después de la irradiación. La fotodegradación en los tres materiales fue similar en cuanto a los fotoproductos formados; las diferencias se presentaron en el tiempo de aparición y desaparición de los fotoproductos durante la irradiación de las muestras.
En los tres materiales, se observó un retardo en la aparición de los fotoproductos con tiempos de retención de 3,4 y 4,1 min, mientras que el fotoproducto con tiempo de retención de 2,7 min, apareció inmediatamente después del inicio de la irradiación. El pico con TR de 3,4 min fue el que mostró las mayores áreas en todos los casos. La mayor área obtenida para este compuesto puede explicarse por la lambda seleccionada para la emisión, la cual es específica para el ácido carbazol 1-acético y/o por las condiciones utilizadas durante las irradiaciones.
Los resultados mostraron, además, que en las celdas de PVC, el tiempo de aparición de los fotoproductos es muy prolongado, mientras que en PTFE este tiempo es intermedio y en cuarzo es muy corto. En PTFE también se observó que el pico con tiempo de retención de 3,4 min mantiene concentraciones "estables" durante varios minutos.
Además su rápida degradación, el PTFE ofrece otras ventajas que permitieron seleccionarlo como material de la celda de irradiación, entre las que se encuentran similitud al cuarzo en cuanto a su transparencia a la LUV, la resistencia a esta radiación posibilita su reutilización, por ser un capilar puede contener volúmenes muy pequeños sin requerir tapa en los extremos, su fácil manipulación y el poco espacio que ocupa.
Determinación del tiempo de irradiación y del pico a utilizar para la cuantificación del diclofenaco. En la figura 3 (B) se muestran las curvas área-tiempo obtenidas para el diclofenaco y sus tres fotoproductos principales en celdas de PTFE. Se observa una caída exponencial del diclofenaco y un crecimiento en las concentraciones de los tres fotoproductos y decrecimiento de la concentración de dos de ellos (TR= 2,7 y TR= 3,4 min).
Las áreas mayores fueron para el pico con TR= 3,4 min, y la estabilidad observada durante la irradiación después de alcanzar el máximo de formación, permitió seleccionarlo como pico de referencia para la cuantificación indirecta del diclofenaco (Fig. 3) (B). Se estableció como tiempo óptimo de irradiación 10 min, ya que a este tiempo se alcanza el máximo de formación del pico de interés. Este tiempo concuerda con el utilizado por Encinas y otros2 en sus estudios de irradiación.
Efecto de la posición de irradiación de la muestra sobre la reproducibilidad del cromatograma. Los valores de áreas obtenidos para cada una de las soluciones irradiadas en celdas ubicadas a lo largo del área de irradiación (posiciones 1, 2, 3, 4 y 5) y en un sitio fijo del área de irradiación (posición 3), mostraron que la fotodegradación de las muestras es más variable cuando estas se ubican en sitios diversos a lo largo del área de irradiación, lo que genera desviación estándar y coeficiente de variación mayores que cuando las celdas se colocan en el centro de la zona de irradiación. Estos resultados indican que es muy probable que la intensidad de emisión de luz en la lámpara varíe a lo largo de ella.
Prueba preliminar de linealidad. Con las condiciones establecidas para el método se evaluó la relación entre la concentración del diclofenaco en las muestras a irradiar y el área obtenida para el pico de 3,4 min. En un rango de concentraciones entre 1,25-2 400 ng/mL, los resultados muestran una pérdida evidente de la linealidad a concentraciones mayores de 406 ng/mL; sin embargo, los datos comprendidos entre 1,586 y 406 ng/mL mostraron una relación lineal entre la concentración y el área. Para verificar el resultado anterior se elaboró una curva adicional ajustando el rango de concentración entre 1,25-500 ng/mL. Esta última curva se sometió a análisis de regresión lineal y se obtuvo un coeficiente de regresión de 0,9999, que demuestra la tendencia lineal de los datos. Este rango de concentraciones se seleccionó como rango de trabajo para el proceso posterior de validación del método.
Finalmente, se logró estandarizar un método por HPLC para la cuantificación de diclofenaco presente en muestras de pequeño volumen y baja concentración, el cual se someterá a proceso de validación.
REFERENCIAS BIBLIOGRÁFICAS
1. Ravina M, Campanella L, Kiwi J. Accelerated mineralization of the drug diclofenc via fenton reactions in a concentric photo-reactor. Water Res. 2002;36(14):3553-60.
2. Encinas S, Bosca F, Miranda MA. Phototoxicity Associated with Diclofenac: A Photophysical, Photochemical, and Photobiological Study on the Drug and Its Photoproducts. Chem Res Toxicol. 1998;11(8):946-52.
3. Poiger T, Buser HR, Muller MD. Photodegradation of the pharmaceutical drug diclofenac in a lake: pathway, field measurements, and mathematical modeling. Environ Toxicol Chem. 2001;20(2):256-63.
4. Mayer BX, Namiranian K, Dehghanyar P, Stroh R, Mascher H, Muller M. Comparison of UV and tandem mass spectrometric detection for the high-performance liquid chromatographic determination of diclofenac in microdialysis samples. J Pharm Biomed Anal. 2003;33:745-54.
5. Kuhlmann O, Krauss GJ. Crocheted ETFE-reactor for on-line post-column photoderivatization of diclofenac in high-performance liquid chromatography. J Pharm Biomed Anal. 1997;16(4):553-9.
6. Wiese B, Hermansson J. Bioanalysis of diclofenac as its fluorescent carbazole acetic acid derivative by a post-column photoderivatization high-performance liquid chromatographic method. J Chromatogr. 1991;567(1):175-83.
7. Roskar R, Kmetec V. Liquid Chromatographic determination of diclofenac in human synovial fluid. J Chromatogr B Analyt Technol Biomed Life Sci. 2003;788(1):57-64.
8. Siu SSN, Yeung JHK, Lau TK. A study on placental transfer of diclofenac in first trimester of human pregnancy. Human Reproduction. 2000;15(11):2423-25.
9. Sawchuk RJ, Maloney JA, Cartier LL, Rackley RJ, Chan KKH, Lau HSL. Analysis of diclofenac and four of its metabolites in human urine by HPLC. Pharm Res. 1995;12(5):756-62.
10. Koutsouba P, Dasenakis M, Hiskia A, Tsipi D. Photochemical studies of the anti-inflammatory drug diclofenac in aqueous solutions. 7th International Conference on Environmental Science and Technology Ermoupolis, Syros Island, Greece. Sept. 2001.
11. Buser HR, Poiger T, Muller MD. Occurrence and Fate of the Pharmaceutical Drug Diclofenac in Surface Waters: Rapid Photodegradation in a Lake. Environ Sci Technol. 1998;32(22):3449-56.
12. Lores M, García CM, Cela R. Selectable-power photoreactor for flow-injection analysis systems and high-performance liquid chromatography post-column phohotochemical derivatization. J Chromatogr A. 1996;724:55-65.
13. González S, Muller J, Petrovic M, Barceló D, Knepper TP. Biodegradation studies of selected priority acidic pesticides and diclofenac in different bioreactors. Environ Pol. 2006;144(3):926-32.
14. Moore DE, Roberts-Thomson S, Zhen D, Duke CC. Photochemical studies on the anti-inflammatory drug diclofenac. Photochem Photobiol. 1990;52(4):685-90.
15. Aguera A, Pérez LA, Ferrer I, Thurman EM, Malato S, Fernández-Alba AR. Application of time-of-ligth mass spectrometry to the analysis of phototransformation products of diclofenac in water under natural sunligth. J Mass Spectrom. 2005;40:908-15.
16. Reddersen K, Heberer TH. Formation of an artifact of diclofenac during acidic extraction of environmental water samples. J Chromatogr A. 2003;1011(1-2):221-6.
17. Bender T, Scahfer M, Bariska J. Tissue concentration o the active substance of voltaren SR 75 in articular cartilage, synovial membrane and bone. Clin Reumatol. 2000;19:89-91.
Recibido: 16 de septiembre de 2013.
Aprobado: 30 de octubre de 2013.
Omar de Jesús Correa Cano. Universidad de Antioquia. Carrera 67 No. 53-108. Medellín, Colombia. Correo electrónico: ocorrea565@yahoo.com