My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Medicina
Print version ISSN 0034-7523
Rev cubana med vol.53 no.4 Ciudad de la Habana Sept.-Dec. 2014
TRABAJO ORIGINAL
Fracción de excreción de magnesio y estado del túbulo-intersticio en pacientes nefróticos
Fractional excretion of magnesium and status of tubulointerstitium in nephrotic patients
Dr. Raymed Antonio Bacallao Méndez, Dr. Genmer Humberto Espinoza Sandoval, Dra. Laura López Marín, Dr. Reinaldo Mañalich Comas, Dr. Francisco Gutiérrez García, Lic. Inés María Roig Duarte, Dra. Betsy Llerena Ferrer
Instituto de Nefrología "Dr. Abelardo Buch López". La Habana, Cuba.
RESUMEN
Introducción: la fracción de excreción de los electrólitos puede constituir un marcador temprano de daño renal en las glomerulopatías.
Objetivo: identificar la posible relación existente entre variables clínicas, fracción de excreción de magnesio y estado del túbulo-intersticio, en pacientes con proteinuria nefrótica a los que se les realizó biopsia renal en el Instituto de Nefrología entre abril de 2012 y junio de 2013.
Métodos: se realizó un estudio observacional analítico, transversal, en el que se excluyeron los pacientes con factores que modificaran la fracción de excreción de magnesio. A los 40 pacientes incluidos en el estudio se les recogieron datos antropométricos, demográficos y clínicos, se les midió la fracción de excreción de magnesio, se les practicó biopsia renal y se les cuantificó el porcentaje de fibrosis con el programa Image J. La información fue procesada mediante el paquete estadístico SPSS 15.0. Se utilizó la técnica estadística de análisis de distribución de frecuencias, en las variables cuantitativas se calcularon estadígrafos descriptivos. Fueron empleados los tests de Wilcoxon, de Kruskal Wallis y el coeficiente de correlación de Spearman's-rho, en las pruebas de hipótesis.
Resultados: se encontró correlación estadísticamente significativa de la fibrosis intersticial con la fracción de excreción de magnesio (rsp= 0,37, p= 0,02) y con la tasa de filtración glomerular (rsp= -0,56, p= 0,00). No fue encontrada asociación de la fracción de excreción de magnesio con el empleo de medicamentos, ni con el antecedente de hipertensión arterial.
Conclusión: la fibrosis intersticial se relaciona con la fracción de excreción de magnesio y con la tasa de filtración glomerular en pacientes con proteinuria nefrótica.
Palabras clave: fracción de excreción de magnesio, fibrosis túbulo-intersticial renal, síndrome nefrótico, tasa de filtración glomerular.
ABSTRACT
Introduction: fractional excretion of electrolytes can be used as an early marker of renal damage in glomerulopathies.
Objective: to identify the possible relationship between some clinical variables, the fractional excretion of magnesium and the tubulointerstitial status in patients with nephrotic proteinuria assisted at The National Institute of Nephrology from April 2012 to June 2013.
Methods: an observational analytical study was conducted. Patients with conditions that modify the fractional excretion of magnesium were excluded. 40 patients were included in this study at the Institute of Nephrology from April 2012 until June 2013, and their demographic, anthropometric and clinical data were collected; the fractional excretion of magnesium was measured as well. Renal biopsies were practiced to all patients and the percent of fibrosis was measured with the aid of image J program. Data were processed with Statistical package for Social Science (SPSS) version 15.0. The statistical technique of frequency distribution analysis was used; quantitative variables descriptive statistics were calculated. Wilcoxon tests, Kruskal Wallis and correlation coefficient Spearman's- rho were used in hypothesis tests.
Results: the percent of interstitial fibrosis was related to fractional excretion of magnesium (rsp= 0,37, p= 0,02) and glomerular filtration rate (rsp= -0,56, p= 0,00). No association of the fractional excretion of magnesium with the use of drugs or with history of hypertension was found.
Conclusions: tubulointerstitial fibrosis is related to the fractional excretion of magnesium and glomerular filtration rate in patients with nephrotic proteinuria.
Key words: fractional excretion of magnesium, tubulointerstitial fibrosis, nephrotic syndrome, glomerular filtration rate.
INTRODUCCIÓN
Todas las enfermedades renales crónicas se caracterizan por el desarrollo de fibrosis intersticial, la que contribuye al deterioro de la función renal.1,2 Por esta razón, la valoración de fibrosis intersticial se usa ampliamente como parte de la evaluación de las biopsias renales.3
Hay acuerdo general, entre nefrólogos, de que la fibrosis túbulo-intersticial (FTI) es un fuerte predictor de la evolución clínica de las enfermedades renales.4 Si se toma en consideración la gran importancia de la relación estructura-función que existe en la evolución clínica del síndrome nefrótico, o sea peor evolución en aquellos sujetos con mayor grado de FTI; la determinación de la función tubular a través de la fracción de excreción (FE) de solutos representa un prometedor acercamiento en el diagnóstico no invasivo, para ayudar a diferenciar al paciente nefrótico con FTI o sin ella.
La magnitud del trastorno en la FE de Mg2+ (FEMg) está relacionada con el grado de afectación del túbulo-intersticio, según Futrakul y otros, quienes encontraron que de 5 fracciones de excreción de solutos, la FEMg aparecía como el indicador más sensible para identificar las lesiones iniciales de FTI, en pacientes pediátricos afectos de síndrome nefrótico; ellos hallaron una relación lineal entre la magnitud de la FEMg y la intensidad de la FTI. Este estudio aporta evidencias de la relación estructura-función, utilizando como marcador funcional la FEMg.5
Como antes esbozamos, las alteraciones del túbulo-intersticio se han reconocido como determinantes de la severidad y evolución clínica de la enfermedades glomerulares,6 sin embargo, para obtener tal precisión diagnóstica se depende del estudio histopatológico que, en muchas ocasiones, no es posible realizar. Por otra parte, el estudio de la función renal, que en la mayoría de las ocasiones se basa en la determinación de la concentración de creatinina sérica o del aclaramiento de creatinina, refleja las modificaciones en la función glomerular principalmente, de modo que tiene escaso valor para determinar el daño en la estructura del túbulo-intersticio, pues sus modificaciones son tardías (pobre sensibilidad). Ello es consecuencia de la hiperfiltración de las nefronas remanentes que se da en las diferentes enfermedades renales.7
La FEMg es dependiente de 2 mecanismos cruciales: la capacidad de la célula tubular de reabsorber el magnesio del filtrado glomerular y la capacidad de la célula tubular de transportar adecuadamente el magnesio al capilar peritubular. Cualquier perturbación de la estructura o de la función del epitelio tubular afectaría la reabsorción del magnesio, así como induciría pérdidas abundantes de este catión. Una FEMg normal se ha asociado a una estructura intacta del túbulo-intersticio y una FEMg notoriamente elevada se ha correlacionado con fibrosis y daño del túbulo-intersticio,8,9 pero los reportes son escasos y limitados a población pediátrica.
La búsqueda de estudios funcionales no invasivos que pongan en evidencia los cambios estructurales del túbulo-intersticio en las enfermedades glomerulares resulta obligatoria.9,10 En tal sentido, se hace necesario determinar el valor de la FEMg en la predicción de la FTI en pacientes nefróticos adultos. Ello constituye una estrategia prometedora para diferenciar los síndromes nefróticos por cambios mínimos con una estructura del túbulo-intersticio intacto o bastante conservada, de una glomerulosclerosis segmentaria focal que se asocia con marcada FTI y pobre evolución clínica.9
MÉTODOS
Se realizó un estudio observacional analítico, de corte transversal, de todos los pacientes con proteinuria nefrótica a los que se le hicieron biopsia renal en el Instituto de Nefrología (INEF) en el período comprendido entre abril 2012 y junio 2013, que no cumplían ningún criterio de exclusión.
Criterios de exclusión
- Pacientes que por prescripción facultativa no se les pudiera suspender el tratamiento diurético.
- Pacientes tratados con: anticalcineurínicos, cisplatino, anfotericin B, foscarnet, glucósidos cardíacos, anticuerpos que bloquean el receptor del factor de crecimiento epidérmico, fenitoína, teriparatide, sales de litio, suplementos minerales e insulina.
- Pacientes con síndrome diarreico crónico, síndromes de malabsorción, alcohólicos, afectos de tubulopatías primarias, enfermedades genéticas como raquitismo hipofosfatémico familiar y similares, hiperparatiroidismo, hipoparatiroidismo, trastornos tiroideos y de la función suprarrenal, cirrosis e insuficiencia hepática.
- Pacientes que no dieran su anuencia de participación en el estudio.
A los 40 pacientes participantes en el estudio se les midió el aclaramiento de creatinina, la FEMg y se les realizó biopsia renal, donde se mensuró la FTI. Las mediciones de magnesio y creatinina en sangre y orina se hicieron por el método colorimétrico de amarillo titánico con equipo Microlab-300 y el método cinético de Jaffé, respectivamente. Las biopsias renales se hicieron siguiendo los protocolos del centro.
Para el análisis histomorfométrico de las biopsias se realizó la captura de las imágenes a un aumento de 10x, con un microscopio acoplado a una computadora. Se tomaron todas las imágenes que fueron necesarias para poder analizar el 100 % de la corteza renal que se obtuvo en el tejido. Las biopsias se analizaron a través del software Image J,11,12 mediante el cual, las láminas, previamente coloreadas con tinción tricrómica de Masson, se sometieron a una exhaustiva evaluación de la fibrosis intersticial y se midió el área afectada en cada una de las láminas procesadas. El resultado se informó en porcentaje de fibrosis. Se excluyeron las áreas de fibrosis que se encontraban alrededor de la cápsula de Bowman, alrededor de los vasos de mayor calibre y en la zona de la médula renal.
Los datos correspondientes al informe de biopsia y el resultado de la histomorfometría no eran conocidos por el personal del laboratorio clínico, mientras los resultados del laboratorio clínico (función renal y fracciones de excreción de magnesio) eran desconocidos por el servicio de patología.
La información fue almacenada en una base de datos en Microsoft Excel e incluyó las siguientes variables objetos de estudio: sexo, edad, color de la piel, peso, índice de masa corporal (IMC), aclaramiento de creatinina como expresión de la tasa de filtración glomerular (TFG), talla, forma clínica de presentación, diagnóstico clínico-patológico, proteinuria de 24 h, albúmina sérica, proteínas plasmáticas, HTA asociada, esquema de tratamiento utilizado, FEMg y porcentaje de fibrosis intersticial.
Se utilizó el paquete estadístico SPSS 15.0 para procesar la información. A las variables cuantitativas se les calcularon media, desviación estándar, mínimo y máximo, mientras que a las cualitativas se les calcularon las frecuencias absolutas y relativas. Para identificar las posibles relaciones entre las variables se utilizó la prueba de Wilcoxon, cuando se trató de 2 muestras, y en el caso de variables de más de 2 categorías, la prueba de Kruskal Wallis. También fue utilizado el coeficiente de correlación de Spearman’s rho. Para todas las pruebas de hipótesis que se realizaron en el estudio se fijó un nivel de significación a= 0,05.
RESULTADOS
Los valores de los estadígrafos descriptivos para las variables: edad, peso, talla e IMC, pueden ser observados en la tabla 1.
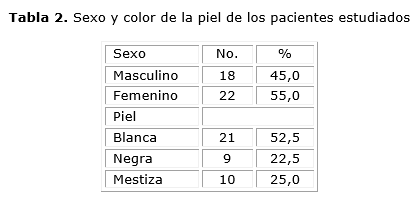
En la tabla 2 se muestra el sexo y el color de la piel de los pacientes estudiados. Se puede observar que 22 fueron del sexo femenino. En cuanto al color de la piel predominaron los pacientes de piel blanca (52,5 %).
La media de la FEMg de los pacientes resultó ser de 3,75 % (DE 3,99 %) y la correspondiente a la fibrosis intersticial, de 21,6 % (DE 13,37 %).
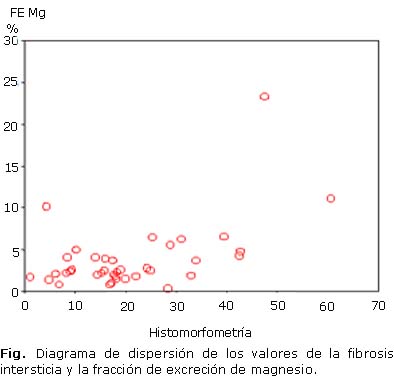
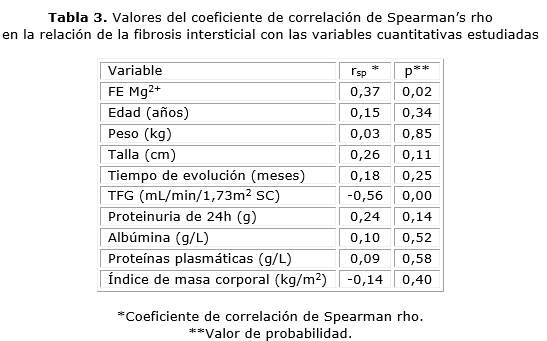
Se encontró correlación estadísticamente significativa de la fibrosis intersticial con la FEMg, (p= 0,02) y con la tasa de filtración glomerular (TFG, p= 0,00). Con la fracción de excreción de magnesio la relación fue directa (Fig.) y de intensidad moderada (rsp= 0,37), mientras que en el segundo caso la relación fue inversa y de intensidad moderada (rsp= -0,56). Con el resto de las variables cuantitativas estudiadas no fue encontrada correlación estadísticamente significativa de la fibrosis intersticial (tabla 3).
En la tabla 4 se puede observar que no se encontró asociación estadísticamente significativa de la FEMg con el empleo de medicamentos de uso más frecuente (p > 0,05 en todos los casos); los promedio de la FEMg resultan similares al comparar pacientes que utilizan un determinado medicamento, con los que no lo utilizan. En cuanto al antecedente de hipertensión arterial, la diferencia de los promedio de la FEMg entre pacientes hipertensos (4,55 %) y no hipertensos (2,23 %) resulta algo mayor, aunque por regla tampoco se consideró estadísticamente significativa (p= 0,05).
DISCUSIÓN
El hallazgo de marcadores pronósticos de las enfermedades glomerulares es uno de los grandes anhelos de los facultativos dedicados a las glomerulopatías. Sin embargo, el número de tales marcadores es limitado y generalmente se modifican tardíamente, de modo que no permiten la implementación temprana de medidas encaminadas al enlentecimiento o detención de la enfermedad renal crónica (ERC). Este trabajo queda enmarcado dentro del gran grupo de investigaciones desarrolladas con el fin de encontrar marcadores de daño renal que sean de utilidad clínica y asequibles en medios de limitados recursos económicos.5,13,14
Dada la naturaleza de esta investigación, la ausencia de trabajos previos en adultos y el número muy limitado de trabajos en población pediátrica, se decidió centrar el análisis en los argumentos que se considera determinan que la FEMg pueda constituirse en un marcador de daño túbulo-intersticial. El hallazgo de la relación (limítrofe) de la FEMg y la presencia de HTA asociada es un resultado esperado considerando la relación existente entre la magnitud del daño túbulo-intersticial y el desarrollo de HTA.7
Al analizar las FEMg en función de la FTI, que constituye el elemento básico de esta investigación, o sea la identificación de marcadores de daño túbulo-intersticial en las enfermedades glomerulares con proteinuria nefrótica, resulta notable la relación directa hallada entre la FEMg con el porcentaje de fibrosis en la biopsia renal. Varias evidencias apuntan a la FEMg como marcador de daño túbulo-intersticial, aunque ninguno de esos trabajos fue desarrollado a partir de estudios histomorfométricos.5,15
Antes de adentrarse en los elementos que explicarían las modificaciones en las FEMg con el daño túbulo-intersticial en las enfermedades glomerulares, resulta preciso analizar cómo tiene lugar el daño túbulo-intersticial en estas enfermedades.
De forma general se considera que el daño glomerular inicial y las modificaciones hemodinámicas intrarrenales que trae aparejadas, ocasionan disminución del flujo tubular capilar, lo que provoca isquemia del túbulo-intersticio y ello se añade a la toxicidad tubular de la proteínas, como origen del daño túbulo-intersticial;9,16,17 esto trae consigo la ocurrencia de FTI, la cual involucra a los vasos que irrigan los glomérulos, ello causa isquemia glomerular y modificaciones hemodinámicas glomerulares que, a su vez, ocasionarán isquemia túbulo-intersticial; de modo que se entra en un círculo vicioso que determina la progresión de la ERC.18
En el desarrollo de FTI, la sustitución del epitelio tubular por mesenquimatoso resulta un elemento clave,19 que determina una disminución de los transportadores tubulares y, en consecuencia, se originan modificaciones en la función tubular que pueden verse reflejadas a través de las FE electrolíticas.20 A esto se adiciona que con la disminución del número de unidades funcionales, la carga filtrada de solutos por cada nefrona se incrementa, lo que trae consigo un aumento de la función reabsortiva tubular, pero este incremento en la reabsorción de cada nefrona ocasionado por el déficit de unidades funcionales, llega a superar su límite fisiológico y determinaría un aumento de la FE de solutos.21
El desarrollo reciente de diferentes trabajos que han permitido conocer el manejo tubular del magnesio y su regulación, resulta clave para la comprensión de la FEMg como marcador de daño túbulo-intersticial. El magnesio filtrado solo es reabsorbido entre un 15-20 % en el túbulo proximal, a favor del gradiente de concentración generado por la reabsorción de sodio y agua; el grueso de la reabsorción tiene lugar en la rama ascendente gruesa del asa de Henle, por vía paracelular; mientras la regulación fina de su excreción tiene lugar en el túbulo contorneado distal, aun cuando solo es responsable del 5-10 % de su reabsorción.22,23 A este nivel, la reabsorción tiene lugar por vía transcelular a través de los canales luminales de magnesio denominados TRPM6, cuya expresión es regulada por la unión del factor de crecimiento epidérmico a su receptor en la membrana basolateral.24 Un elemento que no se puede olvidar es que este segmento nefronal tiene el mayor consumo energético de todo el aparato tubular (expresado por el mayor número de mitocondrias presentes),25 de modo que la isquemia que como antes se vio es un elemento fundamental en la fibrosis intersticial, tiene un peso notorio a este nivel. Así la sustitución de las células epiteliales del túbulo contorneado distal por células mesenquimatosas imposibilita la reabsorción de magnesio y determina el incremento de su FEMg.19 Estos elementos hacen teóricamente a la FEMg un magnífico marcador temprano de fibrosis intersticial, lo cual si bien en un número limitado de casos, ha quedado demostrado en la presente investigación, la que en modo alguno constituye el fin de un trabajo, sino que se debe ampliar a un número mayor de pacientes, de modo que permita contar con un nivel más sólido de evidencias.
Disponer de un marcador no invasivo de daño túbulo-intersticial temprano, barato y asequible, sería una herramienta diagnóstica que ayudaría al nefrólogo en la toma de decisiones clínicas como la prescripción de anticalcineurínicos, así como en el establecimiento de juicios pronósticos en los pacientes con glomerulopatías. De momento, la FEMg constituye una opción prometedora, pero hay que ampliar el volumen de investigaciones al respecto.
REFERENCIAS BIBLIOGRÁFICAS
1. Zeisberg EM, Potenta SE, Sugimoto H, Zeisberg M, Kalluri R. Fibroblasts in kidney fibrosis emerge via endothelial-to-mesenchymal transition. J Am Soc Nephrol. 2008;19:2282-7.
2. Zeisberg M, Kalluri R. Fibroblasts emerge via epithelial-mesenchymal transition in chronic kidney fibrosis. Front Biosci. 2008;13:6991-8.
3. Roberts IS, Cook HT, Troyanov S, Alpers CE, Amore A, Barratt J. The Oxford classification of IgA nephropathy: Pathology definitions, correlations, and reproducibility. Kidney Int. 2009;76:546-56.
4. Risdon RA, Sloper JC, De Wardener HE. Relationship between renal function and histological changes found in renal-biopsy specimens from patients with persistent glomerular nephritis. Lancet. 1968;2:363-6.
5. Futrakul P, Yenrudi S, Futrakul N, Sensirivatana R, Kingwatanakul P, Jungthirapanich J, et al. Tubular function and tubulointerstitial disease. Am J Kidney Dis. 1999;33:886-91.
6. Schainuch LI, Striker GE, Luther RE, Benditt EP. Structural function correlations in renal disease: The correlations. Human Pathol. 1970;1:631-41.
7. Hall ME, do Carmo JM, da Silva AA, Juncos LA, Wang Z, Hall JE. Obesity, hypertension, and chronic kidney disease. Int J Nephrol Renovasc Dis. 18 feb. 2014;7:75-88.
8. Bohle A, Mackensen-Haen S, Wehrmann M. Significance of postglomerular capillaries in the pathogenesis of chronic renal failure. Kidney Blood Press Res. 1996;19:191-5.
9. Futrakul N, Futrakul P. Microvascular disease and renal disease progression. J Med Assoc Thai. 2004;87:854-9.
10. Deekajoindech T. Fractional excretion of Magnesium in Sytemic Lupus Erytematosus. J Med Ass Thai. 2008;88:743-5.
11. Farris AB, Adams CD, Brousaides N, Della Pelle PA, Collins AB, Moradi E, et al. Morphometric and Visual Evaluation of Fibrosis in Renal Biopsies. J Am Soc Nephrol. 2011;22:176-86.
12. Kashgarian M. The Contribution of Quantitative Techniques Including Morphometry to Renal Diagnosis. Ultrastructural Pathology. 2009;30:339-43.
13. Coca SG, Parikh CR. Urinary biomarkers for acute kidney injury: perspectives on translation. Clin J Am Soc Nephrol. 2008;3:481-90.
14. Hoffmann D, Fuchs TC, Henzler T. Evaluation of a urinary kidney biomarker panel in rat models of acute and subchronic nephrotoxicity. Toxicology. 2010;277:49-58.
15. Ghissari A, Andalib A, Labibzadeh A. Fractional excretion of magnesium, a marker for tubular dysfunction in children with clinically recovered ischemic acute tubular necrosis. Saudi J kidney Dis Transpl. 2011;22(3):476-81.
16. Bouissou F, Barthe PH, Pierragi MT. Severe idiopathic nephrotic syndrome with tubular dysfunction (report of 9 pediatric cases). Clin Nephrol. 1980;14:135-41.
17. Remuzzi G, Bertani T. Pathophysiology of progressive nephropathies. N Engl J Med. 1998;339:1448-56.
18. Futrakul N, Yenrudi S, Sensirivatana R, Watana D, Laohaphaibul A, Watanapenphaibul K, et al. Peritubular flow determines tubulointerstitial disease in idiopathic nephritic syndrome. Ren Fail. 2000;22:329-35.
19. Nakagawa T, Kang DH, Ohashi R. Tubulointerstitial disease: role of ischemia and microvascular disease. Curr Opin Nephrol Hypertens. 2009;12:233-41.
20. Venkov CD, Link AJ, Jennings JL. A proximal activator of transcription in epithelial-mesenchymal transition. J Clin Invest. 2008;117:482-91.
21. Bohle A, Mackensen-Haen S, Gise H. The consequences of tubulointerstitial changes for renal function in glomerulopathies. En: Amerio A, Cortelli P, Massry SG, editores. Tubulointerstitial Nephropathies. Massachusetts: Kluwer; 1991. p. 29-40.
22. Topf JM, Murray PT. Hypomagnesemia and hypermagnesemia. Rev Endocr Metab Disord. 2003;4(2):195-206.
23. Konrad M. Mutations in the tight-junction gene claudin 19 (CLDN19) are associated with renal magnesium wasting, renal failure, and severe ocular involvement. Am J Hum Genet. 2009;79(5):949-57.
24. Walder RY. Mice defective in TRPM6 show embryonic mortality and neural tube defects. Hum Mol Genet. 2009;18(22):4367-75.
25. Kaissling B, Kriz W. Structural analysis of the rabbit kidney. Adv Anat Embryol Cell Biol. 1979;56:1-123.
Recibido: 28 de abril de 2014.
Aprobado: 16 de mayo de 2014.
Dr. Raymed Antonio Bacallao Méndez. Instituto de Nefrología "Dr. Abelardo Bush López", Ave. 26 y Boyeros, Municipio Plaza. La Habana, Cuba. raymed@infomed.sld.cu