My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Medicina
Print version ISSN 0034-7523
Rev cubana med vol.53 no.4 Ciudad de la Habana Sept.-Dec. 2014
TRABAJO ORIGINAL
Comportamiento de la resistencia a drogas antirretrovirales en una consulta externa de La Habana durante el año 2012
Resistance Behavior to Antiretroviral Drugs in a Havana Outpatient Consultation in 2012
Dr. Héctor Manuel Díaz Torres,I Lic. Liuber Yans Machado Zaldívar,I Dr. Liodelvio Martínez Fernández, II Lic. Nancy María Ruiz Gutiérrez,I Lic. Carmen Nibot Sánchez,I Dra. Neisy Valdés de Calzadilla,I Lic. Marta Dubed Echevarría,I Lic. Madeline Blanco de ArmasI
I Laboratorio de Investigaciones del SIDA (LISIDA). La Habana, Cuba.
II Hospital Clinicoquirúrgico “Hermanos Ameijeiras”. La Habana, Cuba.
RESUMEN
Introducción: la emergencia de virus de inmunodeficiencia humana tipo 1 (VIH-1) resistentes a antirretrovirales constituye una de las principales causas de fallo terapéutico.
Objetivo: analizar las mutaciones asociadas a resistencia a los antirretrovirales y los niveles de resistencia en un grupo de pacientes con criterios de fallo a la terapia antirretroviral de gran actividad (TARGA) durante el año 2012.
Métodos: se colectaron muestras de plasma de 25 individuos con criterios de fallo a la TARGA, de los 157 pacientes positivos al VIH-1 que asistieron a la Consulta Externa de Infectología del Hospital "Hermanos Ameijeiras" durante el año 2012. Se determinó el subtipo viral y las mutaciones asociadas a resistencia y se estimó el tiempo transcurrido entre el inicio de la última terapia y la detección de virus resistente.
Resultados: 52 % de los pacientes solamente había recibido un régimen de TARGA. Se detectaron mutaciones asociadas a resistencia en 84 % de los pacientes. El 64 % presentó alta resistencia a los antirretrovirales empleados como primera estrategia terapéutica en el país. El tiempo promedio entre el inicio de la última terapia y la detección de virus resistente fue de 2,3 años. El 16 % de los pacientes presentó virus susceptibles, en este grupo la probabilidad de no adherencia a la TARGA pudo ser la causa del fallo terapéutico.
Conclusiones: se evidenciaron altos niveles de resistencia a la primera línea de TARGA empleada en Cuba y la aparición de variantes resistentes después de iniciar el tratamiento. Estos resultados enfatizan la necesidad del monitoreo de la resistencia como parte de la atención integral a las personas que viven con VIH/Sida.
Palabras clave: inmunodeficiencia humana, antirretrovirales, mutaciones asociadas a resistencia, terapia antirretroviral de gran actividad.
ABSTRACT
Introduction: the emergence of resistant virus antiretroviral human immunodeficiency type 1 (HIV-1) is a major cause of treatment failure.
Objective: to analyze the mutations associated with antiretroviral resistance and resistance levels in a group of patients with failure criteria to antiretroviral therapy (HAART).
Methods: Plasma samples from 25 individuals with failure criteria to HAART were collected out of 157 HIV-1 positive patients attending the Outpatient Infectious Diseases at Hermanos Ameijeiras Hospital during 2012. The viral subtype and resistance mutations were determined; and the time between the beginning of the last therapy and detection of resistant viruses was estimated time.
Results: 52 % of patients had only received HAART regimen. Mutations associated with resistance in 84 % of patients were detected. 64 % had to antiretroviral treatment strategy employed as first high resistance in this country. The average time between the beginning of the last therapy and the detection of resistant viruses was 2.3 years. 16 % of patients had susceptible virus. The probability of non-adherence to HAART could be the cause of therapeutic failure in this group.
Conclusions: high levels of resistance to first-line HAART used in Cuba and the emergence of resistant variants after starting treatment were evident. These results emphasize the need for monitoring resistance as part of comprehensive care for people living with HIV / AIDS.
Key words: human immunodeficiency, antiretrovirals, resistance mutations, highly active antiretroviral therapy.
INTRODUCCIÓN
Uno de los progresos más significativos en el enfrentamiento a la epidemia del VIH/sida ha sido el desarrollo de la terapia antirretroviral de gran actividad (TARGA), la que previene o retarda la progresión de la enfermedad, con el impacto positivo de disminuir la carga viral circulante, restaurar el sistema inmunológico y mejorar la calidad de vida.1,2
La mayoría de los antirretrovirales (ARV) actualmente en uso se clasifican en alguno de los siguientes grupos: inhibidores de la transcriptasa inversa análogos de nucleósidos y nucleótidos (ITIAN), inhibidores de la transcriptasa inversa no análogos de nucleósidos (ITINAN) e inhibidores de la proteasa viral (IP). En Cuba, los ARV más frecuentemente empleados en el tratamiento de los pacientes son: de los ITIAN, lamivudina (3TC), estavudina (D4T) y zidovudina (AZT), de los ITINAN la nevirapina (NVP) y de los IP el indinavir (IDV). El esquema más usado incluye 3TC, AZT y NVP. Lamivudina es la droga más utilizada en tratamientos combinados y la terapia de primera línea incluye AZT, 3TC, D4T y NVP. A partir del año 2004, Cuba comenzó a adquirir otro grupo de medicamentos, lo que permitió diversificar la terapia.3 Actualmente se trabaja por retirar progresivamente medicamentos con reacciones adversas frecuentes, no recomendados por la OMS, como D4T e IDV.4
Tras la introducción de la TARGA en el 2001, en Cuba se constató una disminución de la incidencia de las infecciones oportunistas relacionadas con el VIH/sida y de la mortalidad por el sida.3 Al cierre del 2013, 9 662 personas que viven con VIH (PVV) se habían beneficiado de la TARGA (Registro Informatizado del MINSAP. Cuba, 2014).
En el año 2005, la atención médica a las PVV se descentralizó, lo que mejoró el control de la TARGA, según el área de residencia de los pacientes.3 En el Hospital Clinicoquirúrgico "Hermanos Ameijeiras", según el Protocolo de trabajo para la infección y la enfermedad por retrovirus humanos aprobado por la Comisión de Aplicación del Manual de Prácticas Médicas del hospital, se atienden en Consulta Externa de Infectología, un grupo de PVV.5 La atención hospitalaria se realiza en colaboración con la atención primaria descentralizada que se brinda según su área de residencia,3 lo que les ha permitido comenzar la TARGA cuando lo han requerido. Sin embargo, esta terapia no es capaz de erradicar el VIH del organismo y se debe mantener de por vida,2 por lo tanto, se hace necesario controlar factores que pueden entorpecer el éxito del tratamiento a corto o largo plazo, tales como la pobre adherencia a la terapia, la intolerancia a la medicación, las interacciones medicamentosas, las variaciones individuales de la farmacocinética y la emergencia de mutaciones asociadas a resistencia (MAR) a los ARV. Precisamente, la resistencia a los ARV es una de las principales causas de fallo de los esquemas de tratamiento, lo que se evidencia por el aumento de la carga viral, el deterioro inmunológico y, eventualmente, la progresión clínica.6,7 Estos aspectos deben ser monitoreados durante la práctica clínica para detectar precozmente los casos con fracaso terapéutico y evaluar posibles cambios en las combinaciones de antirretrovirales indicadas. Por la importancia de este aspecto en la atención integral que se brinda a las PVV y a la necesidad de perfeccionar el monitoreo de la terapia antirretroviral, el objetivo del presente estudio fue analizar las MAR y los niveles de resistencia en un grupo de pacientes con criterios de fallo a la TARGA que asistieron a la consulta externa de Infectología del Hospital "Hermanos Ameijeiras" durante el año 2012.
MÉTODOS
Selección de los pacientes
Se incluyeron en el estudio todos los individuos que presentaron alguno de los criterios de fallo terapéutico, detectados durante el seguimiento clínico. Se consideraron los siguientes criterios de fallo terapéutico:
- Criterio clínico: aparición de alguna infección oportunista o enfermedad indicadora de sida durante el monitoreo de la TARGA.
- Criterio virológico: detección de niveles de carga viral por encima de 1 000 UI/mL, después de resultados no detectables.
- Criterio inmunológico: no aumentar el conteo de células CD4+ sobre el nivel basal y por encima del nivel de seguridad para evitar infecciones oportunistas.
Evaluación de la adherencia a la terapia
Se obtuvo información sobre la adherencia a la terapia a partir del interrogatorio al paciente y al familiar acompañante, según procedimiento descrito previamente por varios autores8 y a la colaboración de voluntarios de la Línea de Apoyo a PVV que verificaron el cumplimiento de la terapia en los registros de farmacia.
Determinación de la carga viral plasmática
La carga viral plasmática se determinó mediante el empleo de la tecnología COBAS Ampliprep/COBAS Taqman HIV-1 Test (Roche Diagnostics GmbH, Mannheim, Germany). Los resultados se expresaron en UI/mL.
Conteo de subpoblaciones linfocitarias
Los valores correspondientes al conteo de subpoblaciones linfocitarias (CD4+) se obtuvieron a través de la base de datos SIDATRAT del Instituto de Medicina Tropical "Pedro Kourí" (IPK).9
Determinación del subtipo de VIH-1 y de la resistencia a drogas ARV
Se colectaron 10 mL de sangre periférica en tubos con EDTA (0,2 M, pH 7,2), mediante punción venosa, y se separó el plasma por centrifugación durante 20 min a 2 000 g. El plasma se conservó a -85 º C hasta su uso.
Se aisló el ARN viral del plasma para amplificar la región del gen pol de VIH-1 que codifica las enzimas proteasa y transcriptasa inversa (TI), según los procedimientos descritos por Machado y otros.10
Las MAR y los niveles de resistencia a los ARV se determinaron según los programas disponibles en la base de datos de la Universidad de Stanford (http://hivdb.stanford.edu).
Se consideró multirresistencia cuando se detectaban mutaciones asociadas a resistencia a los 3 grupos de ARV: ITIAN, ITINAN, IP.
Se determinó el tiempo entre la fecha de comienzo del último esquema terapéutico y la fecha de detección de la resistencia a los ARV.
Procesamiento estadístico
Los datos categóricos se analizaron mediante el test X2. Se realizó una comparación de 2 proporciones con muestras independientes mediante el empleo del estadígrafo Z. Para todos los tests estadísticos se consideraron significativos los valores de p £ 0,05.
RESULTADOS
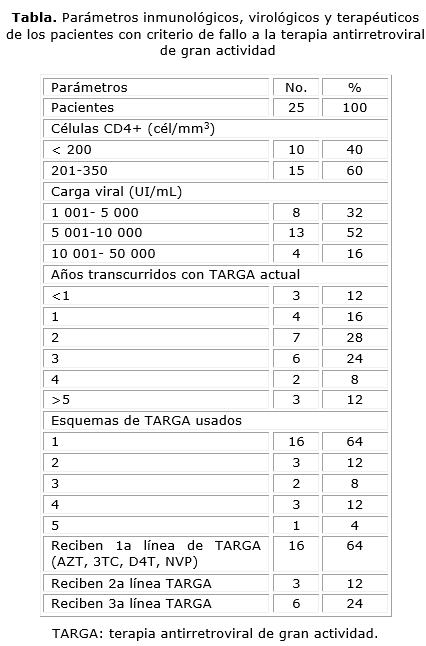
De las 157 PVV, 25 individuos con TARGA fueron clasificados con criterio de fallo terapéutico.
En la tabla se muestran los parámetros inmunológicos, virológicos y terapéuticos de los pacientes incluidos en el estudio.
Distribución de subtipos
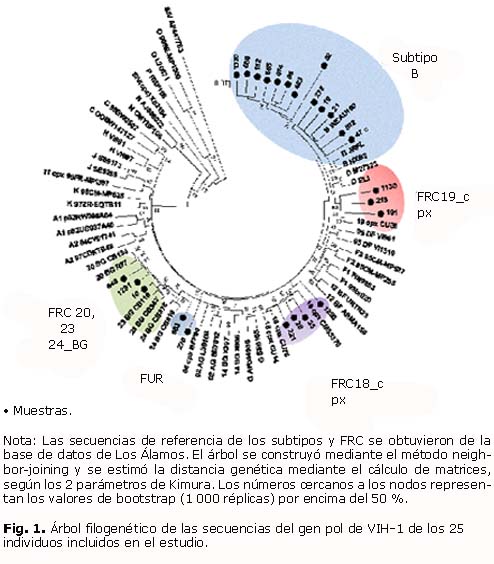
En la figura 1 se ilustra el árbol filogenético de las muestras estudiadas.
El subtipo B predominó en la población estudiada (52 %), seguido de la forma recombinante circulante (FRC) 19_cpx (16 %), las FRC BG (12 %), que incluyen 20_BG, 23_BG y 24_BG, las formas únicas recombinantes (FUR) con 12 % y la FRC 18_cpx con 8 %.
Prevalencia de las mutaciones asociadas a la resistencia a los ARV y niveles de resistencia
Se detectó al menos una MAR en 21 pacientes (84 %). De ellos, el 61,9 % presentó mutaciones a ambas familias de inhibidores de la TI (ITIAN e ITINAN), el 19,1 % a la combinación IP + ITIAN, el 9,5 % solo a los ITIAN y el 9,5 %, solo a los ITINAN. El 16 % de los pacientes presentaron virus susceptibles a todos los ARV.
Las mutaciones más frecuentes para los ITIAN fueron M184V (56 %) y T215F/Y/rev (36 %), mientras que para los ITINAN fueron Y181C/I/V (24 %) y K103N (20 %). La mutación más común para los IP fue K43T (9,5 %).
El 64 % presentó alta resistencia a todas o algunas de las drogas empleadas como primera estrategia terapéutica en el país. Los mayores niveles de resistencia a ARV (suma de resistencia alta, intermedia y baja) se detectaron en la NVP (56 %), seguido de 3TC, abacavir (ABC), AZT, D4T, emtricitabina (FTC) y efavirenz (EFV) (52 %). La presencia de multirresistencia se detectó en el 12 % de las muestras estudiadas. En la figura 2 se ilustra el comportamiento de la resistencia a los diferentes ARV en las muestras estudiadas.
El tiempo transcurrido entre el inicio o cambio de la TARGA y la detección de las MAR fue de 2,3 años y en este parámetro no hubo diferencia estadísticamente significativa entre los resultados de los pacientes que recibían la primera línea de TARGA y los que recibían la segunda o la tercera línea.
DISCUSIÓN
El empleo de la TARGA en Cuba, desde el año 2001, ha propiciado una disminución de la mortalidad por sida e incidencia de enfermedades oportunistas asociadas al VIH/sida en las PVV. La producción de un grupo de ARV en instituciones cubanas, posibilitó un aumento en la cobertura y mayor acceso a este tipo de tratamiento.3 Sin embargo, una de las principales causas referidas al fallo a la TARGA lo constituye la aparición de variantes virales resistentes a los diferentes ARV empleados en los diferentes esquemas terapéuticos.7,11
En el grupo de pacientes con criterio de fallo a la TARGA que asistieron a la consulta de Infectología durante el año 2012, hubo un predominio del subtipo B y la presencia de diferentes formas recombinantes, comportamiento similar al descrito por varios autores al estudiar la diversidad genética del VIH-1 y la resistencia a los ARV en diferentes grupos de PVV cubanos.12-19
El 61,9 % de las muestras estudiadas presentó mutaciones asociadas a los 2 grupos de inhibidores de la transcriptasa inversa (ITIAN e ITINAN). Estos valores son similares a los descritos por varios autores en población tratada con evidencia de fallo a terapia.19-21 El primer estudio de la resistencia a los ARV realizado en Cuba mostró evidencias de MAR en el 32,9 % de las muestras de pacientes tratados.22 Posteriormente, otro estudio mostró una frecuencia de MAR de 64,5 % y 54,8 % para los ITIAN e ITINAN, respectivamente.17 La detección de las mutaciones M184V y T215F/Y, en la mayoría de las muestras estudiadas, puede deberse al empleo sistemático de 3TC, AZT y D4T en los esquemas terapéuticos cubanos. La NVP es uno de los ITINAN empleados con más frecuencia en las combinaciones de TARGA, lo cual explica la elevada frecuencia de alta resistencia a esta droga.
Uno de los factores virales que favorece la aparición de MAR en el VIH-1 lo constituye la presión que ejercen los ARV durante el ciclo replicativo, aspecto que posibilita que se acorte el tiempo de aparición de la resistencia después de iniciada la TARGA.11 En el presente estudio se observó un intervalo promedio de 2,3 años desde el inicio de la TARGA hasta la detección de MAR (con rango de menos de 1 año hasta más de 5 años).
A pesar de que las pruebas genotípicas para la detección de la resistencia a ARV se implementaron en Cuba en el año 2009, a los pacientes involucrados en el estudio no se les pudo realizar el ensayo al momento del diagnóstico y tampoco estudios secuenciales de los patrones de mutaciones de resistencia para determinar la fecha de aparición de dichas mutaciones, elementos que constituyen limitaciones de este trabajo; sin embargo, el intervalo de tiempo observado entre el inicio de la TARGA hasta la detección de MAR es lo suficientemente breve como para poder inferir que las mutaciones aparecieron con relativa rapidez. Por otra parte, se trata de pacientes con buena respuesta inicial al tratamiento, por lo que no se debe descartar la posibilidad de que algunos individuos se hayan reinfectado con virus portadores de MAR, como ha sido reportado por otros autores.23
La mutación más frecuentemente asociada a la resistencia a los IP fue la K43T. Esta mutación disminuye la susceptibilidad al atazanavir (ATV/r), por lo que el hallazgo resulta inesperado debido a que ATV/r, a diferencia del indinavir con ritonavir (IDV/r), no es un fármaco comúnmente utilizado en las primeras estrategias de TARGA.
La falta de adherencia a la terapéutica es una de las causas que contribuyen al fallo de la TARGA.8 En el presente estudio, el 16 % de las muestras analizadas, tomadas de pacientes con fallo terapéutico, no mostró evidencias de MAR; estas muestras pertenecen a pacientes que durante el interrogatorio admitieron tener mala adherencia al tratamiento o en los que el personal de salud detectó falla en el cumplimiento de la terapia, situación que fue detectada en menor frecuencia y gravedad en el resto de los individuos. Este fenómeno podría contribuir a la aparición de una variante resistente y al aumento de la resistencia transmitida en pacientes no tratados y de reciente diagnóstico.24
En conclusión, este estudio evidenció altos niveles de resistencia a la combinación de TARGA más frecuentemente indicada a los pacientes con VIH-1 en Cuba, así como permitió detectar la presencia de variantes resistentes poco tiempo después de iniciada la terapia. Estos resultados enfatizan la necesidad del monitoreo de la resistencia como parte de la atención integral a las personas que viven con VIH/sida.
REFERENCIAS BIBLIOGRÁFICAS
1. Hirsch MS, Brun-Vezinet F, Clotet B, Conway B, Kuritzkes DR, D’Aquila RT, et al. Antiretroviral drug resistance testing in adults infected with human immunodeficiency virus type 1: Recommendations of an International AIDS Society–USA Panel. CID. 2003;37:113-28.
2. Ceccherini-Silberstein F, Svicher V, Sing T, Artese A, Santoro M, Forbici F, et al. Characterization and structural analysis of novel mutations in human immunodeficiency virus type 1 reverse transcriptase involved in the regulation of resistance to nonnucleoside inhibitors. J Virol. 2007;81(20):11507-19.
3. Gorry C. Cuba’s National HIV/AIDS Program. MEDICC Review 2011;13(4):5-8.
4. República de Cuba. Ministerio de Salud Pública. Plan estratégico nacional para la prevención y el control de las ITS y el VIH/Sida 2014-2018. [citado 24 mar 2014]. Disponible en: http://www.sld.cu/servicios/sida/
5. Díaz HM. Infección y enfermedad por retrovirus humanos. Manual de Prácticas Médicas del Hospital Hermanos Ameijeiras. 2a ed. La Habana: Hospital “Hermanos Ameijeiras”; 2008. [citado 26 oct 2013]. Disponible en: http://www.hospitalameijeiras.sld.cu/hha/mpm/
6. Domingo E, Mas A, Menéndez AL. Variabilidad genética del VIH-1. En: Vázquez S, González Lahoz J. Manual del SIDA. 3a ed. Madrid: IDEPSA; 1999. p. 41-58.
7. Sens S, Tripathy SP, Paranjape RS. Antiretroviral drug resistance testing. J Postgrad Med. 2006;52:187-93.
8. Aragonés C, Sánchez L, Campos JR, Pérez J. antiretroviral therapy adherence in persons with HIV/AIDS in Cuba. MEDICC Review. 2011;13(2):17-22.
9. Aragonés C, Campos JR, Pérez D, Martínez A, Pérez J. SIDATRAT: Informatics to improve HIV/AIDS care. MEDICC Review. 2012;14(4):5-9.
10. Machado LY, Dubed M, Díaz HM, Ruiz N, Romay D, Valdés N, et al. Transmitted HIV type 1 drug resistance in newly diagnosed Cuban patients. AIDS Res Hum Retroviruses. 2013;29(2):411-4.
11. Bennett D, Myatt M, Bertagnolio S, Sutherland D, Gilks C. Recommendations for surveillance of transmitted HIV drug resistance in countries scaling up antiretroviral treatment. Antiviral Therapy. 2008;13(Supl.2):25-36.
12. Rolo F, Miranda L, Wainberg M, Gu Z, Lobaina L, Noa E, et al. Envelope V3 region sequences of Cuban HIV-1 isolates. J Acquir Immune Defic Syndr. 1995;9:123-5.
13. Blanco M, Rolo F, Martínez N, Gessa A, Díaz HM, Lubian AL. Aplicación del ensayo de Movilidad del Heteroduplex en los estudios de epidemiología molecular del VIH-1 en Cuba. Biotecnología Aplicada. 2001;18:149-53.
14. Cuevas MT, Ruibal I, Villahermosa ML, Díaz H, Delgado E, Parga EV, et al. High HIV-1 genetic diversity in Cuba. AIDS. 2002;16:1643-53.
15. Pérez L, Thomson M, Aragonés C, González Z, Pérez J, Casado G, et al. HIV type 1 molecular epidemiology in Cuba: high genetic diversity, frequent mosaicism, and recent expansion of BG intersubtype recombinant forms. AIDS Res Hum Retroviruses. 2006;22(8):724-33.
16. Machado LY, Blanco M, Dubed M, Díaz HM, Ruiz NM, Valdés N, et al. HIV type 1 genetic diversity in newly diagnosed Cuban patients. AIDS Res Hum Retroviruses. 2012;28(8):956-60.
17. Kourí V, Alemán Y, Pérez L, Pérez J, Fonseca C, Correa C, et al. High frequency of antiviral drug resistance and non-B subtypes in HIV-1 patients failing antiviral therapy in Cuba. J Clin Virology. 2012;55:348-55.
18. Pérez L, Pérez Álvarez L, Carmona R, Aragonés C, Delgado E, Thomson M, et al. Genotypic resistence to antiretroviral drug in patients infected with several HIV type I genetic forms in Cuba. AIDS Res Hum Retroviruses. 2007;23(3):407-14.
19. Pillay DGH, Matthias R, Dunn D, Phillips A, Sabin C, Evans B. UK Collaborative Group on HIV Drug Resistance. Estimating HIV-1 drug resistance in antiretroviral-treated individuals in the United Kingdom. J Infect Dis. 2005;192(6):967-73.
20. Costagliola D, Descamps D, Assoumou L, Morand-Joubert L, Marcelin AG, Brodard V, et al. Prevalence of HIV-1 drug resistance in treated patients: a French nationwide study. J Acquir Immune Defic Syndr. 2007;46(1):12-8.
21. de Mendoza C, Garrido C, Corral A, Ramirez-Olivencia G, Jimenez-Nacher I, Zahonero N, et al. Changing rates and patterns of drug resistance mutations in antiretroviral-experienced HIV-infected patients. AIDS Res Hum Retroviruses. 2007;23(7):879-85.
22. Ruibal I, Cuevas MT, Díaz HM, Villahermosa ML, Noa E, Parga EV, et al. Genotypic resistance mutations to antiretroviral drugs in HIV-1 B and non-B subtypes from Cuba. Rev Panam Salud Pública. 2001;10(3):174-80.
23. Little S, Frost S, Wong JK, Smith SM, Kosakovsky Pond S, Ignacio C, et al. Persistence of transmitted drug resistance among subjects with primary human immunodeficiency virus infection. J Virology. 2008;82(11):5510-18.
24. Bangsberg DR, Moss AR, Deeks SG. Paradoxes of adherence and drugs resistance to HIV antiretroviral therapy. J Antimicrob Chemother. 2004;53(5) 696-9.
Recibido: 25 de marzo de 2014.
Aceptado: 2 de abril de 2014.
Dr. Héctor Manuel Díaz Torres. Laboratorio de Investigaciones del SIDA (LISIDA), Carretera Tapaste y Autopista Nacional, San José de las Lajas, Mayabeque, Cuba. CP 32700. hectorm@infomed.sld.cu