My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Medicina
On-line version ISSN 1561-302X
Rev cubana med vol.54 no.1 Ciudad de la Habana Jan.-Mar. 2015
TEMA ACTUALIZADO
Fiebre Chikungunya
Chikungunya fever
Dr. Liodelvio Martínez Fernández, Dra. Yeimy Paola Torrado Navarro
Hospital Clinicoquirúrgico "Hermanos Ameijeiras". La Habana, Cuba.
RESUMEN
La fiebre Chikungunya es una enfermedad emergente que se ha extendido explosivamente desde el África a las islas del Océano Índico, la India, el sudeste asiático, Europa y ya, más recientemente, a las Américas, a donde arribó a través de las islas del Caribe en las que está causando una epidemia de gran magnitud. Se hizo una revisión del tema en cuanto a causa, características clínicas y diagnóstico. Se corroboró que no existe hasta el momento una terapéutica específica eficaz ni vacuna disponible, por tanto, la prevención de la infección a través del control vectorial y la prevención de la picadura por el mosquito transmisor son las mejores medidas de contención de sus efectos. Se sugiere estar preparados para la llegada de dicha enfermedad al país y ante su presencia, intentar detectar tempranamente al portador del virus para prevenir la transmisión porque realmente no hay tratamiento específico.
Palabras clave: CHIKV, arbovirus, expansión viral, diagnóstico, tratamiento y prevención.
ABSTRACT
Chikungunya fever is an emerging disease that has spread explosively from Africa to the islands of the Indian Ocean, India, Southeast Asia, Europe, and, more recently, to the Americas, where it arrived via the Caribbean islands causing a major epidemic. Its causes, clinical features and diagnosis were reviewed in the literature. It was confirmed that there is no effective specific treatment or vaccine available yet, thus preventing infection through vector control and prevention of mosquito bites are the best measures to contain its effects. It is suggested to be prepared for the arrival of this disease in the country and at its presence, try to detect early bearer of the virus to prevent transmission because there really is no specific treatment.
Key words: CHIKV, arbovirus, virus spread, diagnosis, treatment and prevention.
INTRODUCCIÓN
La fiebre Chikungunya se ha expandido explosivamente a varias regiones del mundo en las cuales no existía anteriormente y se ha convertido en una enfermedad emergente a nivel global. En diciembre de 2013 se reportaron los primeros casos de transmisión autóctona en el Caribe y, desde entonces, se ha extendido a múltiples islas de esta región. Por tanto, se ha convertido en una amenaza para nuestro país, donde ya se han detectado varios casos importados.
Agente biológico
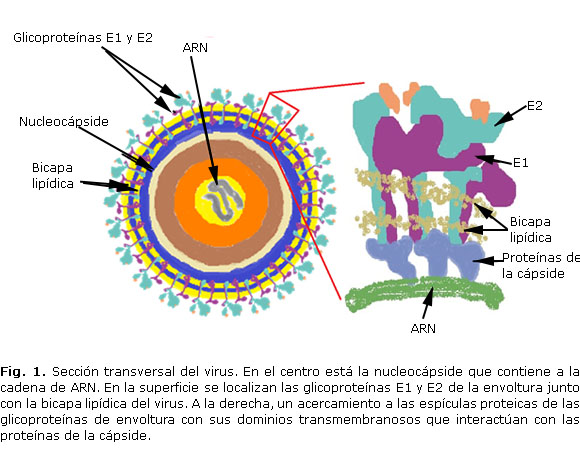
El agente etiológico es el virus Chikungunya (CHIKV). Es un Arbovirus miembro del genero Alphavirus, perteneciente a la familia Togaviridae, constituido por una cadena simple de RNA de polaridad positiva, que codifica para 4 proteínas no estructurales (nsP1-4) y 3 estructurales (C, E1-2).1 Consiste en una partícula esférica pequeña, de aproximadamente 60-70 nanómetros de diámetro, con envoltura fosfolipídica donde están ancladas las glicoproteínas E1 y E2 que forman 80 espigas triméricas, cada una compuesta por 3 heterodímeros de glicoproteínas E1/E2, que son proteínas transmembrana con regiones citoplasmáticas C-terminales que interactúan con la nucleocápside (Fig. 1). Esta última tiene forma icosaédrica y está compuesta por 240 monómeros de proteínas de la cápside y una cadena de RNA genómica. Se une a la célula hospedera a través de la glicoproteína E2, la que incluye un péptido de fusión que media la entrada de la nucleocápside al citoplasma desde el endosoma.2 Su ciclo replicativo es muy rápido, de aproximadamente 4 h.
Epidemiología
Este virus fue aislado por primera vez, en 1952, de un paciente en Tanzania, África. Se han documentado múltiples epidemias tanto en África como en el sudeste asiático. Hacia el año 2004 se inició un gran brote en Kenya, donde alcanzó una seroprevalencia de aproximadamente el 75 % de la población, lo que constituyó un hecho de gran preocupación al nivel mundial. De aquí se diseminó hacia las islas Comoro, Seychelles, Mauricio y Madagascar del Océano Índico y, luego, migró hacia la isla Reunión donde se detectó en marzo del año 2005; esto se constituyó en una situación de gran impacto por el hecho de ser una colonia francesa donde el sistema de salud está muy bien estructurado y, a pesar de ello, la tasa de ataque fue de 35 %.3
Posteriormente, la epidemia se extendió a la India y, de allí, a Europa, sobre todo a países del Mediterráneo e incluso se detectaron casos importados en Estados Unidos y otros países, habiéndose reportado en estos lugares más de mil casos.
En el 2007 ocurrió el primer brote en Italia, en la región de Emilia-Romagna y posteriormente en el 2009-2010 reaparece en la Isla de Reunión, después de 3 años sin que se detectase transmisión en este lugar. Le siguieron nuevos casos en Francia, donde se detectaron 2 autóctonos. A finales del 2010 se reportan casos autóctonos en La Rioja, España, y ya en el 2011 se desató una epidemia de 11 000 casos en la República del Congo. Desde diciembre del 2013 se revelan casos en las Américas, particularmente en el área del Caribe. El primero registrado fue en la Isla de San Martín, que es una de las islas francesas de ultramar. Actualmente hay actividad epidémica en la India, el sudeste asiático, África y países del Mediterráneo, islas caribeñas y territorio sudamericano, específicamente en las Guyanas.4
El número de casos reportados con transmisión autóctona en países caribeños latinos, hasta el 11 de julio, era de 345 296 casos sospechosos y 4 518 confirmados. La República Dominicana ha reportado 193 395 casos sospechosos; Guadalupe, 52 000 y Haití, 51 830, que son los más afectados y los más cercanos a nuestro territorio. Ya hay afectación en América Central. El Salvador reporta 1 608 sospechosos y 8 confirmados. En el Caribe no latino el número de casos es mucho menor, 3 676 sospechosos, 511 casos confirmados, por lo que hay un total de 350 580 casos sospechosos y 5 037 confirmados en todo el Caribe y América Central. Resulta importante señalar la afectación con elevadas tasas de transmisión local de Puerto Rico, República Dominicana y Haití por su cercanía a Cuba, donde hasta el momento se han reportado casos importados sin haberse detectado casos de transmisión. En relación con los casos importados se reportan ya en países caribeños sin transmisión local, entre los cuales señalamos por su importancia los 11 casos de Cuba. Ya hay reportes de estos casos en toda la región, incluyendo a la América del Norte, la Central y la del Sur.5
Filogénesis
Se han reconocido 3 genotipos del virus:1,6-11 el asiático, el africano oeste y el africano este-central-sur. La mutación A226V en la glicoproteína E1 apareció en más del 90 % de los aislamientos virales realizados en diciembre del 2005 en la isla Reunión y no había estado presente en las fases iniciales del brote, lo que se relacionó con la adaptación del virus al mosquito transmisor presente en el lugar, el Aedes albopictus, incrementando la afinidad por la replicación al nivel del mismo.1,3,4,6-11 Lo mismo sucedió en la India y esto, unido a la ausencia de inmunidad en la comunidad, explicó la explosividad del brote y a su vez, su difusión a Europa y las Américas por la presencia del artrópodo en estas regiones. Los brotes de la enfermedad en otras regiones donde el virus responsable no ha poseído esta mutación no han tenido gran magnitud y han sido más rápidamente controlados. Actualmente se reconoce que a nivel de América, el genotipo que está predominando es el genotipo asiático.
Ciclos de transmisión y agentes transmisores
Se reconoce la existencia de 2 ciclos de transmisión,1,3,7-13 el selvático/enzoótico y el urbano epidémico/endémico (Fig. 2). El primero ocurre en hábitats boscosos, donde varios mosquitos arbóreos como el Aedes furcifer, Aedes taylori, Aedes africanus y el Aedes luteocephalus sirven de vectores que transmiten el virus a primates no humanos como huéspedes reservorio y de amplificación. Se conoce que el Aedes furcifer, que parece ser el principal vector enzoótico, es capaz de penetrar en las aldeas humanas cercanas, donde pueden transmitir el virus a los seres humanos. También los roedores y los pájaros pueden ser reservorios del virus durante los períodos no epidémicos.
En las poblaciones y ciudades, el ciclo es urbano endémico/epidémico, donde los vectores son únicamente los mosquitos Aedes aegypti y Aedes albopictus, capaces de iniciar una transmisión sostenida, con elevados niveles de exposición humana por las características ecológicas y conductuales de estos artrópodos que viven en una estrecha relación con las personas. En este ciclo, el humano es el principal reservorio del virus ya que la transmisión es humano–mosquito–humano. La intensidad de la transmisión se ha visto favorecida por los cambios climáticos, el uso de contenedores plásticos y el comercio internacional de neumáticos y otros factores que han auxiliado la expansión en el mundo de la infestación por los dos vectores.1,4 Ha ocurrido una expansión mundial del Aedes albopictus en las últimas 4 décadas.14 Esta expansión ha sido la responsable de la aparición de epidemias del CHIKV en regiones donde no existían antecedentes de la enfermedad, en las cuales el virus encontró el vector y se adaptó a través de la mutación A226V en la glicoproteína E1, lo cual favoreció el desarrollo de epidemias más intensas y explosivas. En nuestro país, además del Aedes aegypti, también está presente este vector.
Se han descrito otros modos de transmisión además del vectorial. Se han documentado casos de aborto y enfermedad congénita que se han relacionado con la transmisión intraútero del virus cuando la gestante se encuentra en viremia,3,4,7,12,13,15-20 incluso en mujeres con infección crónica del virus. También se ha reconocido que las madres pueden transmitir el virus durante el período perinatal entre los días – 4 a + 1 del parto. Hasta el 50 % de los recién nacidos de estas madres pueden contraer la enfermedad. Para el cuarto día de vida del recién nacido todos están sintomáticos con las características comunes de la enfermedad, pero con mayor severidad. Se reporta elevada tendencia a desarrollar meningoencefalitis, lesiones de sustancia blanca, edema cerebral, hemorragia intracraneana, síntomas hemorrágicos y miocarditis. El futuro desarrollo de estos niños pueden verse comprometido.16,19,21 Por esta razón, este grupo se considera una población de riesgo en comparación con otros grupos etarios. No se ha evidenciado que haya prevención de la transmisión a través de la cesárea y tampoco hay evidencias de que la lactancia materna pueda transmitir el virus.
Es posible la transmisión a través de la sangre.4,11 Hay casos documentados de infecciones adquiridas por personal de laboratorio que manipulaba sangre infectada y de un trabajador sanitario que extrajo sangre a un paciente infectado. También genera profunda preocupación la posibilidad de la transmisión a través de la transfusión de sangre o hemoderivados y donación de órganos para transplantes.11 Esto obliga a las autoridades sanitarias a tomar medidas de control en áreas con transmisión local. Se han propuesto varias medidas y una de ellas consiste en la solicitud a los donantes que reporten cualquier enfermedad que se presente después de la donación, mientras se retienen las donaciones por algunos días antes de disponer de ellas. Se ha detectado la presencia del virus en córneas donadas para transplante y se ha evidenciado su transmisión a ratones.17,22,23
Patogénesis
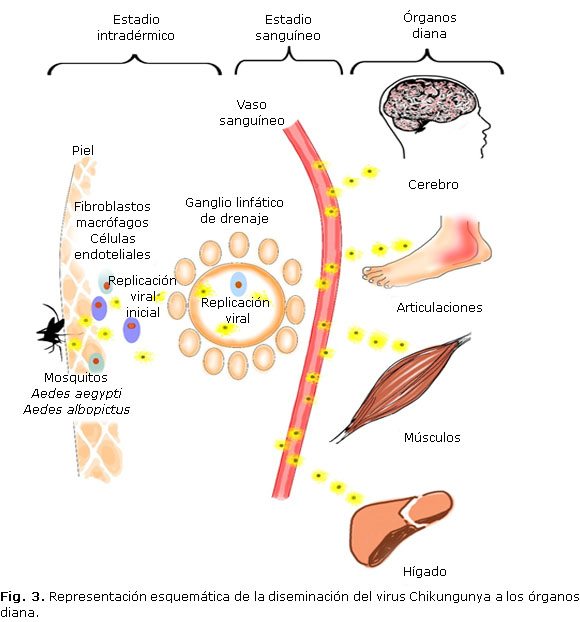
La patogenia se divide en 3 estadios:1,16,24 intradérmico, sanguíneo y el de afectación de los órganos diana (Fig. 3 ). En el primero, el mosquito a través de la picadura introduce los viriones al nivel intradérmico y estos entran en los capilares subcutáneos. Ahí ocurre una replicación viral local al nivel de células que son susceptibles como los fibroblastos, las células endoteliales y los macrófagos. Posteriormente, pasa a los nódulos linfáticos locales, donde también acontece la replicación. De aquí el virus es drenado a través del conducto toráxico a la circulación sanguínea hasta alcanzar los órganos diana: hígado, músculos, articulaciones y cerebro. En el hígado se produce apoptosis y en los órganos linfoides adenopatías. En los músculos y articulaciones, la replicación viral y la infiltración mononuclear provocan intenso dolor y artritis.
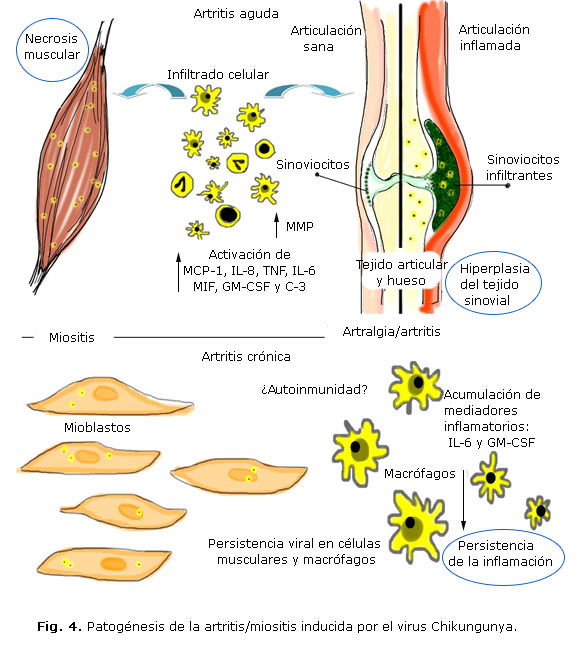
Al nivel inmunológico se ha evidenciado que la primera barrera contra la cual se enfrenta el virus es la inmunidad natural a través de mecanismos citolíticos y no citolíticos. Inicialmente se produce liberación de interferón alfa e interleukinas 4 y 10 que establecen una respuesta adaptativa que inicialmente induce una respuesta de linfocitos T CD8+ y luego, una respuesta mediada por linfocitos T CD4+. La infección inicial induce una respuesta masiva de monocitos y los monocitos/macrófagos infectados migran al tejido sinovial de los pacientes infectados crónicamente induciendo la inflamación, lo que explica la persistencia de los síntomas articulares a pesar de la corta duración de la viremia. Los monocitos/macrófagos infectados son los responsables de la diseminación a otros sitios santuarios, tales como el sistema nervioso central y con ello contribuyen al desarrollo de manifestaciones mediadas por una respuesta inmune en exceso.1 Usualmente, la enfermedad es autolimitada, con una duración del curso clínico entre 7 y 10 d. La recuperación se asocia con una respuesta inmune potente que puede conferir protección perenne, pero en algunos casos pueden persistir síntomas crónicos después del aclaramiento viral de la sangre porque puede persistir un reservorio viral activo en las articulaciones.
La artritis y miositis son características de la enfermedad. En su fisiopatogénesis intervienen varios elementos (Fig. 4). El virus tiene varios mecanismos de inhibición de la respuesta antiviral mediada por el interferón. La fase aguda se caracteriza por la extensa diseminación del virus con una respuesta inflamatoria en los órganos diana, definida por la infiltración extensa de linfocitos, células asesinas naturales, neutrófilos y macrófagos. El incremento en los niveles de múltiples citoquinas y quimoquinas proinflamatorias se asocia con la miositis y la artralgia/artritis. Entre ellas están el interferón alfa, la interleukina 6, la proteína de los monocitos 1/CCL-2 y la interleukina 8. Además, la secreción de metaloproteinasas en el tejido articular pudiese contribuir al daño articular.24 El cuadro inmunoquímico local se corresponde entonces con el de una respuesta inmunológica tipo Th-1 que lleva a una disregulación de la respuesta inflamatoria durante las fases aguda y de convalescencia. Esta ausencia de regulación lleva a un proceso inflamatorio nocivo que persiste por más de un año.25
Por último, la fase crónica parece estar relacionada con la persistencia del virus o de sus productos en las células diana con la consecuente acumulación de mediadores inflamatorios tales como la interleukina 6 y el factor estimulador del crecimiento de las colonias de granulocitos – monocitos que provocan hiperplasia sinovial importante. Queda abierta la pregunta de si existiese un proceso autoinmune asociado a la persistencia de la respuesta inflamatoria tal y como ocurre en la artritis reumatoidea (AR).24,26
Manifestaciones clínicas
El cuadro clínico general se denomina fiebre Chikungunya. Su nombre deriva del Makonde, que es un lenguaje hablado al sur de Tanzania y la palabra significa aquel que se encorva. Esto nos da una magnitud de la importancia de la afectación articular que genera el virus en los pacientes. El período de incubación es de 3 a 7 d con un rango de 1 a 12. Pueden llegar a ser asintomáticos del 3 al 25 %4 de las personas infectadas y la enfermedad se desarrolla de forma aguda o subaguda y crónica sin tener ninguna preferencia por sexo ni por edad. Los neonatos, las personas mayores de 65 años y las que presentan algunas enfermedades crónicas como comorbilidades son las más susceptibles a desarrollar la infección grave. La presentación clínica se caracteriza por la presencia de 2 fases: aguda y crónica.
- Fase aguda
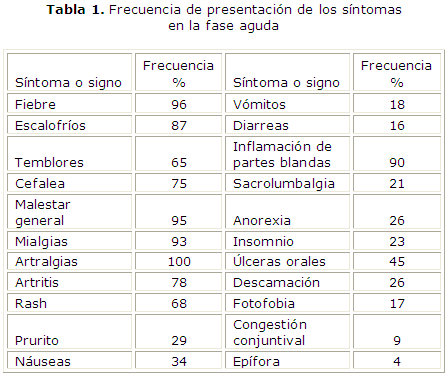
La fase aguda dura generalmente 10 d y existe una triada constituida por fiebre, artralgias y rash.16 La fiebre se presenta abruptamente y alcanza niveles de temperatura corporal superiores a 38.9 ºC, puede ser continua o intermitente, cede poco con el uso de antipiréticos, típicamente dura entre varios días hasta 2 semanas y puede ser bifásica,4 separadas por hasta 3 a 4 semanas.16 Se asocia a otros síntomas generales como cefalea, confusión transitoria, mialgias, fatigas, escalofríos, náuseas, vómitos, anorexia, dolor de espalda, conjuntivitis y otras manifestaciones oculares. Pueden aparecer linfadenopatías cervicales, aunque no son tan frecuentes como en la infección por el O’nyong nyong, otro alfavirus artritogénico. Poco después del inicio de la fiebre aparecen las poliartralgias, que son las que caracterizan el cuadro clínico4 y están presentes en el 100 % de los casos y son las que permiten hacer la diferenciación con otras entidades con cuadro clínico similar como el dengue.1,12,26 Es a lo que más importancia le debemos dar por el hecho de que evolutivamente puede manifestarse de forma crónica. Suelen ser severas y bastante incapacitantes y puede haber inflamación articular importante en hasta el 78 % de los pacientes. Las artritis/artralgias son usualmente simétricas y afectan predominantemente las articulaciones distales y pueden involucrar tanto pequeñas como grandes articulaciones, incluyendo tobillos, rodillas, codos, muñecas y las interfalángicas. Hay también reportes de afectación de hombros, caderas, temporo-mandibulares y esterno-claviculares.27 Pueden ser asimétricas en hasta el 4 % de los casos y manifestarse en forma de poliartritis migratoria o no migratoria. La susceptibilidad para el desarrollo de la afectación articular severa es mayor en pacientes con afectación articular previa como la osteoartrosis u otras artritis. La frecuencia de presentación de los síntomas en la fase aguda se resume en la tabla 1.28
La afectación de la piel ocurre en el 40-50 % de los casos.1 Hacia el día 4 o 5 del cuadro clínico aparece un rash maculopapular, que puede desaparecer a la vitropresión y que se expresa sobre todo al nivel de tórax y extremidades y, en menor proporción, al nivel de la cara. Puede también abarcar las palmas de las manos y las plantas de los pies. Puede ser prurítico o edematoso. Menos frecuentemente se desarrollan la dermatitis exfoliativa con descamación y las lesiones vesículo ampollosas que son casi exclusivas de los neonatos. También puede existir fotosensibilidad, lesiones vasculíticas, úlceras orales y estomatitis, además de petequias, equímosis y gingivorragia, aunque realmente, las manifestaciones hemorrágicas son mucho menos frecuentes e importantes que en el dengue.
La afectación ocular se ve tanto en las fases aguda como crónica de la infección y lo hace en innumerables formas que van de la conjuntivitis hasta la retinitis e incluso la neuritis óptica.1,3,17,22,29,30 En la fase aguda puede existir fotofobia y dolor retrocular, pero lo que más predomina es la presencia de la conjuntivitis y la afectación de la cámara anterior a forma de uveítis anterior granulomatosa y no granulomatosa. En ambas se observan precipitados keráticos pigmentados. Puede ser bilateral y con hipertensión intraocular. Se ha descrito también la iridociclitis y episcleritis. En la fase crónica predomina la afectación de la cámara posterior a forma de neuritis óptica, neuritis retrobulbar y neuroretinitis bilateral. Generalmente, estas alteraciones tienen buen pronóstico, con reversibilidad total, algunos pacientes quedan con visión de 20/30 a 20/60, pero excepcionalmente pueden algunos llegar a quedar con visión de movimientos o ceguera total.29,30 Las manifestaciones oculares, así como el número de referencias bibliográficas que la reportan, se muestran en la tabla 2.17
Hay manifestaciones igualmente atípicas y severas que requieren hospitalización.31 Entre ellas están la meningoencefalitis y las convulsiones, el síndrome de Guillain Barré, el síndrome cerebeloso, las paresias, la parálisis fláccida aguda y la neuropatía. Al nivel cardiovascular puede haber miocarditis, pericarditis, insuficiencia cardíaca y arritmias. También se reporta la hepatitis fulminante en pacientes con hepatopatías crónicas, la pancreatitis, desórdenes endocrinos, la epidermólisis extensa, el fallo respiratorio y la afectación renal a forma de insuficiencia renal aguda. Se ha reportado la ocurrencia de desencadenamiento de psoriasis en el curso de la fase aguda.16 La mortalidad generalmente es rara, pero es mayor en neonatos y adultos mayores o con enfermedades crónicas concomitantes.
- Fase crónica
Se define por la persistencia de síntomas durante más de 3 meses y provoca un deterioro importante de la calidad de vida imponiendo grandes restricciones al normal desenvolvimiento de las actividades diarias, lo que motiva largas restricciones de la actividad laboral y productiva31 y, consecuentemente, un gran impacto en la economía de los lugares en donde ocurren grandes brotes epidémicos. Hasta el 12 % de los pacientes presentan rigidez matinal o dolor articular persistente incluso hasta por 3 años o más. Puede generar artropatía crónica destructiva, tenosinovitis y hay algunos casos en los cuales se ha evidenciado similitud importante con la AR. Además se presenta fiebre recurrente, entumecimientos, fatiga crónica y periartritis al nivel de los hombros.
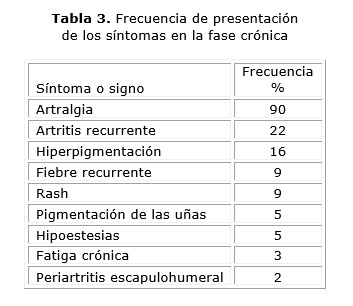
En el orden dermatológico se puede evidenciar la hiperpigmentación fotosensible, las úlceras intertriginosas, rash, pigmentación de las uñas, dermatosis y lesiones tipo vasculitis y otras como discrasias sanguíneas, neumonía, insuficiencia respiratoria, hepatitis que puede evolucionar a su forma fulminante, pancreatitis y secreción inadecuada de hormona antidiurética. La frecuencia de presentación de estos síntomas se presenta en la tabla 3.28
El espectro de afectaciones musculo-esqueléticas puede verse reflejado en la tabla 4, donde se ven los reportes hechos de cada manifestación en la literatura científica.27
Las artralgias y las artritis con sinovitis objetiva se presentan tanto en la fase aguda como en la crónica. Las artralgias/artritis en la fase crónica se presentan en hasta el 64 % de los pacientes que tuvieron un cuadro de fiebre Chikungunya.32 El dolor es continuo o intermitente, o incluso puede ser bimodal, con resolución en la fase aguda y reaparición posteriormente en hasta el 18 % de los pacientes y ocurrir tan rápido como a 10 d después de su presentación. También se ha reportado tenosinovitis, que puede ser más frecuente que la sinovitis y, en algunos reportes, incluso que la artralgia/artritis. Se han descrito asimismo los dolores vertebrales, mialgias generalizadas, síndrome de los túneles carpiano, cubital y tarsal, crioglobulinas, síndrome de Raynaud, presencia de factor reumatoideo, anticuerpos antipéptido citrulinado, HLA-B27 y erosiones en radiografías de articulaciones o en la resonancia magnética nuclear.
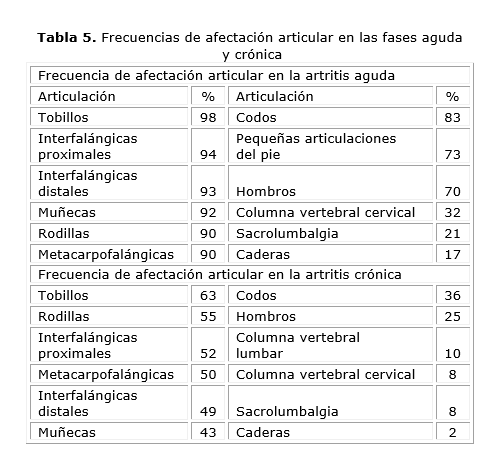
El compromiso articular suele ser diferente en las fases aguda y crónica, lo que se muestra en la tabla 5.28 En la fase aguda predominan las afectaciones en tobillos, interfalángicas proximales, distales, muñecas, rodillas y metacarpofalángicas, mientras que en la crónica se afectan en orden de frecuencia, igualmente los tobillos, pero las rodillas lo hacen con mayor frecuencia que las interfalángicas proximales.
El número de individuos afectados por la artritis/artralgia disminuye con el tiempo. Entre el 88 y el 100 % de los individuos estarán aquejados de ello durante las primeras 6 semanas de la infección y, posteriormente, esto decrecerá hasta un 12 % a los 3 a 5 años con reportes de individuos afectados hasta los 8 años.27,33
Relación con la artritis reumatoidea
Desde las primeras descripciones de la enfermedad articular crónica se evidenció la similitud de los síntomas con los de la AR 4,16,25,32,34,35 e incluso se ha considerado la posibilidad de que la infección por el CHIKV constituya un factor desencadenante y etiológico de la AR. En una investigación realizada en la India28 se le realizó biopsia sinovial a 3 pacientes con artritis persistente y todos mostraron un cuadro histopatológico de sinovitis crónica. La naturaleza crónica de las artralgias y la artritis destructiva llevó a pensar en la persistencia viral en el tejido articular. La persistencia de anticuerpos específicos de tipo IgM anti-CHIKV frecuente en estos pacientes apoya lo antes planteado, lo cual siempre ha sido atribuido a continua exposición al antígeno.3,12,26,27,31,36,37 La evidencia llegó con la detección del antígeno viral y RNA en tejido sinovial de un paciente con artralgia crónica por 18 meses, después de la infección inicial por el CHIKV.3,38
En un estudio de seguimiento a 21 casos,39 que se dieron en la isla Reunión, del año 2006 al año 2007, se diagnosticó la AR con los criterios del Colegio Americano de Reumatología del año 87. El tiempo promedio en que se hizo el diagnóstico fue de 10 meses posteriores al inicio de la fiebre por CHIKV. El 51 % de los pacientes fueron seropositivos al factor reumatoideo y el 28 % lo fue para los anticuerpos antipéptido citrulinado. El 66,6 % los fue para uno o el otro. El 80 % tuvo alteraciones óseas y articulares radiográficas dadas por erosiones y estrechamientos articulares. Casi todos los que tuvieron radiografías normales, mostraron erosiones en las manos a través de la resonancia magnética nuclear. Estas manifestaciones imagenológicas empeoraron evolutivamente a pesar del tratamiento. Aunque nunca se ha demostrado, se ha sugerido que existe un papel de algunos virus como el de Epstein Barr, el parvovirus B19 y otros, en la patogénesis de la AR. Esto, junto a la demostración de sinovitis crónica con presencia de ADN del CHIKV y el claro diagnóstico de AR tras la infección por este virus, sugiere que el virus haya tenido algún papel en su iniciación. Hasta ahora no se ha podido demostrar la coexistencia de un mecanismo autoinmune con la persistencia de una respuesta inflamatoria, tal y como sucede en la AR.24
Diagnóstico
En el hemograma suele haber leucopenia con linfocitopenia. La trombocitopenia es muy infrecuente y este detalle constituye un elemento de gran peso para hacer el diagnóstico clínico diferencial con el dengue. La eritrosedimentación y la proteína C reactiva generalmente son normales, aunque pueden estar ligeramente elevadas.1
El diagnóstico confirmatorio es a través de pruebas virológicas y/o serológicas.1,3,7-9,13,27,31,40-43 En los primeros 3 d de la enfermedad puede lograrse el cultivo viral y la PCR en tiempo real, en la que se pueden detectar las proteínas específicas virales, estructurales o no estructurales, y tienen excelentes sensibilidad y especificidad.
Los anticuerpos IgM se hacen positivos entre los días 2 y 7. Luego se pueden detectar anticuerpos IgG a partir del día 7 y se puede lograr confirmación a través de muestras pareadas con 14 d de separación con demostración de títulos ascendentes superiores a 4 veces entre los períodos de estado y convalecencia. Existen múltiples kits serológicos de diferentes métodos.
En la figura 5 se muestran las curvas de expresión de la viremia y la serología específica. La fase de viremia abarca desde los 10 a 12 d antes de la aparición de los síntomas hasta el día 8 o 9. Los anticuerpos IgM aparecen entre el tercer y cuarto días (aunque hay reportes que los sitúan a partir del segundo) y la IgG entre el sexto y séptimo.
En la tabla 6 se muestra el momento de la infección en que pueden ser realizadas las diferentes pruebas diagnósticas de confirmación.
Para la definición de caso se tienen en cuenta criterios clínicos y epidemiológicos. Dentro de los primeros están fiebre >38,5 ºC (101,3 ºF) y artralgia severa o artritis de comienzo agudo, que no se explican por otras condiciones médicas, y como criterio epidemiológico se considera el hecho de residir o haber visitado áreas epidémicas o endémicas durante las 2 semanas anteriores al inicio de los síntomas.
Para definir un caso sospechoso se considera a aquel que cumple tanto criterios clínicos como epidemiológicos y el caso confirmado es aquel que además de tener los criterios de sospechoso, ha sido confirmado por el laboratorio a través de alguna de las siguientes pruebas diagnósticas específicas:44
- Aislamiento viral.
- Detección de ARN viral por RT-PCR.
· Detección de IgM en una sola muestra de suero (recogida durante la fase aguda o convaleciente).
· Aumento de 4 veces en el título de anticuerpos específicos para CHIKV (muestras recogidas con al menos 2 a 3 semanas de diferencia).
En el diagnóstico diferencial se debe tener en consideración particularmente el dengue, así como la malaria, la leptospirosis, la meningoencefalitis, las artritis posinfecciosas y otras infecciones por virus como el mayaru, rubeola, sarampión, las ricketsiosis y otras. Incluso abundan los casos de coexistencia de epidemias y de coinfecciones en individuos por algunas de ellas. Caben destacarse las asociaciones de CHIKV con el dengue,45-48 la leptospirosis,49 la ricketsiosis50 o la fiebre amarilla.51
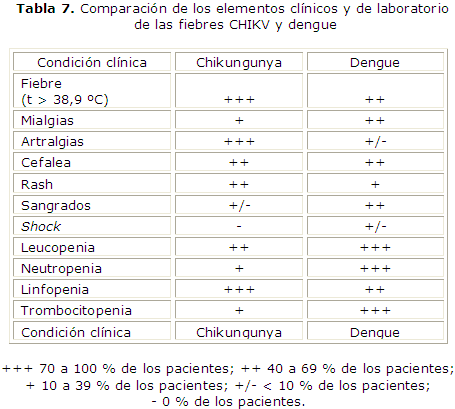
En el diagnóstico diferencial con el dengue hay 2 cosas relevantes. Las artralgias tienden a ser más predominantes en la afectación por el CHIKV, se presentan en el 70-100 % de los pacientes. La trombocitopenia es mucho más frecuente en la infección por dengue. Igualmente, las manifestaciones hemorrágicas, la evolución hacia un estado de shock es mucho más frecuente en el caso del dengue. Y como decíamos previamente, la trombocitopenia, sin dejar de estar presente en el CHIKV, predomina tanto por su frecuencia como por su magnitud en el dengue (tabla 7).4,13,31
Tratamiento y prevención
No existe un tratamiento farmacológico antiviral específico. Se recomienda el tratamiento sintomático luego de excluir enfermedades más graves como malaria, dengue e infecciones bacterianas. Hasta ahora lo que se ha realizado es la indicación de reposo y el uso de acetaminofén o paracetamol, para el alivio de la fiebre, e ibuprofeno, naproxeno o algún otro agente antiinflamatorio no esteroideo (AINE) para aliviar el componente artrítico de la enfermedad.1,3,7,8,28,41 No se aconseja el uso de aspirina por el riesgo de sangrado en un número reducido de pacientes y el de desarrollar síndrome de Reye en niños menores de 12 años de edad.16 En pacientes con dolor articular grave que no se alivia con AINEs se pueden utilizar analgésicos narcóticos (por ejemplo, la morfina) o corticoesteroides a corto plazo después de hacer una evaluación riesgo-beneficio de estos tratamientos. Se debe aconsejar a los pacientes beber grandes cantidades de líquidos para reponer el líquido perdido por la sudación, los vómitos y otras pérdidas insensibles.
En los casos con artralgia/artritis crónica se ha utilizado el fosfato de cloroquina con resultados contradictorios, por lo que actualmente su utilidad se encuentra en controversia.1 La artritis periférica incapacitante que tiene tendencia a persistir por meses, si es refractaria a otros agentes, puede ocasionalmente responder a los corticosteroides a corto plazo. Para limitar el uso de corticosteroides orales se pueden usar inyecciones locales (intra-articulares) de corticosteroides o terapia tópica con AINEs. En pacientes con síntomas articulares refractarios se pueden evaluar terapias alternativas como el metotrexato, con lo cual se han reportado buenos resultados, aunque un grupo importante de pacientes requieren pasar a utilizar los bloqueantes del factor de necrosis tumoral.
La ribavirina (200 mg 2 veces al día / 7 d) a pacientes con artralgias severas o artritis persistentes, por 2 semanas después de la infección inicial, al parecer ha logrado una resolución más rápida de las manifestaciones articulares y de partes blandas. Además, han sido probados in vitro otros agentes antivirales con resultados satisfactorios como son el 6-azauridine, el arbidol, la harringtonina y el interferón alfa 2b combinado con la ribavirina. Así mismo, se encuentran bajo investigación varias modalidades de terapia génica como las moléculas de interferencia con el ARN y otras.52 Igualmente se encuentran en estudio los inhibidores de la quimiotaxis de los monocitos, por haberse demostrado que alivian la artritis provocada por alfavirus en el ratón.
Además de la farmacoterapia, los casos con artralgias prolongadas y rigidez articular pueden beneficiarse con un programa progresivo de fisioterapia. El movimiento y el ejercicio moderado tienden a mejorar la rigidez matinal y el dolor, pero el ejercicio intenso puede exacerbar los síntomas. Los casos de oftalmopatía suelen mejorar considerablemente y en forma relativamente rápida con el uso de esteroides tópicos o sistémicos y en casos de hipertensión intraocular, con el tratamiento antiglaucomatoso.17
Las inmunoglobulinas polivalentes humanas específicas de suero de convalecientes han demostrado gran eficacia en la prevención y tratamiento en infecciones animales in vivo, por lo cual podría ser utilizado en seres humanos para la prevención y el tratamiento, especialmente en los individuos con alto riesgo para desarrollar enfermedad severa, tales como los neonatos nacidos de madres virémicas y los adultos con comorbilidades.
La vacunación sería el método ideal de prevención de la infección y control de brotes en una enfermedad infecciosa que induce inmunidad perenne. Hasta ahora se han desarrollado múltiples candidatos vacunales.1,3,8,9,12,13,52,53 Se han probado múltiples estrategias entre las que se encuentran la preparación de virus completo inactivado, vacunas vivas atenuadas, proteínas recombinantes o partículas similares al virus y vacunación de DNA, pero ninguna ha sido licenciada y algunas han sido abandonadas. Por lo tanto, hasta ahora la prevención radica en la protección contra la picada del mosquito y el control del vector. La protección individual se puede lograr a través del uso de mosquiteros impregnados en repelentes como la permetrina, el uso de ropas que cubran las zonas de la piel normalmente expuestas a la picada de los insectos. El control del Aedes aegypti ha sido muy ocasionalmente logrado y nunca ha sido sostenido. El diclorodifeniltricloroetano aunque eficaz contra el Aedes aegypti, no lo ha sido contra el Aedes albopictus. Las medidas de control del brote están dadas principalmente por la eliminación de los focos de larvas de mosquitos, evitar los viajes a las zonas de transmisión e informar a los turistas o a las personas que deseen viajar sobre los sitios en los que se ha reportado transmisión, sobre todo aquellas personas que son susceptibles de llegar a la mortalidad por sus condiciones de edad y sus condiciones subyacentes.
Se concluye que la fiebre Chikungunya es una enfermedad viral que viene presentándose hace más de 60 años en forma de ciclos interepidémicos que oscilan entre 4 y 30 años, pero que en este momento se considera como una infección tanto emergente como reemergente. Tiene manifestaciones muy similares al dengue, pero se diferencia por la marcada afectación articular, la tendencia a la cronicidad del cuadro y la trombocitopenia que es casi ausente o mínima.
Se ha extendido recientemente a áreas del Caribe e islas cercanas a Cuba y ya estamos hablando de más de 300 000 casos en esas islas por lo que debemos estar preparados para la llegada de dicha enfermedad a nuestro país y ante su presencia, más que tratarla, porque realmente no hay tratamiento específico, lo que debemos hacer es intentar detectar tempranamente al portador del virus para así prevenir la transmisión y el desarrollo de altas tasas de morbilidad futuras.
Agradecimientos
Paola Martínez Fiterre por su cortesía en la confección de las ilustraciones.
REFERENCIAS BIBLIOGRÁFICAS
3. Burt FJ, Rolph MS, Rulli NE, Mahalingam S, Heise MT. Chikungunya: a re-emerging virus. Lancet. 2012;379(9816):662-71. Epub 2011/11/22.
4. Staples JE, Breiman RF, Powers AM. Chikungunya fever: an epidemiological review of a re-emerging infectious disease. Clinical Infectious Diseases. 2009;49(6):942-8. Epub 2009/08/12.
5. PAHO/WHO. Number of Reported Cases of Chikungunya Fever in the Americas, by Country or Territory with Autochthonous Transmission 2013-2014 (to week noted). Epidemiological Week/EW 28 (Updated 11 July 2014). 2014. [acceso 15 de julio del 2014]. Disponible en: http://www.paho.org/hq/index.php?option=com_topics&view=article&id=343&Itemid=40931&lang=en
6. Tsetsarkin KA, Chen R, Sherman MB, Weaver SC. Chikungunya virus: evolution and genetic determinants of emergence. Current opinion in virology. 2011;1(4):310-7. Epub 2011/10/04.
7. Pialoux G, Gauzere BA, Jaureguiberry S, Strobel M. Chikungunya, an epidemic arbovirosis. The Lancet Infectious Diseases. 2007;7(5):319-27. Epub 2007/04/24.
8. Cavrini F, Gaibani P, Pierro AM, Rossini G, Landini MP, Sambri V. Chikungunya: an emerging and spreading arthropod-borne viral disease. Journal of Infection in Developing Countries. 2009;3(10):744-52. Epub 2009/12/17.
9. Sudeep AB, Parashar D. Chikungunya: an overview. Journal of Biosciences. 2008;33(4):443-9. Epub 2009/02/12.
10. Chevillon C, Briant L, Renaud F, Devaux C. The Chikungunya threat: an ecological and evolutionary perspective. Trends in Microbiology. 2008;16(2):80-8. Epub 2008/01/15.
11. Petersen LR, Stramer SL, Powers AM. Chikungunya virus: possible impact on transfusion medicine. Transfusion Medicine Reviews. 2010;24(1):15-21. Epub 2009/12/08.
12. Pulmanausahakul R, Roytrakul S, Auewarakul P, Smith DR. Chikungunya in Southeast Asia: understanding the emergence and finding solutions. International journal of infectious diseases (IJID). Official publication of the International Society for Infectious Diseases. 2011;15(10):e671-6. Epub 2011/07/22.
13. Thiboutot MM, Kannan S, Kawalekar OU, Shedlock DJ, Khan AS, Sarangan G, et al. Chikungunya: a potentially emerging epidemic? PLoS Neglected Tropical Diseases. 2010;4(4):e623. Epub 2010/05/04.
14. Tyler KL. Emerging viral infections of the central nervous system: part 2. Archives of Neurology. 2009;66(9):1065-74. Epub 2009/09/16.
15. Haas H, Robin S, Ramful D, Houdon L, Minodier P, Gerardin P. Chikungunya virus infections in children. Archives de Pediatrie. 2009;16(Suppl 2):S72-9. Epub 2009/10/20.
16. Kucharz EJ, Cebula-Byrska I. Chikungunya fever. European Journal of Internal Medicine. 2012;23(4):325-9. Epub 2012/05/09.
17. Mahendradas P, Avadhani K, Shetty R. Chikungunya and the eye: a review. Journal of Ophthalmic Inflammation and Infection. 2013;3(1):35. Epub 2013/03/22.
18. Robillard PY, Boumahni B, Gerardin P, Michault A, Fourmaintraux A, Schuffenecker I, et al. Vertical maternal fetal transmission of the chikungunya virus. Ten cases among 84 pregnant women. Presse Med. 2006;35(5 Pt 1):785-8. Epub 2006/05/20.
19. Gerardin P, Barau G, Michault A, Bintner M, Randrianaivo H, Choker G, et al. Multidisciplinary prospective study of mother-to-child chikungunya virus infections on the island of La Reunion. PLoS Medicine. 2008;5(3):e60. Epub 2008/03/21.
20. Ramful D, Carbonnier M, Pasquet M, Bouhmani B, Ghazouani J, Noormahomed T, et al. Mother-to-child transmission of Chikungunya virus infection. The Pediatric Infectious Disease Journal. 2007;26(9):811-5. Epub 2007/08/28.
21. Das T, Jaffar-Bandjee MC, Hoarau JJ, Krejbich Trotot P, Denizot M, Lee-Pat-Yuen G, et al. Chikungunya fever: CNS infection and pathologies of a re-emerging arbovirus. Progress in Neurobiology. 2010;91(2):121-9. Epub 2009/12/23.
22. Couderc T, Gangneux N, Chretien F, Caro V, Le Luong T, Ducloux B, et al. Chikungunya virus infection of corneal grafts. The Journal of Infectious Diseases. 2012;206(6):851-9. Epub 2012/06/19.
23. Long KM, Heise MT. Chikungunya virus transmission-more than meets the eye. The Journal of Infectious Diseases. 2012;206(6):806-7. Epub 2012/06/19.
24. Assuncao-Miranda I, Cruz-Oliveira C, Da Poian AT. Molecular mechanisms involved in the pathogenesis of alphavirus-induced arthritis. BioMed Research International. 2013;2013:973516. Epub 2013/09/27.
25. Dupuis-Maguiraga L, Noret M, Brun S, Le Grand R, Gras G, Roques P. Chikungunya disease: infection-associated markers from the acute to the chronic phase of arbovirus-induced arthralgia. PLoS Neglected Tropical Diseases. 2012;6(3):e1446. Epub 2012/04/06.
26. Jaffar-Bandjee MC, Das T, Hoarau JJ, Krejbich Trotot P, Denizot M, Ribera A, et al. Chikungunya virus takes centre stage in virally induced arthritis: possible cellular and molecular mechanisms to pathogenesis. Microbes and Infection / Institut Pasteur. 2009;11(14-15):1206-18. Epub 2009/10/20.
27. Waymouth HE, Zoutman DE, Towheed TE. Chikungunya-related arthritis: case report and review of the literature. Seminars in Arthritis and Rheumatism. 2013;43(2):273-8. Epub 2013/04/24.
28. Binoy JP, Geetha P, Shanu PM, Emil JT. Clinical profile and long-term sequelae of Chikungunya fever. Indian Journal of Rheumatology. 2011;6(1):12-9.
29. Mahendradas P, Ranganna SK, Shetty R, Balu R, Narayana KM, Babu RB, et al. Ocular manifestations associated with chikungunya. Ophthalmology. 2008;115(2):287-91. Epub 2007/07/17.
30. Lalitha P, Rathinam S, Banushree K, Maheshkumar S, Vijayakumar R, Sathe P. Ocular involvement associated with an epidemic outbreak of chikungunya virus infection. American Journal of Ophthalmology. 2007;144(4):552-6. Epub 2007/08/19.
31. Simon F, Javelle E, Oliver M, Leparc-Goffart I, Marimoutou C. Chikungunya virus infection. Current Infectious Disease Reports. 2011;13(3):218-28. Epub 2011/04/06.
32. Ali Ou Alla S, Combe B. Arthritis after infection with Chikungunya virus. Best Practice & Research Clinical Rheumatology. 2011;25(3):337-46. Epub 2011/11/22.
33. de Andrade DC, Jean S, Clavelou P, Dallel R, Bouhassira D. Chronic pain associated with the Chikungunya Fever: long lasting burden of an acute illness. BMC Infectious Diseases. 2010;10:31. Epub 2010/02/23.
34. Fourie ED, Morrison JG. Rheumatoid arthritic syndrome after chikungunya fever. South African Medical Journal = Suid-Afrikaanse Tydskrif Vir Geneeskunde. 1979;56(4):130-2. Epub 1979/07/28.
35. Brighton SW, Simson IW. A destructive arthropathy following Chikungunya virus arthritis--a possible association. Clinical Rheumatology. 1984;3(2):253-8. Epub 1984/06/01.
36. Gerardin P, Fianu A, Michault A, Mussard C, Boussaid K, Rollot O, et al. Predictors of Chikungunya rheumatism: a prognostic survey ancillary to the TELECHIK cohort study. Arthritis Research & Therapy. 2013;15(1):R9. Epub 2013/01/11.
37. Malvy D, Ezzedine K, Mamani-Matsuda M, Autran B, Tolou H, Receveur MC, et al. Destructive arthritis in a patient with chikungunya virus infection with persistent specific IgM antibodies. BMC Infectious Diseases. 2009;9:200. Epub 2009/12/17.
38. Hoarau JJ, Jaffar Bandjee MC, Krejbich Trotot P, Das T, Li-Pat-Yuen G, Dassa B, et al. Persistent chronic inflammation and infection by Chikungunya arthritogenic alphavirus in spite of a robust host immune response. J Immunol. 2010;184(10):5914-27. Epub 2010/04/21.
39. Bouquillard E, Combe B. A report of 21 cases of rheumatoid arthritis following Chikungunya fever. A mean follow-up of two years. Joint, bone, spine: Revue Du Rhumatisme. 2009;76(6):654-7. Epub 2009/12/01.
40. Ziegler SA, Nuckols J, McGee CE, Huang YJ, Vanlandingham DL, Tesh RB, et al. In vivo imaging of chikungunya virus in mice and Aedes mosquitoes using a Renilla luciferase clone. Vector Borne Zoonotic Dis. 2011;11(11):1471-7. Epub 2011/06/15.
41. Nakoune E, Finance C, Le Faou A, Rihn B. The Chikungunya virus. Annales de Biologie Clinique. 2007;65(4):349-56. Epub 2007/07/14.
42. Edwards CJ, Welch SR, Chamberlain J, Hewson R, Tolley H, Cane PA, et al. Molecular diagnosis and analysis of Chikungunya virus. Journal of Clinical Virology. 2007;39(4):271-5. Epub 2007/07/14.
43. Parida MM, Santhosh SR, Dash PK, Tripathi NK, Lakshmi V, Mamidi N, et al. Rapid and real-time detection of Chikungunya virus by reverse transcription loop-mediated isothermal amplification assay. Journal of Clinical Microbiology. 2007;45(2):351-7. Epub 2006/12/01.
44. PAHO/CDC. Preparedness and Response for Chikungunya virus introduction in the Americas. 2011. [citado 15 jul. 2014]. Disponible en: http://www.paho.org/hq/index.php?option=com_docman&task=doc_download&gid=16984&Itemid=&lang=en
45. Schilling S, Emmerich P, Gunther S, Schmidt-Chanasit J. Dengue and Chikungunya virus co-infection in a German traveller. Journal of clinical virology: the official publication of the Pan American Society for Clinical Virology. 2009;45(2):163-4. Epub 2009/05/16.
46. Chahar HS, Bharaj P, Dar L, Guleria R, Kabra SK, Broor S. Co-infections with chikungunya virus and dengue virus in Delhi, India. Emerging Infectious Diseases. 2009;15(7):1077-80. Epub 2009/07/25.
47. Chang SF, Su CL, Shu PY, Yang CF, Liao TL, Cheng CH, et al. Concurrent isolation of chikungunya virus and dengue virus from a patient with coinfection resulting from a trip to Singapore. Journal of Clinical Microbiology. 2010;48(12):4586-9. Epub 2010/10/01.
48. Parreira R, Centeno-Lima S, Lopes A, Portugal-Calisto D, Constantino A, Nina J. Dengue virus serotype 4 and chikungunya virus coinfection in a traveller returning from Luanda, Angola, January 2014. Euro Surveillance. 2014;19(10). Epub 2014/03/22.
49. Renault P, Boidin E, D'Ortenzio E, Balleydier E, Daniel B, Filleul L. Epidemiological surveillance of leptospirosis on Reunion Island in 2004-2008: possible impact of Chikungunya infection on the case fatality rate of leptospirosis. Bull Soc Pathol Exot. 2011;104(2):148-52. Epub 2010/12/22.
50. Premaratna R, Halambarachchige LP, Nanayakkara DM, Chandrasena TG, Rajapakse RP, Bandara NK, et al. Evidence of acute rickettsioses among patients presumed to have chikungunya fever during the chikungunya outbreak in Sri Lanka. International Journal of Infectious Diseases. 2011;15(12):e871-3. Epub 2011/10/25.
51. Filipe AF, Pinto MR. Arbovirus studies in Luanda, Angola. 2. Virological and serological studies during an outbreak of dengue-like disease caused by the Chikungunya virus. Bulletin of the World Health Organization. 1973;49(1):37-40. Epub 1973/01/01.
52. Parashar D, Cherian S. Antiviral Perspectives for Chikungunya Virus. BioMed Research International. 2014;2014:631-42. Epub 2014/06/24.
53. Weaver SC, Osorio JE, Livengood JA, Chen R, Stinchcomb DT. Chikungunya virus and prospects for a vaccine. Expert Review of Vaccines. 2012;11(9):1087-101. Epub 2012/11/16.
Recibido: 27 de enero de 2015.
Aprobado: 20 de febrero de 2015.
Dr. Liodelvio Martínez Fernández. Hospital Clinicoquirúrgico "Hermanos Ameijeiras", San Lázaro No. 701 entre Belascoaín y Marqués González, Centro Habana, La Habana, Cuba. CP 10300. liodelvio@infomed.sld.cu