Introducción
Dentro de las enfermedades crónicas no trasmisibles, la enfermedad renal crónica (ERC), es la cuarta causa de muerte en países desarrollados, luego de las enfermedades cardíacas, cerebro-vasculares y el cáncer. Se considera más que una epidemia, como pandemia, debido a su crecimiento exponencial.1
El trasplante renal (TxR) es la mejor opción terapéutica desde el punto de vista biológico y económico para pacientes con ERC avanzada y para los sistemas de salud. Estos se han logrado realizar en su mayor proporción con riñones provenientes de donante cadáver (DC), pese que a inicios de la trasplantología los primeros fueron a predominio del donante vivo (DV).2
Cuba es uno de los países en la región de Latinoamérica que expone las mejores tasas de trasplantes por millón de habitantes y la mayor parte de ellos, con órganos de donante cadáver, como se comportan los países desarrollados.3 En 1994 fue la mayor tasa de la historia de la trasplantología cubana. El país se situó en el primer lugar en toda la región, después de nueve programas de países desarrollados con una tasa de 22 pmh.4
Una vez realizado como todo método alternativo a sustituir la función renal tiene vida limitada. Las dos primeras causas por las que se pierde el injerto y que entre ambas representan más del 80 % es la muerte del paciente y en segundo lugar, la nefropatía crónica del injerto (NCI).5,6 Los reportes de países desarrollados plantean que la vida media (VM) del trasplante cadavérico se encuentra entre los 10 y 13 años, no más, pese al desarrollo que se ha logrado con modernas técnicas quirúrgicas y potentes inmunosupresores. Para el donante vivo la vida media sobrepasa los 30 y 35 años.7
La diferencia de sobrevidas del donante vivo v/s cadavérico están dadas fundamentalmente porque en los primeros se encuentran los más compatibles ya que su fuente fundamental de donantes ha sido hasta hace muy poco tiempo un familiar de primer y segundo grado de consanguinidad. Por leyes biológicas comparten mejor compatibilidad inmunológica. Estos son antígenos producto de los genes que se sitúan en el sexto par de cromosomas y que se expresan en los leucocitos humanos. Desde el principio se les conoció como antígenos leucocitarios humanos y fueron nombrados en inglés human leukocyte antigens (HLA).8
Con los años, y en la búsqueda de nuevas fuentes de donantes ante la escasez de donante cadáver se ha empleado una modalidad entre vivos y es los no emparentados, al que se le denomina emocionalmente relacionado y están constituidos por los conyugues y los amigos.
Algunos consideran que la isquemia fría menor en el trasplante entre vivos, es lo que garantiza el éxito al comparar con el trasplante cadavérico. Sin embargo, la mayor parte de los autores dan más importancia a la mejor compatibilidad inmunológica entre el donante y el receptor.9,10,11,12,13
No existe reporte alguno en el país de cómo se comporta la vida media del trasplante. El estudio se propone describir el volumen de trasplantes desde 1970, que representa casi la mitad de los realizados en el Instituto de Nefrología. Por otra parte, como la especialidad acogió desde muy temprano la asignación y distribución de los órganos sobre todo por la compatibilidad inmunológica para el HLA. Esta investigación puede ser útil para llegar a conclusiones y/o recomendaciones.
Métodos
El Universo de estudio estuvo constituido por los 512 trasplantes realizados entre el 1ro de enero de 1993 al 31 de diciembre de 2010 y se continuó la muestra hasta el 31 de diciembre 2019 sin excluir ningún caso. Se tuvo en cuenta fecha de última noticia para la función renal o del paciente, no es más que la última constancia escrita en la institución de haber sido visto el enfermo, también se definió como variable el estado del paciente vivo o fallecido, así como el estado del órgano de su funcionamiento. Se expone supervivencia del injerto, pero está implícita la muerte del paciente, incluso con el riñón en funcionamiento, por eso muchos autores le denominan también supervivencia global o total, donde todo riñón perdido sea cual fuese la causa cuenta en el análisis. Las fuentes de información fueron las historias clínicas que se tienen en el archivo de la institución (modelo 54-01-1), más los protocolos de necropsias o el certificado de defunción en casos sin necropsias. Los datos se llevaron a una base de datos y se procedió al cálculo del tiempo de observación individual del órgano y del paciente, tiempos de supervivencias, como la diferencia del tiempo en años entre la fecha del trasplante y las últimas noticias del órgano y del paciente. Posteriormente de las técnicas de análisis de supervivencia, fue empleado el método de Kaplan Meier para estimar la curva de supervivencia en ambos casos, por el paquete estadístico Spss 22.0. Este mismo tipo de análisis también se realizó para el grado de compatibilidad inmunológica HLA entre donante y receptor. Las curvas de supervivencia fueron comparadas unas con otras y se utilizó el Test de long rank para los que tuvieron distribución proporcional. En caso contrario se utilizó el Test de Breslow. Se fijó un nivel de significación alfa=0,05. Se empleó la técnica estadística de análisis de distribución de frecuencias. Fueron calculadas las frecuencias absolutas y relativas y estas últimas se expresaron en porcentajes.
Resultados
De los 397 trasplantes con donante cadáver al momento del corte, 45 mantuvieron función renal para un 11,3 % y el resto la había perdido. Para los 115 de donantes vivo conservaron la función 52 pacientes para un 45,2 %. La sobrevida del TxR donante vivo, es cuatro veces superior v/s a la del cadavérico, p=0,000 y comparado con el donante vivo, su riesgo relativo es de 1,62 (Tabla 1).
Tabla 1 Función del injerto renal según tipo de donante

Log Rank (Mantel-Cox) 66,133 Chi-Cuadrado, p=0,000
Cuando se analiza la supervivencia, nótese como la mediana, para el trasplante entre vivos, es de 16,0 años (DS 9,1 - 22,9), cinco veces mayor al trasplante cadavérico, para 3,1 años (DS 2,4 - 3,8), p=0,000 (Tabla 2).
Tabla 2 Mediana, intervalo de confianza al 95 %, de la supervivencia del injerto renal según tipo de donante

*En años.
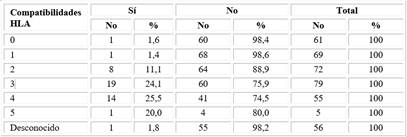
Al subdividir los trasplantes cadavéricos atendido al número de compatibilidades HLA entre donante y receptor, es evidente que al tener mayor compatibilidad tienen una función renal más prolongada, específicamente aquellos que fueron trasplantados con tres o más compatibilidades HLA, comparados con el resto, p=0,002 (Tabla 3).
En el análisis realizado se reagrupan en tres grupos, y se evidencia mejor sobrevida en los trasplantes cadavéricos, cuando se comparten tres o más antígenos HLA entre donante y receptor con vida media de 5,4 años, no se logra con aquellos que tenían menos de tres compatibilidades p=0,03. No ocurrió en los 56 pacientes que fueron trasplantados sin haberse conocido y/o no realizado el HLA tanto al donante como al receptor en lista de espera en el momento del TxR (Tabla 4).
Tabla 4 Mediana, intervalo de confianza al 95 %, de la supervivencia del injerto renal de donante cadáver según número de compatibilidades HLA

p =0, 033 *En años.
Cuando se subdivide el grado de parentesco entre donante y receptor se observa como los trasplantes con donante hermanos fueron la mayoría, 64 de los 115, tienen más receptores de injertos con función renal al momento del corte que cuando el donante fue uno de los padres o un hijo, 51,6 % v/s 38,1 % y 33,3 %, respectivamente, p=0,01 (Tabla 5).
Para el caso de los trasplantes entre vivos el compartir todas las compatibilidades estudiadas (seis), los receptores de esos hermanos idénticos para HLA, exhibieron las mejores sobrevidas con un 60,0 % de función v/s 44,2 % para los que compartían tan solo un haplotipo es decir tres compatibilidades y 0 % para el único hermano que solo compartía una compatibilidad HLA (Tabla 6) p=0,001.
Discusión
La muestra está constituida en mayor proporción por pacientes con trasplante donante cadáver v/s vivo, como mismo ha ocurrido en la historia del trasplante renal en Cuba por todos los centros y épocas. Ha sido así en la inmensa mayoría de países desarrollados.3 Estos sistemas socioeconómicos evitaron desde los inicios mutilar donantes vivos, y rápidamente trabajaron con el donante en muerte encefálica. Una fuerte base bioética, les ha permitido concientizar a grandes grupos poblacionales para aceptar este tipo de donante cadavérico. Cuba es una excepción al igual que Uruguay, únicos países latinoamericanos donde más del 90 % de los trasplantes provienen de donante cadavérico.5,14 Para lograrlo es indispensable el desarrollo en los laboratorios, para el estudio inmunológico pretrasplante de los candidatos en listas de espera y luego seleccionar la mejor pareja donante - receptor por normas biológicas donde predomine la compatibilidad HLA, que es sin dudas la que garantiza las mejores sobrevidas a mediano y largo plazo.8,15
Aunque algunos estudios recientes limitados por el tiempo y la cantidad de receptores han demostrado que cuando su utilizan los inmunosupresores de última generación las compatibilidades HLA no se relacionan con la supervivencia, aún las grandes series y estudios multicéntricos evidenciaron que a mayor compatibilidad HLA mayor es la sobrevida de los pacientes cuando los riñones provienen de donantes fallecidos.16
A nivel internacional la realización de trasplantes entre vivos ha significado en un incremento de cuatro a cinco veces la supervivencia de los injertos, respecto al cadavérico, lo mismo que se ha observado en esta investigación.2,10,12,15 Basados en este principio no se propuso hacer inferencias respecto a la isquemia fría entre esos dos tipos de trasplantes, que es la segunda variable de mayor influencia en la sobrevida, lo cual está avalado por amplios estudios.13,17 Se estudió solo como variable principal el nivel de compatibilidad entre donante y receptor, particularmente en cada grupo de trasplante, sea cadavérico o entre vivos por separado.
En esta serie las medianas de supervivencias fueron cuatro veces superior en el trasplante donante vivo, se puede inferir que en ellos se encontraban pacientes con mayor compatibilidad HLA que en los trasplantes cadavéricos. De hecho, con la excepción de un solo trasplante, el resto de los que recibieron un órgano de vivo, compartían un mínimo de tres compatibilidades HLA, un haplotipo grado de compatibilidad solo encontrado en la cuarta parte de los trasplantes de cadáver y que constituyeron dentro de ese grupo los de superior supervivencia. Se reafirma que la compatibilidad HLA es una variable de mucho peso y ninguna otra permite diferencias tan significativas.15,18
Existe otra variable biológica que propicia mejores sobrevidas de injertos y vida media y es la menor isquemia fría con que se realizan los trasplantes, sobre todo cuando se hace por debajo de las 18 h, pero no es objetivo de esta investigación y en el orden teórico no ofrece las diferencias tan evidentes como ocurre cuando se analizan las curvas de supervivencias por compatibilidad HLA.19,20
A mayor la compatibilidad de antígenos en común entre el donante con su receptor se lograron más pacientes con función del injerto. Los pacientes llegan incluso a cuadruplicarlas, cuando comparten tres o más compatibilidad, respecto a los que se trasplantaron con menos o se desconoció en el momento del trasplante y que por leyes inmunológicas del azar, se sabe que de haberse hecho, se encontrarían con muy baja compatibilidad, quedó demostrado que su vida media fue muy corta.
En este momento gran parte de los programas de trasplantes del mundo utilizan las técnicas de biología molecular para detectar estos antígenos HLA que por la serología o técnicas de microlinfocitotoxicidad, estructuralmente es difícil de diferenciar porque forman un grupo de reacciones cruzadas.16 La literatura científica demuestra que en la época que se emplearon técnicas serológica (aproximadamente los primeros 40 años de la trasplantología), cuando más compatibles se hacían los trasplantes respecto al sistema mayor HLA, la sobrevida era muy superior a los que tenían baja compatibilidad o ninguna.8,13,15,18 Este estudio de un cohorte de 18 años con seguimiento de la mayor parte de los trasplantes por más de 15 y 20 años, pese a referirse a tipificación por técnicas serológicas no deja de tener valor. Todo lo contrario, se reafirma lo planteando por múltiples estudios en el mundo y los realizados en Cuba a inicios de la década del 90 del siglo pasado, por Arce y otros21 fueron los que introdujeron el tipaje serológico en 1973.
Aún no se ha cumplido la promesa de la inmunología para el verdadero éxito de los trasplantes, que sería lograr la tolerancia. No se trata de alcanzar una simple ausencia de la actividad efectora como con la inmusupresión sino un tipo de respuesta inmunitaria con especificidad y memoria, que permita la aceptación de un injerto que mantenga la inmunocompetencia contra el resto de los agentes “agresores”.16
Compatibilizar el mayor número de alelos HLA que se pueda estudiar, además la respuesta anticorpal contra esos sistemas antigénicos sigue siendo la principal estrategia de estudio pretrasplante para disminuir en la práctica la inmunogenicidad de los injertos renales con donantes fallecidos a lo que se le conoce como “medicina de precisión”22 Muchos plantean que el estudio de anticuerpos debe ser superior y mejor a la hora de decidir una selección donante-receptor, pero la respuesta anticorpal es específica contra antígenos HLA y por tanto, el tener anticuerpos preformados contra algunos antígenos HLA, infiere decir que existe un bajo grado de compatibilidad y por eso se expresan esos anticuerpos. En otras palabras, son dos elementos que traducen en sí, la compatibilidad en el sistema mayor HLA.23
En cambio los trasplantes renales con donantes vivos al compararlos con los cadavéricos se dice que no es la compatibilidad inmunológica para el HLA lo que favorece las mejores supervivencias sino la isquemia fría, como suele referirse a la ultracorta isquemia v/s el trasplante con riñones provenientes de cadáver. Esa afirmación es real, si se comparan ambos en similitud de ambiente inmunológico de compatibilidad HLA. En la práctica, para los cadavéricos además de esa isquemia ultracorta de la que se benefician, sin dudas estos pacientes reciben los injertos con mayor grado de compatibilidad HLA porque gran parte de sus donantes son emparentados de primer y segundo grado de consanguinidad.2,24
Cuando se logre mayor compatibilidad para los antígenos HLA, mejor será la sobrevida, incluso en los trasplantes entre vivos. El estudio pionero y de la mayor casuística reportada a nivel mundial, es actualmente un fiel exponente de esta afirmación. Paul Terasaki,25 comparó 5 849 trasplantes entre vivos contra 86 682 que emplearon un donante cadavérico. Los trasplantes entre vivos, lograron sobrevida cuatro veces mayores. Al subdividir a su vez, los trasplantes con donante vivo, por el grado de consanguinidad, los hermanos idénticos duplican la supervivencia respecto a los donantes padres y conyugues, pese a que se efectúan con similar isquemia fría. Irrefutable evidencia a favor de la compatibilidad HLA, para el mejor resultado en los más compatibles. Padres y hermanos, 3 368 que compartían como mínimo un haplotipo, duplican a su vez la supervivencia cuando se comparan con los donantes amigos y los emparentados de tercer y cuarto grado de consanguinidad. Esto refuerza que la compatibilidad HLA, es fundamental para lograr las mejores sobrevidas.
En la supervivencia a corto plazo, puede que una adecuada y moderna inmunosupresión no deje expresar las bondades de una mayor compatibilidad HLA en la sobrevida del injerto. A mediano y largo plazo, la mayor parte de los autores que han estudiado la compatibilidad HLA, afirman que es la variable de mayor peso en los mejores resultados.8,13,15,18,22
En el presente estudio, los trasplantes entre vivos, se demostró justo lo planteado en el clásico reporte de Paul Terasaki, también en los trasplantes realizados en el Instituto de Nefrología fue evidente que mientras mayor la compatibilidad HLA entre donante y receptor, los resultados fueron muy superiores. Los hermanos idénticos para HLA, propiciaron la mejor función del órgano a largo plazo.25
Teóricamente entre hermanos, y no cuando el donante es un padre o un hijo, se tiene mayor probabilidad de lograr mejor compatibilidad HLA. En los trasplantes de ese período aún no se permitía por la ley, que un hermano sin compatibilidad fuera donante (algo que por ley de Mendel, es probable en el 25 % de una descendencia). En el presente reporte, los hermanos que donaron, tenían al menos, un haplotipo en común, más otros antígenos que también pueden compartir, lo que sobrepasa las tres compatibilidades que solo pueden ofertar los padres por el modelo mendeliano de herencia de los antígenos HLA. Solo por azar se tendrían algún otro antígeno en común.
Para el trasplante cadavérico, cuando se subdividen los mismos por el grado de compatibilidad HLA, también se hace muy evidente que a medida que los pacientes tenían tres o más compatibilidades esto propició mejor función a largo plazo y una superior vida media.
Se concluye que la compatibilidad inmunológica HLA entre donante y receptor, propicia diferencias en las supervivencias de injertos, y es mejor mientras más compatibles sean el donante y el receptor. Esto se cumple para el trasplante renal con donante cadavérico como para el de donante vivo.