Introducción
Las enfermedades cardiovasculares (ECV) son la primera causa de muerte en el mundo occidental.1) El proceso patológico que subyace a ellas es el engrosamiento de la pared arterial debido a la formación de placas ateroscleróticas. El mayor problema de esta enfermedad es su desarrollo silencioso y continuo hasta su manifestación clínica. Por ello, la posibilidad de prevenir o interferir con su historia natural tiene una gran implicación clínica y social. Se ha demostrado claramente que el control de los factores de riesgo cardiovasculares (FRC) conduce a un descenso en la incidencia y la mortalidad por ECV. Las estrategias deben centrarse en la aplicación preventiva, para reducir los eventos cardiovasculares e interferir con su progresión natural. La aplicación de medidas preventivas a toda la población es un objetivo extremadamente difícil, por su alto impacto económico, los efectos secundarios (en caso de fármacos) y la falta de adherencia al tratamiento. Por consiguiente, la identificación del paciente en riesgo es esencial para iniciar medidas preventivas más intensas y optimizar la relación coste efectividad.2
La hipertensión arterial (HTA) afecta aproximadamente al 30,9 % de la población con 15 años o más en Cuba.3 La HTA incrementa el riesgo de sufrir lesión en los lechos vasculares de diversos órganos vitales. La morbimortalidad asociada a la HTA está relacionada fundamentalmente con la lesión en órgano diana (LOD) o con sus complicaciones cardiovasculares. El objetivo principal del tratamiento de la HTA no es solo controlar las cifras de presión arterial (PA); sino reducir el riesgo cardiovascular (RCG). En las últimas décadas hay evidencia sobre la posibilidad de realizar acciones terapéuticas para prevenir, detener o revertir la lesión vascular subclínica.4
La HTA se asocia frecuentemente a otros FRC, lo que favorece la aparición y rápida progresión de la aterosclerosis. Además, cerca del 85 % de estos FRC son compartidos por las ECV que poseen la aterosclerosis como base anatomopatológica. El RCG viene determinado por la carga global de factores de riesgo de una determinada persona, así como por las cifras de PA y la presencia o no de LOD.4,5
Por otra parte, hay evidencia que la HTA no debe considerarse un hecho aislado, debido a que los trastornos metabólicos asociados desempeñan un importante rol en su aparición, pronóstico a largo plazo y por su estrecha relación con el RCG.2,3 Múltiples estudios confirman que las alteraciones del metabolismo de la glucosa y de los lípidos frecuentemente se asocian con alteraciones de la PA, por lo que la prediabetes, la DM y la hipercolesterolemia son más frecuentemente diagnosticadas en presencia de la HTA y que esta asociación de factores, reconocida como riesgo cardiometabólico ensombrece el pronóstico de estos pacientes.6 Es conocido que las anormalidades del metabolismo de la glucosa y de los lípidos en pacientes con HTA se asocian con daño vascular subclínico lo que aumenta el riesgo de eventos cardiovasculares fatales y no fatales.7
El paciente con riesgo cardiometabólico es el que tiene una predisposición a la aterosclerosis y a la DM tipo 2, que se origina de la asociación de los FRC con las alteraciones propias del síndrome de insulinorresistencia (SIR) o metabólico. Entre estas últimas, la obesidad abdominal y la insulinorresistencia son las que tienen un mayor protagonismo.7
En el riesgo cardiometabólico intervienen, por tanto, los trastornos del metabolismo de la glucosa, de los lípidos y un estado proinflamatorio y protrombótico, que forman parte del SIR, junto con distintos factores aterógenos, entre ellos la HTA, la obesidad abdominal y el tabaquismo son las mejor definidas. La identificación del riesgo cardiometabólico es de gran trascendencia clínica, ya que una actuación enérgica dirigida al control global de los factores que lo componen previene las ECV, en todas sus manifestaciones, y la DM.8
Uno de los principales retos en la evaluación del riesgo cardiometabólico en el paciente con HTA esencial, es que cursa durante muchos años asintomática, es en esta fase subclínica en la que ya se están produciendo alteraciones a nivel del endotelio vascular de los órganos diana de la HTA, que por las investigaciones tradicionales pasan inadvertidas y de detectarse pudieran aplicarse terapéuticas para la corrección de estas alteraciones.8
Se realizó esta investigación con el objetivo de evaluar el comportamiento del riesgo cardiometabólico en pacientes hipertensos esenciales sin LOD en relación con el IMC, el tiempo de evolución de la HTA y el RCG.
Métodos
Se realizó una investigación descriptiva y transversal en el Hospital Clínico Quirúrgico “Hermanos Ameijeiras”, con el propósito de evaluar el comportamiento del riesgo cardiometabólico en pacientes hipertensos esenciales sin LOD y su relación con el tiempo de evolución de la HTA, el control de la PA y el RCG.
La muestra estuvo constituida por los primeros 100 pacientes con HTA esencial sin LOD, con 18 años o más, que de forma consecutiva acudieron a las consultas protocolizadas de hipertensión arterial en el período comprendido entre el 1 de marzo de 2018 al 28 de febrero de 2019. Se excluyeron pacientes con endocrinopatías, con enfermedades agudas o crónicas graves, mujeres gestantes, y pacientes con malformaciones que dificultaran la medición de la PA.
En cuanto a las consideraciones éticas, se tomó previo consentimiento informado a todos los pacientes, se les recogió por anamnesis los datos siguientes: edad, sexo, antecedentes patológicos de ECV precoz en familiares de primer grado, así como la presencia o no de hábito tabáquico, llevar dieta saludable, realizar ejercicios físicos y el tiempo de evolución de la HTA. Se midió las cifras de presión arterial sistólica (PAS) y de presión arterial diastólica (PAD), la circunferencia de la cintura abdominal (CA) y el índice de masa corporal (IMC) por formula de Quetelet.4 Además, se les realizó determinación de glucosa, hemoglobina glucosilada, colesterol total, triglicéridos, lipoproteínas de alta densidad (HDL), lipoproteínas de baja densidad (LDL) y ácido úrico sérico. Se estimó el RCG para cada paciente con la estratificación del RCG propuesta en la guía cubana para el diagnóstico, evaluación y tratamiento de la HTA.4
Procesamiento estadístico y análisis de la información
La información obtenida se vertió en una base de datos digital, y se realizó el procesamiento estadístico Spss versión 25.0. Para la descripción del perfil clínico y metabólico de los pacientes estudiados, se determinaron las medidas de resumen de estadística descriptiva, de acuerdo al tipo de variable que se analizó: (números absolutos y porcentajes) para las variables cualitativas y (promedios y desviación típica) para las variables cuantitativas.
Se analizó el comportamiento de las variables que conforman el perfil clínico y metabólico y su relación con IMC, el tiempo de evolución de la HTA y el RCG. Para este análisis fue necesario emplear el test de ANOVA (análisis de varianza por tratarse de variables cuantitativas). El nivel de significación que se utilizó para todas las pruebas de hipótesis estadísticas fue de 0,05. La información se presenta en tablas, que junto con la redacción del informe final se realizó mediante el editor de texto Word para Windows 10.
Resultados
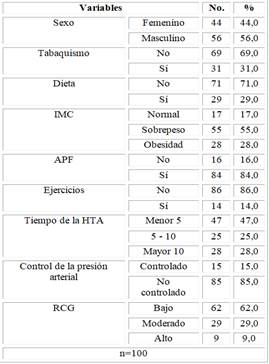
La población estudiada estuvo constituida por un total de 100 pacientes con diagnóstico de HTA esencial sin LOD. En los pacientes estudiados predominó las edades entre 18 a 55 años, con el 62,5 % (35) entre los hombres y el 61,9 % (29) entre las mujeres, entre 56 a 64 años fue el 28,6 % (16) entre los hombres y el 27,3 % (12) en las mujeres. Las edades promedio para los hombres fue de 50,9 ±12 años y para las mujeres de 51 ±9,6 años, sin diferencia estadísticamente significativa entre ambos grupos (p=0,906).
Se observa el comportamiento de las diferentes variables clínicas en los pacientes estudiados el 56 % fueron del sexo masculino. En relación con los factores de riesgo asociados a las ECV, se encontró que el 31 % de los pacientes refirieron ser fumadores. En relación a los hábitos alimenticios refirieron no llevar dieta saludable el 71 % de los pacientes. Constatamos que el 83 % de los pacientes tenían sobrepeso u obesidad (55 % sobrepeso y el 28 % obesidad). El 86 % declaró tener un estilo de vida sedentario. Asimismo, el 84 % de los pacientes refirieron haber tenido familiares de primera línea con muerte prematura de etiología cardiovascular. En cuanto al tiempo de evolución de la HTA se encontró que el 47 % de los pacientes eran hipertensos conocidos desde hacía menos de 5 años; mientras que de más de 5 años de evolución el 53 % (25 % entre 5 a 10 años y 28 % de más de una década de evolución de la enfermedad). En la estratificación del RCG predominó la categoría de bajo, con un 62 %, el 29 % moderado y solo el 9 % alto (Tabla 1).
Tabla 1 Perfil clínico y sociodemográfico de los pacientes estudiados
IMC. Índice de masa corporal, APF. Antecedentes patológicos familiares, RCG. Riesgo cardiovascular global.
Se relacionan las variables edad, CA y las cifras de PAS y PAD con el IMC, resaltando la relación directamente proporcional y con significación estadística entre el aumento del IMC y el aumento de la CA (CA: 93,1 ± 6,6, CA: 99,7 ± 6,3, CA: 110,9 ± 8,9, p=0,000) para el IMC normal, sobrepeso y obeso respectivamente. Estos resultados fueron corroborados cuando se diferenció por género los pacientes, las femeninas (CA: 88,1 ± 5,4, CA: 96,4 ± 5,4, CA: 108 ± 11,1, p=0,000) en relación con el IMC normal, sobrepeso y obeso respectivamente, y los masculinos (96,1 ± 5,4, CA: 102,3 ± 5,6, CA: 113,1 ± 6,4, p=0,000) en relación con el IMC normal, sobrepeso y obeso respectivamente.
No encontramos diferencias en la edad promedio en relación al IMC, al igual que las PAS y PAD, aunque si fueron más elevadas en los pacientes obesos sin significación estadística.
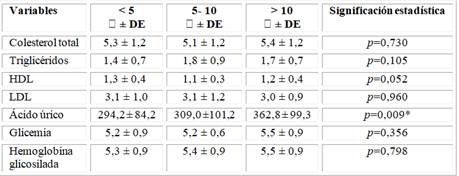
Además, se reflejaron las variables metabólicas en relación con el IMC encontrándose aumento progresivo de las cifras de colesterol total, triglicéridos, LDL y ácido úrico, aunque solo estadísticamente significativo para los triglicéridos (1,8 ± 0,9, p=0,05) y el ácido úrico (374,5 ± 100,7, p=0,001) fueron los niveles más elevados en los pacientes obesos.
Tabla 2 Promedio de variables clínicas y metabólicas según IMC

Se excluye en este análisis, la categoría bajo peso del IMC, por clasificar solo un sujeto en el estudio
HDL: lipoproteínas de alta densidad LDL: lipoproteínas de baja densidad * p<0,05.
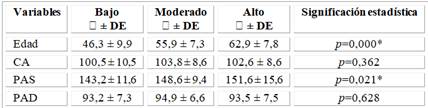
Se relacionó al promedio de las variables clínicas con el RCG, se encontró relación estadísticamente significativa con la progresión de la edad y el RCG, con los de RCV alto los de mayor edad (62,9 ± 7,8, p=0,000), así como con el aumento de la PAS (151,6 ± 15,6, p=0,021), no así con la PAD.
En relación a la CA tampoco encontramos relación estadísticamente significativa entre el empeoramiento del perfil de RCG y el aumento de la CA, diferenciado por género, las femeninas (CA: 97,4 ± 10,8, CA: 98,8 ± 4,3, CA: 114,0 ± 5,3, p=0,295) en relación con el RCG bajo, moderado y alto respectivamente, y los masculinos (CA: 105,2 ± 7,9, CA: 105,2 ± 9,0, CA: 101,8 ± 8,2, p=0,402) en relación con el RCG bajo, moderado y alto respectivamente (Tabla 3).
Tabla 3 Promedio de variables clínicas según RCG
* p=0,0000 (p<0,05), CA: circunferencia abdominal PAS: presión arterial sistólica PAD: presión arterial diastólica.
Se relacionan las variables metabólicas estudiadas al RCG, se evidenció relación significativa de la disminución progresiva de los valores del HDL (0,9 ± 0,3, p=0,000) con el RCG alto, así como con el aumento progresivo del ácido úrico (349,3 ± 115,3, p=0,015), aunque se constató aumento progresivo del colesterol total, triglicéridos, y LDL en relación al empeoramiento del RCG no fue estadísticamente significativo (Tabla 4).
Tabla 4 Promedio de variables metabólicas según RCG

* p<0,05 HDL: lipoproteínas de alta densidad LDL: lipoproteínas de baja densidad.
Se relacionaron las variables metabólicas con el tiempo de evolución de la HTA, se obtuvo que los valores de modo global fueron incrementándose según el tiempo de evolución de la HTA, aunque sin significación estadística, excepto el ácido úrico con evidente aumento progresivo en relación con el tiempo de HTA, encontrándose, en los de más de 10 años de HTA sus cifras más elevadas (362,8 ± 99,3, p=0,009).
Discusión
Las principales guías actuales sobre el diagnóstico y manejo de la HTA destacan la relevancia del trastorno metabólico frecuentemente detectado en pacientes hipertensos, lo que influye negativamente en su perfil de RCG.4,9,10) Esta afirmación se basa en un gran número de hallazgos epidemiológicos encontrados a lo largo de los años, los que han demostrado alteraciones en el metabolismo de la glucosa, los lípidos y el ácido úrico frecuentemente asociados con alteraciones de la PA, hace que la DM, la prediabetes y la hipercolesterolemia sean más frecuentemente detectadas en presencia de la elevación de la PA; y que esta asociación o riesgo cardiometabólico tenga un impacto adverso en el pronóstico de los pacientes.9,10
La HTA posee una elevada prevalencia en la población cubana y se presenta en edades cada vez más tempranas de la vida, influyen negativamente en el RCG de estos enfermos.3 En los pacientes estudiados en la investigación se observó predominio de adultos jóvenes de 18 a 55 años, este aspecto tiene coincidencia con lo planteado por Kario y Stergiou, en sus investigaciones encontraron entre un 55,3 % y un 68,2 % de hipertensos sin LOD entre los 20 y 50 años.11,12) Otro estudio realizado en Japón develó una prevalencia del 50 % entre 20 y 69 años a favor de pacientes hipertensos de reciente comienzo o con riesgo cardiometabólico bajo, sin LOD.13
El tabaquismo es uno de los principales FRC para las ECV. El elevado número de pacientes con hábito de fumar encontrada en la investigación es similar con la prevalencia de esta deletérea adicción en la población cubana encontrada en III Encuesta nacional de factores de riesgo y actividades preventivas.3) Semejantes resultados obtuvieron Nduka y Plummer quienes declaran un tercio de pacientes con hábitos tabáquicos.13,14 Este es uno de los factores de riesgo modificables en el que con mayor intencionalidad en los pacientes hipertensos debemos eliminar dado su dañino impacto sobre el RCG.
El número de pacientes con sobrepeso y obesidad encontrada en la investigación es superior a la encontrada en estudios de referencia nacional,3 pensamos que la diferencia está en el tipo de población estudiada. La obesidad es uno de los factores más importantes del SIR por sus efectos deletéreos inflamatorios, neuroendocrinos y de diversa índole, se relaciona directamente tanto con la HTA como con la DM, empeora significativamente el perfil de RCG de los pacientes. La consistencia de los resultados obtenidos fue comprobada tanto para mujeres (CA > 88 cm), como para hombres (CA > 94 cm), lo que ha sido planteado en la mayoría de las clasificaciones diagnosticas de SIR.15) La relación encontrada en la investigación entre la CA y el IMC no hace más que resaltar la importancia del tipo de patrón de distribución de la grasa en los pacientes sobrepesos y obesos, caracterizada por su predominio abdominal, que es uno de los elementos clínicos más aceptados, que conforman el SIR de la mayoría de las clasificaciones diagnósticas.8,9,10,11,12,13,14,15
En un estudio realizado por Williams, se encontró que los pacientes obesos con IMC > 30 tenían 2,2 veces más probabilidad de padecer de HTA que las personas con IMC < 24,9, por lo que el SIR y la obesidad tienen cabida en estos datos. Lo mismo se vio en pacientes con DM e hipercolesterolemia porque 15,1 y 21,4 %, respectivamente tenían mayor prevalencia de consumo de fármacos antihipertensivos.16 Estos resultados son similares a los reportados por Calderín y otros.17 en estudios en población cubana.
La progresión de la edad se ha relacionado con empeoramiento del perfil de RCG, en estos pacientes coinciden una serie de factores que no solo están dados por las características fisiológicas del envejecimiento, sino además por el mayor tiempo de evolución de la HTA, perfiles de RCG peores por coexistencia de otros FRC, o LOD, a lo que se le añade características psicológicas y sociales muy particulares en esta etapa de la vida.
El tiempo de evolución de la HTA, reviste vital importancia a la hora de analizar los efectos deletéreos del riesgo cardiometabólico en pacientes hipertensos. Así se evidencia en lo declarado por Sinnott y Krieger quienes exhibieron entre un 47,6 % y un 53,5 % de casos con menos de 5 años de evolución entre sus hipertensos sin complicaciones cardiovasculares.18,19
Las cifras más altas de ácido úrico en los pacientes de edad más avanzada tuvieron significado estadístico, esto refuerza la hipótesis de que el ácido úrico es un biomarcador muy fiel de daño endotelial, del perfil de riesgo cardiometabólico en los pacientes hipertensos y se relaciona significativamente con el empeoramiento del RCG. García Sánchez y León Álvarez corroboran la importancia actual del ácido úrico como biomarcador de ateroesclerosis subclínica y propusieron que las cifras de ácido úrico podrían usarse como biomarcador de riesgo cardiovascular.20 Incluir el ácido úrico como variable para estratificar el RCG puede resultar interesante, por tratarse de una prueba de bajo coste, fácil realización y de utilidad en la práctica clínica, especialmente en pacientes con SIR. Pocos estudios han investigado el papel predictivo de los niveles de ácido úrico, y aún son escasos los estudios que investiguen la relación entre los criterios de SIR y las cifras de ácido úrico en pacientes previamente detectados con RCG. Este estudio contribuyó a un mejor conocimiento de la relación de las cifras de ácido úrico con las variables clínicas y metabólicas en una población en riesgo cardiometabólico. Según Rho y otros,21 existe una fuerte asociación entre el ácido úrico y el SIR, lo que sugiere que el ácido úrico podría contribuir de forma independiente al desarrollo de la enfermedad. Algunos estudios sugieren que debido a que el ácido úrico es un antioxidante eficaz, el aumento de este biomarcador entre los sujetos con SIR podría reflejar un mecanismo compensatorio del aumento del estrés oxidativo asociado a SIR.22
Los resultados de la investigación tienen solidez estadística al demostrar la vinculación del ácido úrico con el incremento del IMC, el tiempo de evolución de la HTA y el empeoramiento del RCG, lo que supone un riesgo cardiometabólico deletéreo a mediano y largo plazo.
En relación con el tiempo de evolución de la HTA existe consenso de la relación directa entre el tiempo de HTA, el RCG y el deterioro del perfil metabólico de los enfermos si no se instauran medidas enérgicas para modificarlos.23,24,25
Los hallazgos en la investigación relacionados con el ácido úrico y el tiempo de evolución de la HTA no sorprenden. León Álvarez y otros han resaltado en anteriores publicaciones la importancia de este biomarcador como expresión de daño endotelial. Esto corrobora la hipótesis de que este biomarcador además de ser uno de los que con mayor facilidad podemos realizar en nuestro medio, se relaciona significativamente tanto con el RCG como con el tiempo de HTA.26 Esta tendencia fue de igual manera constatada por Vongpatanasin y Ayala quienes declararon entre un 35 y un 42,5 % de casos con dislipidemia, y un 30 % como promedio de casos con hiperuricemia en sus poblaciones de pacientes hipertensos sin LOD.27,28
La elevación de las cifras de PAS se relacionó con peor RCG, los elementos explicados ya del envejecimiento sustentan estos hallazgos, así como el efecto hemodinámico que la mayor PA ejerce sobre el endotelio vascular de los principales órganos. Semejantes resultados se observaron en muestras poblacionales de investigaciones multicéntricas como las de Bhatt y de Jager que mostraron que 4 de cada 10 pacientes tenía menos de 5 años de evolución de la HTA y que 6 de cada 10 casos se correspondían con varones, con un tercio de la muestra obesa y una quinta parte con hábitos tabáquicos y dislipidemia, con riesgo cardiometabólico mucho mayor al coincidir comorbilidades y al aumentar el tiempo de evolución de la HTA.29,30
En la investigación no se demostró relación significativa entre los valores de los lípidos con el tiempo de la HTA, hay numerosos estudios internacionales que, si lo prueban, de hecho, en numerosas guías de prevención del RCG se propone el tratamiento enérgico de este factor de riesgo.2,4,9,10,25 Se encontró de manera significativa relación entre la disminución progresiva del HDL y el empeoramiento del RCG, así como del aumento de las cifras de triglicéridos en relación con un IMC mayor. El principal obstáculo para tratar el riesgo residual debido a la dislipemia aterogénica, es la pérdida de conciencia sobre su incidencia y el impacto que puede tener en el RCG. El uso de estatinas no elimina el riesgo residual debido a otras alteraciones lipídicas, como es el caso de la hipertrigliceridemia con o sin niveles bajos HDL, hecho este corroborado por un subanálisis del estudio de Roush y otros,31 que mostró en población con sobrepeso y obesidad, que la concentración de triglicéridos y HDL, pero no de LDL, estaba asociada con la aparición del síndrome cardiometabólico en pacientes con HTA.
La importancia del control de la PA y de los valores absolutos de PA, han sido sostenidamente publicados, desde hace décadas se conoce la estrecha relación entre la PAS y la LOD, así como con el riesgo cardiometabólico.32 Los resultados evidenciaron significativamente la relación entre la PAS y el RCG. Hermida y otros han encontrado resultados similares, mostró que más de la mitad de sus casos con descontrol de la PA estaban vinculados a la obesidad y argumentó que el adipocito obeso, a diferencia del delgado, tiene una sobreexpresión de citoquinas proinflamatorias, entre las que destacan la resistina, la leptina o la IL-6. Las tres están implicadas en la inflamación endotelial; el aumento en los niveles circulantes de resistina e IL-6 se asocian con la aparición de HTA, cardiopatía isquémica e infarto agudo de miocardio, y en especial la hiperleptinemia se asocia con marcadores de aterosclerosis subclínica.32 De semejante manera lo afirma Arnet y otros colaboradores norteamericanos, quienes de forma directamente proporcional, mientras más peso corporal tenían los pacientes mayores las cifras de PAS, encontrado en casi la mitad de la muestra.25
Los resultados sostienen la hipótesis de que el riesgo cardiometabólico se incrementa en función de las cifras de PA, y del tiempo de diagnóstico de la HTA, esto gira en torno a un cúmulo de FRC que se verán afectados a partir de estilos de vida inadecuados, específicamente en los hábitos dietéticos, hábitos tóxicos y en el control del peso corporal fundamentalmente.
Por otra parte, es evidente el valor de parámetros clínicos (edad, CA, IMC y PAS), así como parámetros metabólicos (colesterol total, LDL, triglicéridos, HDL y ácido úrico) en la evaluación del riesgo cardiometabólico y la estimación del RCG en los pacientes hipertensos.
Se concluye que los resultados de la investigación sostienen con significación estadística el valor de parámetros clínicos como la edad, la circunferencia abdominal, el índice de masa corporal y la PAS, así como de parámetros metabólicos como los triglicéridos, el HDL y el ácido úrico en la evaluación del riesgo cardiometabólico y la estimación del RCG en pacientes con HTA esencial no complicada. Aunque sin significación estadística en la investigación se evidenció la relación entre el aumento del colesterol total y del LDL con el RCG alto