Introducción
Actualmente las infecciones por hongos afectan del 20 al 25 % de la población mundial,1 entre ellas las producidas por hongos dermatofitos representan entre un 5 y 10 %.2 Los dermatofitos son un grupo de hongos con capacidad para adherirse a la queratina y degradarla lo que les permite colonizar tejidos queratinizados como estrato córneo, pelos y uñas.3
Los dermatofitos se clasifican en tres géneros: Epidermophyton, microsporum y Trichophyton. Se reconocen más de 40 especies, alrededor de una docena son patógenas para el hombre. El género epidermophyton tiene dos especies conocidas, donde Epidermophyton. floccosum representa y constituye la única patógena para el hombre y la especie tipo, mientras que el género microsporum presenta como la especie tipo a M. audouinii y posee unas 20 especies distintas, de las que unas 10 son patógenas para el hombre.4 El género trichophyton es el más frecuente con cerca de 30 especies, de las que menos de 10 son responsables de las dermatofitosis humanas,4 con una prevalencia del 70-90 % para onicomicosis y 53‑86 % para el resto de infecciones de tiña,5T. tonsurans constituye la especie tipo,4 mientras que Trichophyton rubrum es el principal agente etiológico seguido por T. mentagrophytes.6,7
Las opciones de tratamientos para estas enfermedades son numerosas y varían no solo de acuerdo al tipo de microorganismos sino también al país o región donde se indique el tratamiento. Históricamente, los imidazoles como el bifonazol, clotrimazol, miconazol han sido los de mayor uso para el tratamiento de las micosis cutáneas y en los últimos años se incorporan los triazoles como el fluconzol, itraconazol y efinaconazol.8 Por otro lado, las alilaminas como la butenafina, naftifina y la terbinafina provocan la disminución de la producción de ergosterol en la etapa temprana de su formación lo que provoca una disminución en la organización celular y el crecimiento del hongo.9
La resistencia a los antifúngicos presenta implicaciones importantes en la morbilidad y la mortalidad de las micosis; las consecuencias clínicas de esta resistencia se observan en los fallos en el tratamiento y en los cambios en la prevalencia de las especies fúngicas.10,11 De ahí que, constituye una necesidad el desarrollo de estrategias profilácticas y terapéuticas eficaces que eviten los problemas que aparecen en la actualidad con las micosis por hongos resistentes.
El aceite de girasol ozonizado OLEOZON® es un medicamento desarrollado y producido en el Centro Nacional de Investigaciones Científicas (CNIC). Es un antimicrobiano de amplio espectro, que resulta letal para numerosas especies de bacterias, hongos filamentosos y levaduras por lo que se emplea exitosamente en el tratamiento de diferentes enfermedades infecciosas.12,13,14 El mecanismo de acción de los aceites ozonizados sobre los microorganismos no está completamente dilucidado. No obstante, es generalmente aceptado que la actividad antimicrobiana de los aceites vegetales ozonizados está relacionada con la acción de los compuestos peroxídicos, formados por la reacción del ozono con los ácidos grasos insaturados que componen los aceites vegetales. Entre los principales blancos de los peróxidos en los microorganismos se encuentran los lípidos insaturados y las proteínas que contienen los grupos sulfidrilos.15
El OLEOZON® es un medicamento registrado para el uso en la epidermofitosis desde el año 1999,16 y a partir de esa fecha existen numerosas renovaciones de registros de acuerdo a las exigencias presentadas por la autoridad regulatoria Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos (CECMED).17,18 Uno de los ensayos exigidos para el registro de los medicamentos es el estudio de estabilidad, donde no solo se analiza la estabilidad químicamente, sino también la actividad antimicrobiana y se tienen en cuenta la temperatura: estudio acelerado (25 ± 2ºC ) y estudio vida de estante (5 ±3 °C) así como el tipo de envase.19
Esta investigación tuvo el objetivo de determinar la concentración mínima inhibitoria de dos lotes de OLEOZON®, tópicos almacenados a dos temperaturas y en dos tipos de envases: de vidrio (FV) y polietileno de alta densidad (FPAD), frente a tres cepas de dermatofitos.
Métodos
En el estudio se emplearon dos lotes de OLEOZON®, lotes 803295 y 803301, proporcionados por el CNIC, los cuales fueron almacenados en FV y FPAD y a dos temperaturas, 25 ± 2 ºC donde se tomaron muestras al inicio, 1, 2, 3, 4, 5 y 6 meses y de 5 ± 3 °C donde se tomaron muestras al inicio; 1, 3, 6, 9, 12, 15, 21 y 24 meses.19
Cepas fúngicas
Las cepas evaluadas fueron Trichophyton rubrum CBS 218,65; Epidermophyton floccosum var. Floccosum CBS 240,67 y Trichophyton mentagrophytes CBS 572,75. Todas fueron conservadas en aceite mineral y en agua destilada estéril.
Preparación del antifúngico
Se preparó una emulsión en proporción 3:2:3 con OLEOZON( (950 mg/mL), Tween 80 y caldo Müeller-Hinton, con lo cual el principio activo quedó a una concentración de 356,25 mg/mL. Una vez estabilizada la mezcla se colocó en un equipo ultrasónico durante 15 min.
Se realizaron diluciones colocaron concentraciones decrecientes de OLEOZON( en Erlenmeyers que contenían 25 mL de agar Müeller-Hinton esterilizado, finalmente el producto quedó en concentraciones de 36,5 mg/mL; 17,8 mg/mL; 8,9 mg/mL; 4,45 mg/mL; 2,25 mg/mL; y luego se distribuyeron en placas Petri hasta su completa solidificación a temperatura ambiente.
Preparación de los medios de cultivo y del inóculo
Con la ayuda de una aguja de inoculación, se transfirió una porción de cada cepa a tubos de agar dextrosa Sabouraud y papa dextrosa, los que se incubaron a 25 °C durante 7-14 días. Para confirmar la pureza e identificación de los hongos filamentosos se examinaron las características del cultivo a simple vista, y luego se observaron las colonias al anverso y reverso bajo estereoscopio (Carl Zeiss, Alemania), se realizó un examen directo del cultivo para observar las estructuras clásicas de fructificación.
Para el microcultivo se utilizó una placa Petri de vidrio esterilizada, cuyo fondo se encontraba cubierto con papel de filtro, sobre el cual se colocó una varilla de vidrio en forma de “V”, un cubreobjetos y un portaobjetos. Sobre este último se colocó una porción de agar papa dextrosa suplementado de 1 cm2 de superficie, donde se inocularon fragmentos pequeños del aislado a identificar sobre la superficie de los bordes laterales. Después se cubrió el medio de cultivo con el cubreobjetos estéril y se incubó en cámara húmeda a 37ºC. Una vez que se detectó el crecimiento del hongo se retiró el cubreobjetos y se colocó sobre un portaobjetos que contenía una gota de azul algodón de lactofenol. La preparación se observó al microscopio con aumento de 100X y 400X.
Las colonias fueron cubiertas con 1 mL de solución salina estéril al 0,85 % y con ayuda de un asa estéril se removió suavemente para liberar las conidias en la solución y obtener una suspensión turbia, formada por esporas y fragmentos de hifas. Después se tomó 1 mL de la suspensión y se transfirió a un tubo estéril y se homogenizó durante 15 seg con un vórtex (Heidolph, Alemania). Se esperó entre 3-5 min para que las partículas más densas sedimentaran y luego se tomó 1 mL de sobrenadante y se transfirió a un tubo estéril. Luego se añadió una gota de tween 20 para disolver el inóculo y se procedió a colocar en la cámara de Neubauer una alícuota, y a realizar el conteo hasta ajustar la concentración final establecida en un rango de 1,0-3,0x105 ufc/mL. La concentración del inóculo se verificó mediante la siembra de 100 µL en agar Müeller-Hinton y se incubó a 25ºC.
Posteriormente se realizaron diluciones 1:10 en medio caldo Müeller-Hinton hasta obtener una concentración final de 1-3 x103 ufc/mL, que se empleó para inocular las placas con las diferentes diluciones del OLEOZON( previamente preparadas. Se estableció como control de esterilidad (agar Müeller-Hinton + OLEOZON() para cada dilución y control de crecimiento (agar Müeller-Hinton + inóculo) con la concentración de inoculo final, para cada cepa.
Preparación e incubación de las muestras
Se distribuyó por extensión en la superficie del agar 100 µL de la suspensión del inóculo (1-3 x 103 ufc/mL) con ayuda de la espátula de Drigalski para lograr su distribución uniforme. Se dejó reposar por 15 min a temperatura ambiente y se incubó a 25 ºC por 72 a 96 h. Se realizaron tres réplicas por cada dilución frente a cada cepa. La CMI fue considerada como la concentración más baja del OLEOZON® que, en condiciones in vitro definidas, impidió la aparición de crecimiento visible del microorganismo antes de transcurrido un período de tiempo definido.20
Análisis estadístico
Los resultados fueron procesados a través del programa, Statgraphics Centurion versión 15,2. Se realizó el test de Shapiro-Wilk para determinar la normalidad de los datos. Las demás pruebas empleadas fueron en dependencia del resultado del valor del estadístico W de Shapiro-Wilk. Para datos provenientes de una distribución normal se aplicaron pruebas paramétricas. Para los datos que no provienen de una distribución normal se aplicó la prueba U de Mann-Whitney para la comparación entre dos muestras independientes, la prueba de Kruskal-Wallis para comparar varias muestras y la prueba de múltiples rangos para determinar la homogeneidad entre los grupos, se utilizó un nivel de significación de 0,05.
Resultados
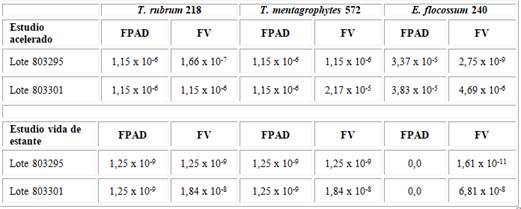
Se muestra los resultados del test de Shapiro-Wilk para el estudio acelerado y vida de estante. Se evidencia que los datos no provienen de una distribución normal (tabla 1).
Tabla 1- Valores del estadístico p del test de Shapiro-Wilk en el estudio acelerado y vida de estante
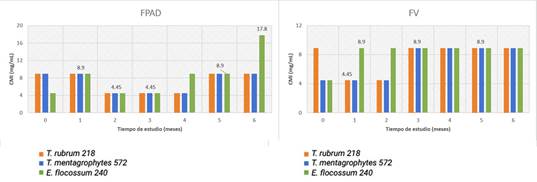
Se muestran los valores obtenidos de la CMI del estudio acelerado del lote 803295 en el tiempo y en los envases evaluados. Al analizar el comportamiento entre los FPAD y FV para cada microorganismo se evidenció la ausencia de diferencias significativas, para T. rubrum 218 P, T. mentagrophytes 572 y E. flocossum 240, los valores del estadístico de la prueba U de Mann-Whitney fueron 0,3; 0,99 y 0,29 respectivamente. Entre los valores de las concentraciones de los FPAD con relación a los tres microorganismos tampoco se evidenciaron diferencias significativas, el estadístico p de la prueba de Kruskal-Wallis resultó para los FPAD fue 0,84 y para los FV 0,13 (fig. 1).
En cuanto a los resultados del lote 803301, los cuales se muestran en la figura 2, se observó similar comportamiento en relación al lote anterior. Resultó en ausencia de diferencias significativas entre los envases para cada microorganismo, para T. rubrum 218, T. mentagrophytes 572 y E. flocossum 240, los valores del estadístico de la prueba U de Mann-Whitney fueron 0,99; 0,71 y 0,14, respectivamente, así como para el mismo envase con relación a los tres dermatofitos. El valor del estadístico p de la prueba de Kruskal-Wallis resultó para los FPAD 0,25 y para los FV 0,91 (fig. 2).
Al analizar todos los valores obtenidos para los FPAD y para los FV entre los dos lotes no se evidenciaron diferencias significativas. El valor del estadístico p de la prueba de Kruskal-Wallis resultó ser 0,66 para el envase de plástico mientras que para el de vidrio fue 0,23.
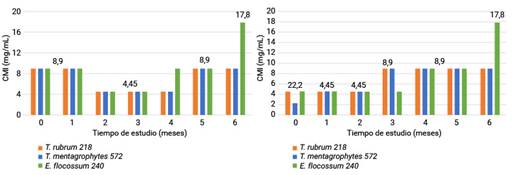
El análisis de los resultados de las CMI del estudio vida de estante del lote 803295 se muestran en la figura 3. El valor del estadístico p de la prueba U de Mann-Whitney al analizar el comportamiento entre los FPAD y FV para cada microorganismo evidenció la ausencia de diferencias significativas. Para T. rubrum 218 y T. mentagrophytes 572 fue 0,99 y para E. flocossum 240 0,08. Entre los valores de las concentraciones de los FPAD en relación a los tres microorganismos el valor del estadístico p de la prueba de Kruskal-Wallis resultó ser 0,03 lo que evidencia diferencias significativas entre los géneros estudiados. En cuanto a los FV se observó la existencia de grupos homogéneos (p = 0,48).
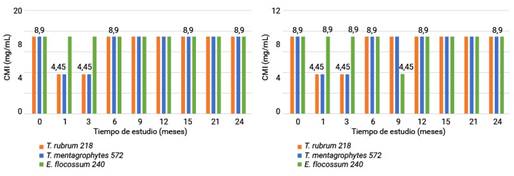
Fig 3 -Valores de CMI para los dos envases en el tiempo del estudio vida de estante del lote 803295.
En la figura 4 se muestran los valores obtenidos de la CMI del lote 803301 del estudio vida de estante. En este lote se evidenciaron diferencias significativas entre los envases respecto a E. flocossum 240 (p = 6,68 x 10-6), contrario a las cepas de Trichophyton, donde el valor de p de la prueba U de Mann-Whitney fue 0,37 para ambas. Entre los valores de las concentraciones de los FPAD en relación a los tres microorganismos p resultó 0,03 lo que evidencia diferencias significativas entre los géneros estudiados. En cuanto a los FV se observó la existencia de grupos homogéneos (p = 0,16).
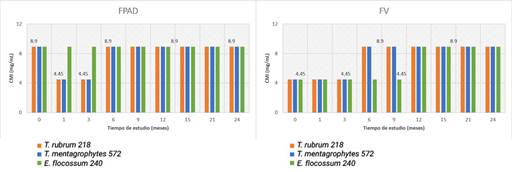
Fig 4 - Valores de CMI para los dos envases en el tiempo del estudio vida de estante del lote 803301. Al analizar los valores obtenidos para los FPAD entre ambos lotes se evidenciaron diferencias significativas entre los géneros en estudio. Se evidenció la formación de dos grupos homogéneos, uno para las especies del género Trichophyton y el otro para epidermophyton. En cuanto a los FV las diferencias fueron halladas entre los valores de E. flocossum 240 (p = 6,23 x 10-4) y entre los valores para los FV del lote 301 de E. flocossum 240 y los valores obtenidos para T. rubrum 218 y T. mentagrophytes 572 (p = 0,01).
Discusión
En la actualidad se conocen las propiedades generales de los aceites de girasol ozonizados, sus aplicaciones médicas, propiedades físico-químicas y sus propiedades antimicrobianas, lo que se evidencia en la existencia de estudios sobre la efectividad de estos aceites frente a las micosis en humanos. Sus efectos beneficiosos tanto por su acción antifúngica como antiinflamatoria, regenerativa y analgésica, falta de resistencia de los gérmenes, sus escasos o nulos efectos secundarios y toxicidad, al igual que su bajo coste en comparación a los antifúngicos convencionales, los convierten en fármacos ideales para las terapias actuales.21 El aceite ozonizado ha demostrado ser eficaz contra estafilococos, estreptococos y enterococos, pseudomonas, Escherichia coli, mycobacterium y se ha utilizado para curar infecciones fúngicas.22
Los perfiles de susceptibilidad antifúngica no son los mismos en todas las regiones.23,24 En el método de susceptibilidad tanto el medio de cultivo, tamaño del inóculo, tiempo de incubación, entre otros, influyen directamente en los resultados, por lo que se consideran puntos críticos dentro de la metodología.25,26 Varios autores reportan los puntos de corte para la susceptibilidad antifúngica de dermatofitos frente a antifúngicos convencionales al utilizar la guía del Instituto de Estándares Clínicos y de Laboratorio, y obtienen valores de CMI cercanos y dentro de los rangos establecidos en la guía, tanto en Latinoamérica,23,27 India,28 e Irán.29
En este estudio los valores finales de CMI oscilaron entre los 8,9-17,8 mg/mL, superiores en comparación con los datos obtenidos por Ouf y otros,22 y Geweely,30 los cuales utilizaron aceite de oliva ozonizado frente a dermatofitos, y lograron obtener valores que oscilaron entre 0,0001 - 0,0002 mg/mL,22 y 0,5 - 2,0 mg/mL, respectivamente.30 Las CMI de los aceites vegetales ozonizados se encuentran en el rango de 0,1 mg/mL a 10 mg/mL, que resultan al menos cien veces superiores a las que usualmente poseen los antimicrobianos convencionales. Estos valores relativamente elevados se deben a que la actividad biológica corresponde sólo a una fracción de los compuestos presentes en los aceites ozonizados, así como a la polimerización que sufren algunos compuestos peroxídicos durante el proceso de ozonización.15
Las diferencias encontradas entre los valores de CMI para los dos géneros estudiados, se atribuyen a la morfología que presentan. E. flocossum presenta macroconidios ampliamente claviformes con paredes celulares que van desde lo delgado a moderadamente gruesas, con presencia de uno a nueve septos. Mientras que el género trichophyton cuando están presentes los macroconidios, tienen paredes lisas, generalmente delgadas y de uno a 12 tabiques, se pueden observar solos o en racimos, y pueden ser alargados y en forma de lápiz, claviforme, fusiforme o cilíndrica.31
El aumento de dichos valores de CMI puede estar asociado a la disminución del índice de peróxido del OLEOZON tópico. Preservar los aceites vegetales ozonizados y por tanto oxidados, es una difícil tarea, estos en general continúan rutas de descomposiciones muy difíciles de detener y controlar. Aunque el deterioro de los aceites puede provenir debido a la acción de enzimas o microorganismos, la oxidación es la causa más importante desde el punto de vista práctico. La luz, el calor y ciertas impurezas, tales como el agua y los metales, aceleran ese proceso. Se conoce que los peróxidos son los compuestos de descomposición primaria de la oxidación de las grasas y aceites, mientras que, en la reacción secundaria, los productos de descomposición que resultan de la oxidación son los peróxidos, aldehídos, ácidos.32
Durante la ozonización de los aceites y su almacenamiento se observa la formación de ácidos libres tanto volátiles como no volátiles, lo que demuestra que tiene lugar la oxidación de una parte de los aldehídos con el ozono y el oxígeno molecular a un estado de oxidación superior, correspondiente a los ácidos grasos y una autoxidación de los hidroxil-hidroperóxidos. También durante el almacenamiento se observa una ligera disminución de la viscosidad, como consecuencia de la despolimerización de los poliperóxidos que se forman durante el proceso. Los compuestos formados entre el óxido de carbonilo y el compuesto prótico en el medio reaccionante, son capaces de autodescomponerse, queda el aldehído y el hidroperóxido en equilibrio dinámico.33 Estas reacciones en su conjunto provocan que los aceites vegetales ozonizados durante su almacenamiento modifiquen sus propiedades químicas, físicas y microbiológicas.32
Se concluye que las concentraciones mínimas inhibitorias del OLEOZON® tópico obtenidas sugieren que este producto presenta una actividad antifúngica frente a los dermatofitos estudiados, independientemente del tipo de envase que lo contenga a lo largo del tiempo evaluado.