Introducción
En diciembre de 2019, en Wuhan, provincia de Hubei en China, se reportó un grupo de 27 pacientes con neumonía de etiología desconocida, vinculados con exposición al mercado de mariscos, pescados y animales vivos.1,2 El 7 de enero de 2020, se identificó una nueva cepa de coronavirus aislada en estos pacientes (SARS-CoV-2), responsable de la enfermedad conocida como la COVID-19 (enfermedad infecciosa por coronavirus-19).3
A partir del incremento exponencial de los casos, unido a la elevada letalidad reportada a nivel mundial trajo consigo una carrera desenfrenada contra el tiempo, sin experiencias previas para afrontar dicha contingencia de tal magnitud, y en aras de revertir esta realidad, se iniciaran ensayos de fármacos en un grupo de países,4,5 sin la correspondiente aleatorización y basado en su amplia utilización en otras entidades como el lupus eritematoso sistémico, y otras enfermedades autoinmunes como las reumáticas, las infecciones parasitarias y las bacterianas.6 Entre estos se encuentran los antimaláricos, los antiretrovirales, los anticuerpos monoclonales, los antibióticos y el plasma sanguíneo.5,7
Varios de los fármacos propuestos se han asociado con arritmias cardíacas, incluido la prolongación del intervalo QTc, torsades de pointes, bloqueo auriculoventricular y muerte súbita (MS).8,9
La prolongación del intervalo QT predispone a la aparición de arritmias ventriculares que pueden causar la muerte. La arritmia que está más relacionada a la prolongación del intervalo QT es la taquicardia ventricular helicoidal o torsión de puntas, que puede degenerar rápidamente en fibrilación ventricular. Por otro lado, es importante mencionar que por cada 10 ms de prolongación del intervalo QT el riesgo de torsión de puntas se incrementa en un 7 %.10
Los pacientes con la COVID-19 pueden llegar eventualmente a desarrollar síndrome de dificultad respiratoria aguda, estos requieren ventilación mecánica y manejo en una unidad de cuidados intensivos (UCI). Debido a su estado crítico, las alteraciones electrolíticas secundarias a ese estado, las complicaciones cardiovasculares y el empleo de múltiples drogas; los pacientes en las UCI pueden presentar QT prolongado. Se ha reportado que hasta el 28 % de los pacientes admitidos en una UCI tiene intervalo QT prolongado y que uno de cada cinco pacientes tiene intervalo QT corregido (QTc) mayor de 500 ms en el momento de su admisión en la UCI.11
El riesgo de prolongar el QT y el uso de estos medicamentos es bajo (alrededor del 1 %), el número de pacientes con la COVID-19 se eleva día a día; en el momento de redactar este artículo la cifra mundial de casos había superado los 638 336 790, todos recibieron estos protocolos con los fármacos descritos, y se estima además, que al menos 6 383 368 pacientes prolongarían el QT.8
La investigación tuvo como objetivo recopilar información sobre los fármacos empleados en el tratamiento de la COVID-19 y sus efectos en la prolongación del intervalo QT y la aparición de muerte súbita (MS).
Métodos
En la investigación se analizaron los artículos originales y de revisiones sistemáticas que incluían la información sobre los fármacos empleados en el tratamiento de la COVID-19 y sus efectos en la prolongación del intervalo QT y la aparición de MS. La búsqueda se efectuó en las bases de datos PubMed, Medline, SciELO, Google Académico, HINARI, sitios web de carácter científico, escritos en idioma español e inglés, todos en el período comprendido de enero de 2020 a enero de 2023. Se utilizaron los siguientes descriptores claves: fármacos empleados en la COVID-19, efectos adversos de las drogas, prolongación del intervalo QT en pacientes con la COVID-19, muerte súbita cardiovascular y las palabras clave y conectores muerte súbita y COVID-19; drogas empleadas y efectos en la prolongación del intervalo QT; prolongación del QT y muerte súbita.
Resultados
Tratamiento médico en la COVID-19 y el riesgo arrítmico
El riesgo de aparición de arritmias potencialmente fatales, capaces de desencadenar un paro cardíaco (PC) y evolucionar a la MS en pacientes con la COVID-19, no puede explicarse únicamente por la injuria directa o indirecta sobre el miocardio.
Los factores relacionados con el tratamiento médico del paciente para las enfermedades cardiovasculares previas, se añaden el ensayo de nuevas drogas que se investigan en la actualidad para el tratamiento de la enfermedad de la COVID-19 (tabla 1).
Tabla 1 - Arritmias asociadas al tratamiento médico de la COVID-19
| Remdesivir | Antiviral | Hipotensión severa y paro cardíaco24 |
| Favipiravir | Antiviral | Prolongación del intervalo QTc en pacientes infectados del ébola26 |
| Lopinavir / Ritonavir | Antiretroviral | Bloqueo AV, prolongación del PR, QRS y QTC27,28,29 |
| Darunavir | Antiretroviral | Bloqueo AV, prolongación del PR, QRS y QTC27,28,29,31,32 |
| Hidroxicloroquina | Antimalárico Inmunosupresor | prolongación QTc, TdP, TVP/FV6,8,36,37 |
| Cloroquina | Antimalárico Inmunosupresor | Prolongación QTc, TdP, TVP/FV6,8,36,37 |
| Azitromicina | Antibiótico (macrólido) | Prolongación QTc, TdP, TVP / FV43,44,45,46,47 |
AV: aurículo-ventricular; QTc: intervalo QT corregido; TdP: torsades de pointes; FV: fibrilación ventricular; TVP: taquicardia ventricular polimórfica.
El empleo concomitante de drogas para otras comorbilidades que constituyen antecedentes patológicos personales (tabla 2).
Tabla 2 - Fármacos asociados frecuentemente a la prolongación del intervalo QT43,49
| Disopiramida | Amitriptilina | Haloperidol | Eritromicina | Loratadina | Metadona |
| Procainamida | Desipramina | Fenotiazinas | Azitromicina | Astemizol | Probucol |
| Quinidina | Imipramina | Citalopram | Pentamidina | Difenhidramina | Droperidol |
| Dofetilide | Doxepina | Cloroquina | Hidroxicina | Ondansetrón | |
| Dronedarona | Fluoxetina | Hidroxicloroquina | |||
| Ibutilide | Sertralina | Ciprofloxacina | |||
| Sotalol | Venlafaxina | Fluconazol | |||
| Amiodarona | Levofloxacina | ||||
| Moxifloxacina | |||||
| Claritromicina | |||||
| Itraconazol | |||||
| Ketoconazol |
El uso inadecuado de fármacos en complicaciones graves de la enfermedad de la COVID-19, pueden ocasionar prolongación del intervalo QT y arritmias ventriculares tipo TdP, lo que puede conllevar a la aparición de MS (fig. 1).6,12,13
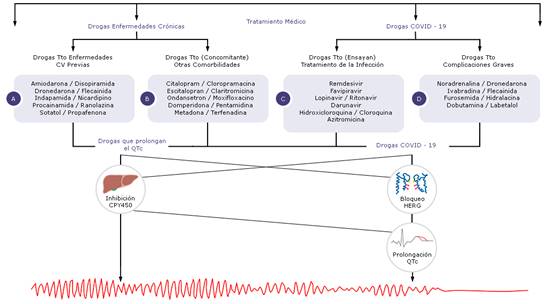
Fig. 1 - Tratamiento médico en la COVID-19, riesgo arrítmico y de muerte súbita. A) Fármacos prescritos para el tratamiento de las enfermedades cardiovasculares previas del paciente. B) Empleo concomitante de otras drogas para el tratamiento de comorbilidades. C) Ensayo de nuevas drogas que se investigan en la actualidad para el tratamiento de la enfermedad COVID-19. D) Uso inadecuado de fármacos para el tratamiento de complicaciones graves por la COVID-19. Pueden ocasionar prolongación del intervalo QT y arritmias ventriculares tipo torsades de pointes y conllevar a la aparición de muerte súbita.
El principal grupo de riesgo para la mortalidad se representa en la edad avanzada (mayor de 80 años).12,14 En pacientes con hipertrofia del ventrículo izquierdo significativa (grosor de la pared > 1,4 cm) o cardiopatía isquémica (CI) subyacente, el uso de sotalol, flecainida y propafenona incrementan el efecto proarrítmico.15
El uso de los fármacos bloqueadores de los canales de sodio como los antidepresivos tricíclicos en pacientes con antecedente de infarto de miocardio o taquicardia ventricular sostenida, debido a la enfermedad cardíaca estructural, ofrece un incremento en el riesgo de arritmias graves.
En el grupo de pacientes, de edad avanzada, la interacción que ejerce cada fármaco en específico y debido a sus combinaciones en el tratamiento de las comorbilidades podría contribuir a la cardiotoxicidad derivada de la polifarmacia.16 Estas interacciones motivan que, con frecuencia, se retire a estos pacientes ingresados su tratamiento farmacológico habitual, y todo ello puede conllevar a una descompensación cardiológica de base.12,17
Muchas medicaciones no cardíacas inhiben los canales de potasio, y en pacientes susceptibles se asocian a riesgo de taquicardias tipo TdP. El tratamiento con antibióticos, como quinolonas o azitromicina, aumenta significativamente el riesgo de arritmia cardíaca y MS.18,19
Otros antibióticos macrólidos, incluidas la eritromicina y la claritromicina, metabolizados también por la enzima citocromo P4503A4, aumentan el riesgo de taquicardia ventricular polimórfica (TVP) y MS, especialmente en mujeres.20 La combinación de inhibidores del sistema renina-angiotensina y antibióticos como cotrimoxazol en condiciones de hiperpotasemia, se ha asociado igualmente con un aumento del riesgo.21
La prescripción incorrecta de fármacos en pacientes con la COVID-19, no específicos para SARS-CoV2, según un estudio reciente,22 se asoció con un mayor incremento del QT corregido (QTc) comparado con los pacientes en los que no se prescribieron. Entre los fármacos más utilizados se encuentran: metoclopramida, ondasentrón, loperamida y levofloxacino.
Drogas para el tratamiento de la COVID-19
Efectos adversos
Remdesivir
Es un nucleótido análogo del ácido ribonucleico (ARN) inhibidor de la polimerasa. Se ha demostrado la efectividad in vitro contra varios coronavirus (SARS-CoV, MERS-CoV) y también contra el SARS-CoV-2. Un estudio evaluó su uso en 60 pacientes con la COVID-19 con un compromiso respiratorio severo y se encontró mejoría clínica en un 68 %.23 Entre sus efectos adversos después de administrada la dosis inicial ha sido reportado la hipotensión severa y el PC como se hace mención en la tabla 1 sobre las arritmias asociadas al tratamiento médico de la COVID-19.24
Favipiravir
Este fármaco es un nucleótido análogo del ácido ribonucleico (ARN) inhibidor de la polimerasa. Se evalúan sus posibles efectos benéficos en pacientes con afectación moderada por la COVID-19.25 Su efecto ha sido reportado en la prolongación del intervalo QTc en pacientes con infección por el virus del ébola. Se ha observado la regresión del QTc después de descontinuar el tratamiento.26
Lopinavir/ritonavir
Son fármacos antivirales, utilizados en la infección por el virus de la inmunodeficiencia humana. Han mostrado la actividad in vitro contra los coronavirus SARS-CoV y MERS. Un estudio evaluó su utilidad en la neumonía severa por la COVID-19, donde se documentó una menor mortalidad y falla respiratoria, pero sin una tendencia significativa.27
Se han descrito con su uso como efectos adversos: prolongación del QTc, del intervalo PR, TdP y bloqueo AV de segundo y tercer grado como aparece en la tabla 1.28 Estos efectos han sido más frecuentes cuando se usan concomitantemente con atazanavir.29Cao y otros27 en un estudio de 95 pacientes, documentó solo en 1 caso la prolongación del intervalo QTc, no se registraron otras alteraciones acerca del ritmo en dicho estudio.27
Darunavir
El Darunavir es un inhibidor de la dimerización y de la actividad catalítica de la proteasa del VIH-1 de última generación.30 Su efecto se ha potenciado al asociarse a ritonavir de forma inicial y a cobicistat posteriormente. Se ha usado como monoterapia y en biterapia sobre todo con lamivudina, también con otros fármacos antirretrovirales.31 Sus efectos potenciales son en la prolongación del QT que se producen cuando se asocia a otros antiretrovirales como ritonavir y cobicistat y a fármacos que prolongan el QT, debido a un mecanismo de bloqueo de canales HERG de potasio31,32
Hidroxicloroquina/cloroquina
La cloroquina y su derivado la hidroxicloroquina, son agentes antipalúdicos que bloquean la infección del virus al aumentar el pH endosómico, requerido para la fusión virus-célula (menor glicosilación de los receptores ECA-2),33 que evita la replicación viral, así como la réplica y la liberación del ARN viral. Se ha demostrado in vitro su actividad inhibitoria frente al SARS-CoV-2.34 Además, la hidroxicloroquina dado su efecto antiinflamatorio, principalmente altera el factor de necrosis tumoral alfa (TNFα), las interleucinas (IL-1β, IL-6, IL-12) y las linfoquinas, entre otras, podría atenuar la tormenta de citoquinas observada en casos severos.9,35
Ambos compuestos muestran un potencial (intermedio a tardío) de toxicidad miocárdica, la cual se manifiesta como miocardiopatía restrictiva o dilatada o trastornos de la conducción, atribuidos a inhibición intracelular de enzimas lisosomales en el miocito.
Estos medicamentos bloquean los canales de potasio HERG/Kv 11,136 y pueden causar efectos directos sobre el QT, alteran los canales iónicos de potasio (lf), y las corrientes de iones de calcio (lcaL), que prolonga el intervalo QTc, que desencadena taquiarritmias ventriculares tipo TdP y TVP, e incrementa el riesgo de MS durante la pandemia de la COVID-19.8,37
La toxicidad arrítmica y el riesgo de MS se ve incrementa por la presencia de otros factores como la edad (> 65 años), el sexo (femenino), la presencia de comorbilidades como: cardiopatías, enfermedad renal crónica, diabetes mellitus, alteraciones del medio interno: hipocalcemia, hipopotasemia, hipomagnesemia,8 el uso crónico y las sobredosis (debido a la semivida prolongada del agente de 40 días), y la combinación de estos antimaláricos, con otros fármacos, pueden prolongar el QT (azitromicina)6,36 como se hace mención en la tabla 2.
Han sido publicados varios estudios sobre el riesgo de prolongación del intervalo QT y MSC en pacientes con tratamiento de hidroxicloroquina, hospitalizados estos por la COVID-19. Mercuro y otros38 evaluaron 90 pacientes con la COVID-19 que recibían hidroxicloroquina al (59 % en conjunto con la azitromicina), de los cuales el 20 % desarrollaron prolongación del QTc > 500 ms y hubo un aumento del QTc > 60 ms, que fue mayor con el uso combinado de la azitromicina.
En 1 caso se reportó taquicardia tipo TdP. El uso de diuréticos, QTc basal > 450 ms y el de desarrollo de síndrome de respuesta inflamatoria sistémica fueron considerados predictores de riesgo.
En un estudio realizado por Silva y otros39) evaluó la utilidad de las dosis altas de cloroquina (600 mg cada 12 h por 10 días), dosis que son necesaria en los estudios in vitro para lograr la actividad antiviral, fue suspendido en el brazo las altas dosis por el aumento de la mortalidad, con incremento del QTc > 500 ms en el 19 % de los casos. No se encontraron eventos de taquicardia de puntas torcidas.
Este resultado se repite en otras investigaciones,22,38,39,40,41 lo cual permite concluir que debido a que la terapia con hidroxicloroquina, propuesta para la COVID-19 es relativamente corta entre (5 a 10 días), el riesgo de toxicidad arrítmica probablemente sea bastante bajo,25 por lo que el incremento de la mortalidad en pacientes con formas severas de la enfermedad no parece ser (de predominio) arrítmico.
Un registro multinacional con 96 032 pacientes hospitalizados con la COVID-1942 encontró que aquellos tratados con hidroxicloroquina o cloroquina (con o sin macrólidos) tenían mayor mortalidad, comparado con el grupo control (9,3 %). La mortalidad en los casos en que se indicó hidroxicloroquina fue casi el doble (18,0 %) (HR 1,33; IC 95 % 1,223-1,457) y aumentaba con la combinación de macrólido (23,8 %) (HR 1,447; IC 95 % 1,368-1,531).
En los pacientes tratados con la cloroquina existió también un aumento en la mortalidad (16,4 %) (HR 1,365; IC 95 % 1,218-1,531) e igualmente aumentó con el uso de concomitante de un macrólido (22,2 %) (HR 1,368; IC 95 % 1,273-1,469).
El uso de estos medicamentos, además, se asoció a un mayor riesgo de arritmias ventriculares; hidroxicloroquina (6,1 %) (HR 2,369, IC 95 % 1,935-2,9), hidroxicloroquina con macrólido (8,1 %) (HR 5,106; IC 95 % 4,106-5,983), cloroquina (4,3 %) (HR 3,561; IC 95 % 2,760-4,596) y cloroquina con macrólido (6,5 %) (HR 4,011; IC 95 % 3,344-4,812) en relación al grupo control (0,3 %).
Azitromicina
Los macrólidos han demostrado tener efectos antivirales. En diferentes estudios clínicos ha sido útiles en las infecciones por rinovirus, virus sincitial respiratorio e influenza. Un estudio que incluyó 6 pacientes tratados con la combinación de hidroxicloroquina y azitromicina, al sexto día mostraba un 100 % de curación virológica (PCR negativa en muestras nasofaríngeas). Se ha encontrado además efecto in vitro contra los virus del zika
y el ébola.9
Con el uso de la azitromicina los informes sobre la aparición de taquicardia tipo TdP son aislados, y la prolongación del QTc resulta menos frecuente que lo reportado por otros compuestos (hidroxicloroquina⁄cloroquina).43,44 Los efectos sobre el intervalo QT son atribuidos a su acción sobre la corriente rápida de sodio y, también sobre la corriente L de calcio, según se muestra en estudios realizados en animales de experimentación y preparados celulares humanos.45,46
El riesgo de MS está dado por sus efectos en la prolongación del QTc, la inducción de taquicardia tipo TdP y TVP.25,47 El registro FAERS48 documentó un incremento en el riesgo de la prolongación del QTc por azitromicina cuando se administró en monoterapia o en combinación con hidroxicloroquina.
Una cohorte de pacientes tratados con azitromicina (347,795 prescripciones), dirigida a evaluar el riesgo de muerte cardiovascular, publicada por Ray WA y otros47 concluyó que la administración de la droga en una pauta de 5 días de tratamiento ofrecía un incremento del riesgo para muerte cardiovascular total (HR 2,88; IC 95 % 1,79 - 4,63; p < 0,001), y para MSC (HR 2,71; IC 95 % 1,58-4,64; p < 0,001) respecto a los pacientes en los que no se prescribió antibióticos.
Prospectivamente, 10 días posteriores a la administración de la droga se observó un incremento menor en el riesgo de muerte cardiovascular total (HR 1,86; IC 95 % 1,27-2,73; p = 0,002). El estudio concluyó que un tratamiento de 5 días de azitromicina comparado con otros antibióticos (amoxicilina, ciprofloxacino y levofloxacino) ofrecía un pequeño incremento absoluto del riesgo de muerte cardiovascular. Lo que fue más prominente entre los pacientes con alto riesgo de enfermedades cardiovasculares.
Es fundamental prestar atención no solo a los fármacos que se ensayan para el tratamiento de la infección, incluir, además, los protocolos de actuación, según aparece en la tabla 1 y en la figura 1, también se incluyen otros fármacos que se administran durante el ingreso para tratar otras comorbilidades, concomitando con estas terapias y con el tratamiento cardiológico (de base) en los pacientes, como aparece referenciado en la figura 1A, y que pueden prolongar de manera importante el intervalo QT, según aparece en la tabla 2 y en la figura 1B.43,49
Una de las causas de descompensación del paciente, que propicia la aparición de falla cardíaca y arritmias ventriculares malignas que afectan la supervivencia es la suspensión del tratamiento cardiológico de base (IECA, ARA II, B bloqueadores, anticoagulantes) 12,17 para el control de las enfermedades crónicas como la hipertensión arterial, IC y CI. No se recomienda la suspensión de medicamentos como los inhibidores de la enzima convertidora de angiotensina (IECA) o antagonistas del receptor de angiotensina 2 (ARA II).
El estudio realizado por Lei Fang y otros50 sugirió que los pacientes con enfermedades cardiovasculares que consumen estos fármacos, pueden ser susceptibles a un mayor impacto de la infección por SARS-CoV-2, asociado a la sobre-expresión de ECA2 y una mayor tendencia de evolución a formas graves de la enfermedad. Se produjo una ola de incertidumbre en el ámbito médico y entre los pacientes consumidores de estos fármacos a nivel mundial, acerca de la necesidad en la prescripción y/o suspensión de los tratamientos con estas terapias.
No existen suficientes evidencias que desaconsejen estas terapias.12,35,51,52 Por el contrario; los informes actuales reportan que los pacientes tratados con IECA/ARA-II se asociaron de manera independiente con menor riesgo de mortalidad o enfermedad grave que requieran ingreso en la unidad de cuidados intensivos (HR del uso de IECA/ARA-II 0,666; IC 95 % 0,445-0,997; p = 0,048), cuando estos compuestos se prescribieron solos o en combinación con fármacos para la infección por SARS-CoV-2 (hidroxicloroquina).53,54
Dos ensayos clínicos aleatorizados publicados recientemente,55,56 tuvieron como objetivo evaluar la evolución de los pacientes admitidos por la COVID-19 de acuerdo a la continuidad o discontinuidad del tratamiento con estas terapias, concluyeron que no existieron diferencias entre los pacientes ingresados en el hospital con la COVID-19 que mantuvieron o interrumpieron el tratamiento con los inhibidores del sistema renina-angiotensina.
En ambos estudios se recomendó continuar la prescripción de estos fármacos a los pacientes ingresados en el hospital con la COVID-19 con indicación para el tratamiento.
El temor y la desinformación ocasionada por la pandemia pueden llevar a la falsa percepción de que los fármacos antitrombóticos confieren un mayor riesgo de padecer COVID-19, y por este motivo algunos pacientes interrumpen el tratamiento anticoagulante, lo que incrementa el riesgo de la enfermedad tromboembólica venosa.57,58
Unido a la suspensión del tratamiento, el uso inadecuado de fármacos en el manejo de las complicaciones graves por la COVID-19 como se menciona en la figura 1D, que pueden ocasionar prolongación del intervalo QT y arritmias ventriculares tipo TdP, lo que puede conllevar a la aparición de MS.12,13
El potencial arrítmico también está relacionado con los tratamientos necesarios para el manejo del choque circulatorio en el paciente grave con la COVID-19.59 Una revisión con seis ensayos clínicos aleatorizados (n = 1 400), comparó, noradrenalina y dopamina en pacientes con choque.
Los resultados mostraron un riesgo aumentado de arritmias (HR 2,34; IC 95 % 1,46-3,78) en el brazo de la dopamina.60 Resulta importante evaluar de manera multidisciplinaria la necesidad (o no) del uso de drogas cardiovasculares, como antiarrítmicos (amiodarona, dronedarona, ivabradina, flecainida, propaferona), diuréticos, vasodilatadores, inotrópicos y otras que potencialmente pueden prolongar el QTc como se expone en la tabla 2.17,35
Prevención de la muerte súbita por prolongación del QTc / Tdp en la COVID-19
En la actualidad la evidencia científica disponible no ha demostrado un incremento sustancial de la mortalidad o la admisión en la UCI por causas arrítmicas en pacientes con la COVID-19,22,35 por este motivo el ensayo de nuevas drogas en los protocolos de tratamiento (sin efecto probado aún en la reducción de la mortalidad por la COVID-19) puede estimularse. No debe obviarse que la edad avanzada en pacientes (mayor de 80 años) representa el principal grupo de riesgo para la mortalidad12,14 por la presencia de comorbilidades como la enfermedad cardiovascular, diabetes mellitus, enfermedad pulmonar obstructiva crónica, hipertensión arterial y antecedentes de enfermedad neoplásica,61 donde la presencia de injuria miocárdica conlleva a la aparición de falla cardíaca e isquemia, factores que favorecen la prolongación del QT.35
Todo paciente que acuda a urgencias con un cuadro clínico sugestivo de la COVID-19, se recomienda (antes y durante el tratamiento), la monitorización del intervalo QT, como se expresa en la figura 2, dada su variación con la frecuencia cardíaca, debe corregirse (QTc) a través de la fórmula de Bazett (universalmente utilizada). Adicionalmente, deben evaluarse los factores modificables que favorecen su prolongación, como alteraciones electrolíticas: hipocalcemia (calcio < 4,65 mg∕dL), hipocalemia (potasio < 3,4 mmol∕L) e hipomagnesemia (magnesio < 1,7 mg∕dL) y medicamentos de uso crónico que pudieran prolongar el QTc (uso concurrente ≥ 1 fármaco).8,43,49
Existen factores no modificables ante los cuales el rigor en la monitorización del QTc y la toma de decisiones en estos pacientes debe ser más estricto.8
Se incluyen:
Demográficos (edad > 65 años, sexo femenino),
Cardiovasculares (síndrome coronario agudo, bradicardia < 45 ∕ min, falla cardíaca (FEVI < 40 %), síndrome de QT prolongado congénito, miocardiopatía hipertrófica, estado de posreanimación o antecedentes familiares de QTc prolongado o MS).
Neurológicos (evento de accidente cerebrovascular, hemorragia subaracnoidea o trauma craneoencefálico en la última semana y sincope o estatus convulsivo en las primeras 24 h).
Endocrinológicos (feocromocitoma, hipoglucemia en ausencia de diabetes, diabetes mellitus).
Otros factores (anorexia nerviosa, desnutrición severa, daño renal crónico con necesidad de diálisis).
La toma de decisiones en la aplicación de protocolos terapéuticos en pacientes con la COVID-19 con QTc prolongado basalmente, o con incremento del QTc después de iniciado el tratamiento, debe pasar por el análisis de la relación riesgo/beneficio, definida por un equipo multi e interdisciplinario donde se integren infectólogos, internistas, cardiólogos e intensivistas.8 Si antes del inicio del tratamiento o durante el mismo se encuentra un factor modificable, este debe ser corregido según se demuestra en la figura 2.
Un objetivo terapéutico es llevar el potasio a > 4 mEq/ L y el magnesio a > 2 mg/dL.62 Es importante evaluar la procedencia (o no) en la utilización de drogas cardiovasculares, como antiarrítmicos (ivabradina, amiodarona, dronedarona, propaferona), diuréticos y otras capaces de prolongar el QTc43,49 y suspenderlas, si estas han sido prescritas al paciente con anterioridad.35

Fig. 2 . Enfoque para mitigar el riesgo de muerte súbita cardíaca inducida por Tdp en pacientes que reciben tratamiento farmacológico para la COVID-19 con drogas que prolongan el QTc.
Se concluye que ha sido demostrado el efecto deletéreo de los fármacos en el tratamiento de la enfermedad de la COVID-19 y sus posibles asociaciones a la terapéutica del paciente, en la prolongación del tiempo de repolarización ventricular cardíaca, con traducción eléctrica por intervalo QT prolongado y su contribución a la génesis de arritmias malignas, potencialmente fatales, capaces de desencadenar un paro cardíaco y evolucionar a la MS.
Los factores relacionados con el tratamiento médico del paciente para sus enfermedades cardiovasculares previas, el empleo concomitante de drogas para otras comorbilidades, el ensayo de nuevas drogas que se investigan en la actualidad para el tratamiento de la enfermedad y el uso inadecuado de fármacos en complicaciones graves por la COVID-19, pueden ocasionar prolongación del intervalo QT y arritmias ventriculares tipo TdP, lo que puede conllevar a la aparición de MS.
Todo paciente que acuda a urgencias con un cuadro clínico sugestivo de la COVID-19 se recomienda (antes y durante el tratamiento), la monitorización del intervalo QT. Deben evaluarse factores modificables que favorezcan su prolongación. La toma de decisiones en la aplicación de protocolos terapéuticos en pacientes con la COVID-19 con QTc prolongado basalmente, o con incremento del QTc, después de iniciado el tratamiento, debe pasar por el análisis de la relación riesgo/beneficio, definida por un equipo multiinterdisciplinario.














