My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Pediatría
Print version ISSN 0034-7531
Rev Cubana Pediatr vol.86 no.4 Ciudad de la Habana Oct.-Dec. 2014
ARTÍCULO ORIGINAL
Enteropatía perdedora de proteínas en pacientes con corazón univentricular
Protein-losing enteropathy found in patients with univentricular heart
Dr. Alfredo Naranjo Ugalde,I Dr.C. Eugenio Selman-Housein Sosa,I Dra. Maritza Oliva Pérez,II Dr.C. Francisco Carballés García,I Dra. María Teresa Consuegra Chouarey,I Dra. Eutivides Aguilera SánchezI
ICardiocentro Pediátrico "William Soler". La Habana, Cuba.
IIPoliclínico Docente "Salvador Allende". La Habana, Cuba.
RESUMEN
Introducción: la enteropatía perdedora de proteínas puede aparecer en la evolución de los pacientes con corazón univentricular que sobreviven a la derivación cavopulmonar total. Una vez que se diagnostica, la mortalidad es alta.
Objetivo: identificar los posibles factores de riesgo de esta complicación.
Métodos: se realizó un estudio de cohorte prospectivo de la evolución en 74 pacientes con derivación cavopulmonar total, intervenidos en el Cardiocentro Pediátrico "William Soler", desde enero de 1992 hasta enero de 2011.
Resultados: el tiempo promedio de evolución fue de 8 años. Sufrió enteropatía perdedora de proteínas 8,1 % de los pacientes. Se presentó con mayor frecuencia en los operados con la técnica intratrial, en los operados con más de 6 años de edad, y en quienes sufrieron derrames pleurales persistentes en el posoperatorio inmediato. Se encontró relación significativa entre la enteropatía y la disfunción ventricular posoperatoria, con RR= 11,45 (IC: 95 %: 2,37 a 55,16). El análisis multivariado identificó a la disfunción ventricular como factor de riesgo.
Conclusión: la detección de disfunción ventricular en la evolución del paciente con derivación cavopulmonar debe orientar el tratamiento, en aras de evitar la aparición de enteropatía perdedora de proteínas.
Palabras clave: enteropatía perdedora de proteínas, univentricular, cavopulmonar.
ABSTRACT
Introduction: protein-losing enteropathy may occur in the progression of patients with univentricular heart, who survived total cavopulmonary shunt. Once diagnosed, the mortality rate of the condition is high.
Objective: to identify the possible risk factor of this complication.
Methods: a prospective cohort study of the progression of 74 patients with total cavopulmonary shunt was conducted from January 1992 through January 2011. They had been operated on at "William Soler" pediatric cardiac center.
Results: the average time of progression was 8 years. In this group, 8.1 % of patients suffered protein-losing enteropathy that was more frequently seen in patients operated on by the intraatrial technique, aged over 6 years and in those suffering persistent pleural effusion in the immediate postoperative period. Significant statistical relation was found between enteropathy and postoperative ventricular dysfunction with RR= 11.45 (CI: 95 %: 2.37 to 55.16). The multivariate analysis showed that the ventricular dysfunction was a risk factor.
Conclusions: Detection of the ventricular dysfunction in the progression of a patient with cavopulmonary shunt should guide the treatment to avoid occurrence of protein-losing enteropathy.
Keywords: protein-losing enteropathy, univentricular, cavopulmonary.
INTRODUCCIÓN
El corazón normal tiene una doble conexión atrioventricular con 2 orificios permeables y 2 válvulas aurículoventriculares (AV), que permiten el paso de la sangre de las aurículas a 2 ventrículos competentes; el derecho, conectado al tronco de la arteria pulmonar (TAP); y el izquierdo, conectado a la aorta, a través de las que impulsan la circulación pulmonar y sistémica.1,2
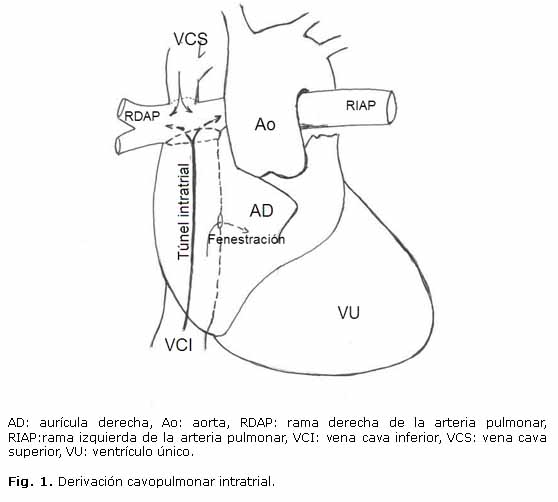
El tratamiento quirúrgico actual es la derivación cavopulmonar total (DCPT) intra o extracardiaca3,4 (Fig. 1 y 2).
En la evolución a mediano y largo plazo de estos pacientes puede aparecer la enteropatía perdedora de proteínas (EPP), que se define como la pérdida anormal de proteína sérica en la luz del tracto gastrointestinal.5 En 1980 se describió por primera vez en un paciente con circulación univentricular.6 La prevalencia se reporta entre 1 a 11 % de los operados.7
El aumento de las presiones en el circuito de la DCPT provoca la pérdida de la integridad de la red vascular y el aumento de la permeabilidad, además del aumento de las resistencias en el compartimento vascular esplácnico, que se manifiesta en la pérdida de flujo diastólico arterial mesentérico.8
La causa de la EPP se relaciona con la inflamación, linfangiectasia, congestión venosa crónica9 y alteraciones de la membrana basal del enterocito,7 que produce edema de la pared intestinal, malabsorción y esteatorrea secundaria. Comienza con diarreas, dolor abdominal, edemas periféricos, derrames pleurales, ascitis, tromboembolia, tetania, pérdida de peso, compromiso de la talla por un balance nitrogenado negativo, y finalmente, la muerte.7 El examen de laboratorio revela niveles bajos séricos de proteínas y albúmina. El diagnóstico se realiza por la presencia de alfa 1 antitripsina en heces fecales.10,11 No existe un tratamiento eficaz, y la expectativa de vida se reduce una vez que se diagnostica, a 5 años en 50 % de los pacientes.5,12,13
La escasa referencia a factores de riesgo posoperatorios para el desarrollo de la EPP9,14-16 motivó el estudio actual, con el objetivo de identificar los posibles factores de riesgo en la evolución posoperatoria de los pacientes que viven con una derivación cavopulmonar total.
MÉTODOS
Se realizó un estudio observacional, analítico, de cohorte prospectivo, desde enero de 1992 a enero de 2012 en el Cardiocentro Pediátrico "William Soler".
La muestra se constituyó con pacientes con un año de supervivencia después de la derivación cavopulmonar total intratrial o extracardiaca, cuyos tutores legales expresaron su consentimiento para la inclusión en esta investigación. Se excluyeron a los pacientes con derivación atriopulmonar previa, que se operaron para conversión a derivación cavopulmonar, y a quienes sería imposible mantener el seguimiento evolutivo en el tiempo mínimo de estudio posoperatorio de un año. Los dos grupos de la muestra se conformaron según la realización de una u otra técnica quirúrgica, resultado de la decisión del equipo quirúrgico actuante en cada paciente.
Se midieron las presiones arteriales pulmonares y diastólicas ventriculares al final de la intervención quirúrgica. Se halló la media de la variación de las presiones pulmonares y diastólicas ventriculares en el tiempo de seguimiento de los pacientes, a quienes se les indicó estudio hemodinámico al menos una vez después de la DCPT. La función ventricular se evaluó por ecocardiograma a través de la fracción de eyección (FE). Se definió disfunción cuando la FE fue menor de 50 %.17
El diagnóstico de EPP se basó en la aparición de síntomas digestivos, hipoproteimemia e hipoalbuminemia una vez descartadas otras causas, durante consultas semestrales y los ingresos programados al año de operado, a los 3, a los 5 y un momento final coincidente con la terminación del estudio. En todos los pacientes el diagnóstico fue realizado por el mismo grupo básico de trabajo.
Los datos se almacenaron y procesaron en una base creada en el programa estadístico SSPS 13.5 (SPSS Inc., Chicago, Illinois, Estados Unidos). Se construyeron distribuciones de frecuencias y tablas de contingencia. Como medidas de resumen se emplearon los porcentajes para las variables cualitativas y medias y desviaciones estándar en las variables cuantitativas. Para el análisis de asociación entre variables cualitativas se empleó la prueba no paramétrica de independencia chi cuadrado de Pearson y la prueba exacta de Fisher. Para las variables cuantitativas se empleó la prueba paramétrica t de student, previo análisis de homogeneidad de varianzas.
Se relacionaron con la aparición de EPP al tipo de derivación, el diagnóstico morfológico, el tipo de ventrículo principal, la presencia de isomerismo, la disfunción ventricular medida por ecocardiografía, la ocurrencia de derrames pleurales persistentes en el posoperatorio inmediato, la estrategia quirúrgica en 1 o 2 tiempos, el intervalo entre las intervenciones, la edad, el tiempo de seguimiento y las variaciones de presión arterial y del ventrículo principal.
Para la identificación de factores de riesgo de EPP se utilizó la regresión logística binaria. Se relacionó la variable dependiente EPP con las independientes: edad, tipo de derivación cavopulmonar total y el antecedente de derrames pleurales persistentes. Se analizó el exponencial de los coeficientes (Exp b) del modelo como estimadores de la razón de ventaja u Odds Ratio (OR). Para evaluar la calidad del ajuste se utilizó el estadígrafo de Hosmer y Lemeshow.18
Para validar los resultados en términos de significación se utilizó un nivel de confianza de 95 %, y se consideró significativo todo valor de p≤ 0,05 para el estadígrafo asociado a la prueba. Para analizar la relevancia clínica se calculó el riesgo relativo (RR). Se calcularon como medidas de impacto, la reducción absoluta del riesgo (RAR) y el número necesario a dañar (NND).19,20
Para realizar esta investigación se contó con la aprobación del Consejo Científico y del Comité de Ética del Cardiocentro Pediátrico "William Soler". El proyecto recibió el aval de la Academia de Ciencias de Cuba (ACC) perteneciente al Ministerio de Ciencia, Tecnología y Medio Ambiente (CITMA). Se respetó lo establecido en los principios básicos de la Declaración de Helsinki, que contiene las recomendaciones a seguir en la investigación biomédica en seres humanos.21
RESULTADOS
La muestra quedó constituida por 74 pacientes intervenidos desde enero de 1992 hasta enero de 2011, y evaluados hasta enero de 2012 en el Cardiocentro: 43 operados con derivación cavopulmonar total intratrial (DCPTIA) y 31 con derivación cavopulmonar total extracardiaca (DCPTEC).
Durante un promedio de 8,85 ± 5,83 años de evolución, la EPP se diagnosticó en 6 pacientes (tabla 1), a un promedio de 4,42 ± 3,36 años de realizada la DCPT. En 5 pacientes se había realizado DCPT IA, y todos tenían ventrículo de morfología izquierda. El tipo de técnica quirúrgica no mostró relación significativa con la EPP. Cinco fueron operados con más de 6 años de edad, todos se intervinieron en 2 estadios, y el intervalo entre la derivación parcial y la total fue mayor de 4 años en 4 de ellos.
Se encontró asociación entre la aparición de EPP y la disfunción ventricular posoperatoria (p= 0,004; RR= 11,45 [IC: 95 %: 2,37 a 55,16]). La reducción absoluta del riesgo de EPP en presencia de disfunción ventricular, fue -0,33 (IC: 95 %: -0,62 a -0,04), lo que significa en realidad un aumento del riesgo, y el número necesario de pacientes a dañar fue 4 (IC: 95 %: 2 a 23).
El intervalo entre derivaciones y la edad en el momento de la DCPT fue mayor en quienes desarrollaron EPP, pero sin diferencias significativas. La tabla 2 muestra que las variaciones en las presiones arterial pulmonar y ventricular, tampoco se relacionaron con la EPP. El análisis multivariado mostró una probabilidad mayor en 20 veces de desarrollo de la EPP si aparece disfunción posoperatoria (p= 0,004; Exp β: 24,63) (tabla 3).
Luego del alta hospitalaria, y hasta finalizar este estudio, fallecieron 5 pacientes, 3 con DCPTIA; 2 con EPP, uno de ellos con sangrado digestivo como evento final.
DISCUSIÓN
La EPP se reporta de 1 a 11 % de los pacientes que viven con una DCPT.7 En esta investigación constituyeron 8,1 %.
Se asocia a una mortalidad de 30 a 50 % a los 5 años luego del diagnóstico.22,23 Aunque no se ha identificado la etiología, las lesiones residuales anatómicas, la pérdida del ritmo cardiaco normal o el hallazgo de la ausencia de flujo diastólico, provocan aumento de las resistencias vasculares mesentéricas,7 y como consecuencia, la EPP; sin embargo, muchos pacientes no llegan a presentar esta complicación, y otros, con presiones pulmonares menores de 15 mmHg la desarrollan, lo que hace plantear la importancia de algún otro factor predisponente individual.14
En un estudio de la hemodinámica antes y después del inicio de la EPP en 7,8 % de los pacientes con DCPT en un centro,9 se encontró que la presión venosa central y las resistencias pulmonares fueron elevadas, con diferencia significativa con respecto al grupo de excelente evolución, también la fracción de eyección fue significativamente menor en el grupo con EPP. El aumento de la presión venosa puede ser consecuencia de disfunción ventricular, del aumento de la presión arterial pulmonar y de arritmias, de estado de bajo gasto cardiaco o de sobrecarga de volumen por colaterales arteriovenosas, situaciones estas frecuentes en este grupo de pacientes.9
En la presente investigación, se detectó una alta probabilidad de sufrir esta complicación, una vez detectada la disfunción ventricular de moderada a grave en la evolución posoperatoria. Según el NND hallado (NND 4, IC: 95 %: 2 a 23), cada 4 pacientes con disfunción ventricular, 1 presentará EPP. El tratamiento y vigilancia de la evolución debe dirigirse, entonces, a la búsqueda temprana de este indicador.
A diferencia de Rogers,24 quien enuncia como factor de riesgo de la EPP el antecedente de derrames pleurales, no se encontró en esta investigación relación significativa entre ellos. Al igual que reportó Angeli,25 fue similar la distribución de los pacientes con EPP, según tipo de DCPT, y sin relación significativa.
En 5,1 % de los 234 pacientes estudiados por Yu y otros,16 se desarrolló EPP en un intervalo promedio de 2 años luego de la DCP. Ellos detectaron que en los pacientes con EPP existió una disminución significativa de la distensibilidad o compliancia vascular pulmonar. La media de la variación de las presiones pulmonares encontrada en la investigación del Cardiocentro Pediátrico "William Soler", fue mayor, aunque no significativa, en los pacientes con EPP, lo que pudiera corresponderse con la disminución de la compliancia vascular pulmonar referida.
La principal limitante de este estudio es la ausencia del diagnóstico por el análisis de alfa 1 antitripsina en heces fecales en nuestros laboratorios, por lo que el diagnóstico es solo según la sospecha clínica. En el diseño del estudio no se incluyó la influencia de los tratamientos médicos en el comportamiento hemodinámico y clínico posoperatorio. Otra limitante es la diferencia de tiempo de seguimiento. Debido a los riesgos asociados al procedimiento, no todos los pacientes accedieron al estudio por cateterismo cardiaco en el posoperatorio.
Se concluye que la detección de disfunción ventricular en la evolución del paciente con DCPT debe orientar al tratamiento, en aras de evitar la aparición de EPP. Se debe instrumentar en nuestros laboratorios clínicos la detección de alfa 1 antitripsina en heces fecales, para facilitar y documentar el diagnóstico de EPP.
REFERENCIAS BIBLIOGRÁFICAS
1. Jacobs ML, Anderson RH. Nomenclature of the functionally univentricular heart. Cardiol Young. 2006;16(Suppl 1):3-8.
2. Naranjo AM, Rodríguez JH, Consuegra MT, Guillén AG, Ladino KR, Sánchez EA. Morbilidad y mortalidad posoperatoria en niños con corazón univentricular según diagnóstico morfológico. Rev Cubana Pediatr. 2013;85(3):346-55.
3. Leval Md, Kilner P, Gewillig M. Total cavopulmonary connection: a logical alternative to atriopulmonary connection for complex Fontan operations. Experimental studies and early clinical experience. J Thorac Cardiovasc Surg. 1988;96:682-95.
4. Marcelletti C, Corno A, Giannico S. Inferior vena cava-pulmonary artery extracardiac conduit. A new form of right heart bypass. J Thorac Cardiovasc Surg. 1990;100:228-32.
5. Johnson JN, Driscoll DJ, O'Leary PW. Protein-losing enteropathy and the Fontan operation. Nutr Clin Pract. 2012;27:375-84.
6. Crupi G, Locatelli G, Tiraboschi R, Villani M, Tommasi MD, Parenzan L. Protein-losing enteropathy after Fontan operation for tricuspid atresia (imperforate tricuspid valve). Thorac Cardiovasc Surg. 1980;28:359-63.
7. Rychik J. Protein-losing enteropathy after Fontan operation. Congenit Heart Dis. 2007;2:288-300.
8. Uzun O, Wong JK, Bhole V, Stumper O. Resolution of protein-losing enteropathy and normalization of mesenteric Doppler flow with sildenafil after Fontan. Ann Thorac Surg. 2006;82:39-40.
9. Ohuchi H, Yasuda K, Miyazaki A, Kitano M, Sakaguchi H, Yazaki S, et al. Haemodynamic characteristics before and after the onset of protein losing enteropathy in patients after the Fontan operation. Eur J Cardiothorac Surg. 2013;43:e49-e57.
10. Florent C, L'Hirondel C, Desmazures C, Aymes C, Bernier JJ. Intestinal clearance of alpha 1-antitrypsin. A sensitive method for the detection of protein-losing enteropathy. Gastroenterology. 1981;81:777-80.
11. Fujii T, Shimizu T, Takahashi K. Fecal alpha1-antitrypsin concentrations as a measure of enteric protein loss after modified Fontan operations. J Pediatr Gastroenterol Nutr. 2003;37:577-80.
12. Chin AJ, Whitehead KK, Watrous RL. Insights after 40 years of the Fontan operation. World Journal for Pediatric and Congenital Heart Surgery. 2010;1(3):328-43.
13. O'Donnell CP, Landzberg MJ. The 'failing' Fontan circulation. Progress in Pediatric Cardiology. 2002;16:105-14.
14. Ostrow A, Freeze H, Rychik J. Protein-losing enteropathy after Fontan operation: investigations into possible pathophysiologic mechanisms. Thorac Surg. 2006;82:695-700.
15. Yetman AT, Everitt MD. The role of iron deficiency in protein losing enteropathy following the Fontan procedure. Congenit Heart Dis. 2011;6:370-3.
16. Yu JJ, Yun TJ, Yun SC, Im YM, Lee SC, Shin HJ, et al. Low pulmonary vascular compliance predisposes post-Fontan patients to protein-losing enteropathy. Int J Cardiol. 2013;165(3):454-7.
17. Kotani Y, Kasahara S, Fujii Y, Yoshizumi K, Oshima Y, Otsuki SI, et al. Clinical outcome of the Fontan operation in patients with impaired ventricular function. Eur J Cardiothorac Surg. 2009;36:683-7.
18. Silva LC, Barroso IM. Construcción y evaluación de modelos. En: Albajar RA, Murgiondo JE, Gómez GR, Tejedor FJT, editores. Regresión logística. Madrid: La Muralla SA; 2003. p. 73-9.
19. Miron JA, Alonso M. Medidas de frecuencia, asociación e impacto en investigación aplicada. Med Segur Trab. 2008;211:93-102.
20. Tajer CD. Ensayos terapéuticos, significación estadística y relevancia clínica. Rev Argent Cardiol. 2010;78(4):385-90.
21. World Medical Association. Declaration of Helsinki-Ethical principles for medical research involving human subjects. 59th. WMA General Assembly, Seoul, October 2008 [homepage en Internet] World Medical Association, Inc.; 16 Enero 2011 [citado 16 de marzo de 2011]. Disponible en: http://www.wma.net/en/30publications/10policies/b3
22. Ghanayem N, Berger S, Tweddell J. Medical management of the failing Fontan. Pediatr Cardiol. 2007;28:465-71.
23. Silvilairat S, Cabalka A, Cetta F, Grogan M, Hagler D, O'Leary P. Protein-losing enteropathy after the Fontan operation: associations and predictors of clinical outcome. Congenit Heart Dis. 2008;3:262-8.
24. Rogers LS, Glatz AC, Ravishankar C, Spray TL, Nicolson SC, Rychik J, et al. 18 years of the Fontan operation at a single institution. Results from 771 consecutive patients. J Am Coll Cardiol. 2012;60:1018-25.
25. Angeli E, Napoleone CP, Balducci A, Formigari R, Luigi Lovato, Candini L, et al. Natural and modified history of single-ventricle physiology in adult patients. Eur J Cardiothorac Surg. 2012;42(6):996-1002.
Recibido: 6 de marzo de 2014.
Aprobado: 21 de abril de 2014.
Alfredo Naranjo Ugalde. Cardiocentro Pediátrico "William Soler''. Calle 100 y Perla, reparto Altahabana, municipio Boyeros. La Habana, Cuba. Correo electrónico: naranjob@infomed.sld.cu