Introducción
La infección del tracto urinario (ITU) es la infección bacteriana no transmisible más común en niños, pero con mayor frecuencia de presentación en recién nacidos y lactantes1 y entre aquellos febriles menores de 2 años de edad el diagnóstico de ITU se realizó en 15,5 % (IC 95 %; 13,8-17,3 %).2 El criterio diagnóstico de esta infección viene dado por una bacteriuria significativa (dependiendo del método de recolección de orina),3 además de las manifestaciones clínicas, pero existe mucho debate en cuanto a la presencia de leucocituria. Por lo general se acepta que un lactante con ITU febril tiene una infección urinaria alta,4 mientras no se demuestre lo contrario, y debe ser la regla que por una ITU alta haya presencia de leucocituria.5
La presencia de leucocituria nos orienta hacia la probabilidad de ITU,5,6 ya que indica la inflamación ocasionada por la infección, pero se tiene el inconveniente que el resultado del cultivo de orina no está disponible rápidamente, que confirmaría el diagnóstico de ITU sospechado en la evaluación inicial.7
Por lo general, ante la presencia de un recién nacido o de un lactante con un cuadro clínico sugerente de infección y en quien se identifica en el examen de orina conteo de leucocitos elevado, el médico opta por recoger un urocultivo confirmatorio y después de ello iniciar tratamiento antibiótico apropiado a este tipo de infección, a la espera del resultado del cultivo de orina.8,9 Si más adelante el urocultivo resulta positivo y de esta manera se corrobora el diagnóstico de ITU, además de lo apropiado de haber indicado tratamiento antibiótico, es corriente completar el esquema de antibioticoterapia seleccionado, sin embargo, sucede con bastante frecuencia que, ante un paciente con sospecha de ITU, tanto por la clínica, como por la presencia de leucocituria significativa en la cituria, no se pueda recoger la muestra de orina para cultivo, o que una vez recolectada la muestra de orina, el urocultivo puede resultar contaminado y también puede ser que en ocasiones, los pacientes son tratados con antibióticos antes de realizar el urocultivo, lo que podría ofrecer un cultivo de orina sin crecimiento bacteriano. De esta manera, se genera incertidumbre en el médico de asistencia, quien esperaba la confirmación de su sospecha diagnóstica y de si debería o no mantener la antibioticoterapia, aun teniendo la convicción de que con un examen de orina y conteo de leucocitos tan elevado es muy probable la presencia de ITU.8,10
Teniendo en cuenta todos los elementos planteados anteriormente se decide realizar la presente investigación, con el objetivo de determinar si la leucocituria significativa es un marcador de ITU, aún sin un cultivo de orina positivo.
Métodos
Se realizó un estudio descriptivo y retrospectivo de los pacientes egresados de los Servicios de Neonatología y Nefrología del Hospital Pediátrico Universitario “Juan Manuel Márquez”, en el que se incluyeron los niños menores de 2 años de edad con ITU confirmada (con urocultivos positivos) o sospechada (sin un cultivo de orina positivo, pero con leucocituria significativa), en el período comprendido de enero de 2018-diciembre 2019. El total de pacientes seleccionados fue de 124 casos.
Los casos fueron identificados del libro de ingresos de los servicios de neonatología y nefrología mencionados, y se solicitó el permiso establecido al departamento de archivo del propio hospital para la revisión de las historias clínicas de los pacientes.
Un equipo de especialistas de neonatología y pediatría ha estado constantemente trabajando desde el punto de vista asistencial e investigativo, bajo un criterio uniforme de diagnóstico y atención de esta entidad, durante el período de esta investigación, la cual incluyó además el seguimiento de los casos por consulta externa en que se continuó la evaluación clínica y de radioimagen protocolizada.
Los datos de cada paciente se recogieron en una encuesta individual y periódicamente fueron introducidos en la base de datos por dos médicos, los que al final verificaron estos datos para corregir errores en su entrada.
Las variables del estudio fueron: edad cronológica, sexo, resultado del examen de cituria, resultado del urocultivo, microorganismo causal si resultó identificado, manifestaciones clínicas, intensidad de la fiebre, resultado del conteo global de leucocitos sanguíneos, velocidad de sedimentación globular (VSG), proteína C reactiva (PCR) cualitativa y del ultrasonido (US) de riñón y vías urinarias, así como de la uretrocistografía miccional (UCGM).
En el examen citoquímico de orina no centrifugada (cituria) se tuvo el criterio para definir leucocituria cuando hubo presencia de leucocitos> 10 000/ml y leucocituria significativa cuando hubo presencia de leucocitos > 100 000/ml (a veces informada como campo cubierto de leucocitos).
El diagnóstico de ITU confirmada se estableció sobre las bases de la presentación de manifestaciones clínicas sugerentes de infección, un examen de cituria con leucocituria y la confirmación por el crecimiento de un solo microorganismo en cualquier cantidad de unidades formadoras de colonias (UFC)/ml en muestras de orina tomadas por punción vesical suprapúbica (predominantemente en recién nacidos), o más de 10 000 UFC/ml cuando fue por cateterismo vesical, o más de 100 000 UFC/ml por las otras técnicas de recolección de orina.
Para las técnicas de punción vesical y cateterismo solo se necesitó de una muestra de orina, pero para las otras técnicas fue imprescindible contar con 2 muestras de orina obtenidas en momentos diferentes y que tuvieran el mismo microorganismo. El diagnóstico de ITU sospechada se estableció sobre las bases de la presentación de manifestaciones clínicas sugerentes de infección, un examen de cituria con leucocituria significativa y no contar con un resultado de urocultivo, o que hubiera sido contaminado, o sin crecimiento bacteriano.
Las muestras de orina recogidas por cualquiera de las técnicas señaladas, con las medidas establecidas en cada una de ellas para obtener una muestra limpia, se procesaron de inmediato, o se conservaron a temperatura de 4 ℃ hasta su procesamiento. Partiendo del microorganismo aislado en la muestra de orina, se procedió a su identificación mediante técnicas estandarizadas en nuestro laboratorio de microbiología.
A todos los pacientes se les realizó US de vías urinarias y aquellos niños con ITU atípica y alteraciones ultrasonográficas, se le indicó UCGM, una vez que fue controlada la infección. En la realización de la UCGM se utilizó la técnica estándar, con llenado completo de la vejiga con una sustancia de contraste y se verificaron por visión de pantalla la fase de llenado y de micción espontánea. En casos puntuales se tomaron de 3 a 4 vistas radiográficas.
Los resultados se presentaron en medidas de resumen en números absolutos y relativos (porcentajes). La comparación de diferentes variables categóricas clínicas, de laboratorio y de radioimagen, entre el grupo de pacientes con ITU confirmada con el de ITU sospechada, se realizó mediante la prueba de contingencia χ² (Ji-cuadrada) o test exacto de Fisher si fuera necesario. Los análisis estadísticos se realizaron empleando el programa Epidat 3.
Desde el punto de vista ético la investigación fue aprobada por el Consejo Científico y del Comité de Ética de las Investigaciones del hospital. Solo se utilizaron los resultados para fines científicos y se respetó la confidencialidad de la información.
Resultados
Los lactantes (1-11 meses de vida), fueron los pacientes más representados con 60 casos (48,4 %) del total, seguidos de 45 recién nacidos (36,3 %). Predominaron los casos del sexo masculino en 67 casos (54,0 %), principalmente en el período neonatal (33/45), pero se invirtió a ser más frecuente la ITU en el sexo femenino para aquellos de 12 a 23 meses de edad (16/19).
Se le realizó el urocultivo a la mayoría de los pacientes, aunque no se pudo contar con el resultado de este análisis en 7 niños (5,6 %). De los 117 urocultivos realizados, en 84 casos (71,8 %) los resultados fueron positivos, lo que representa casi las tres cuartas partes del total de muestras analizadas, urocultivos negativos 19 (16,2 %) y contaminados 14 (12,0 %).
Escherichia coli se aisló en 66 (78,6 %) de los niños estudiados con urocultivo positivo. Para los microorganismos no E. coli el más frecuente fue Klebsiella sp., representado en 8 casos (44,4 %) de este subgrupo. En otros microorganismos se encontraron Proteus sp., Pseudoma aeruginosa, Hafnia alvei, cada uno de estos en 2 pacientes y Enterobacter sp., Staphylococcus aureus, Staphylococcus coagulasa negativo y Morganella morganii en un solo caso para cada uno de estos últimos microorganismos.
Todos los pacientes, tanto los que tuvieron ITU confirmada por urocultivo positivo, como aquellos con ITU sospechada al no poder confirmarse por urocultivo, pero que tenían un examen de cituria con leucocituria significativa (>100 000 leucocitos/ml), presentaron alguna manifestación clínica y fue la fiebre en ambos grupos la de mayor frecuencia y el fallo de medro, la de menor afectación (Tabla 1).
Se remarcó la intensidad de la fiebre entre los pacientes febriles y así se identificaron niños que padecieron fiebre ≥ 39 °C.
Otras manifestaciones exploradas, como las urinarias y digestivas, categorizadas en presentes o no, así como desglosadas en cuales eran en particular, también padecieron los pacientes en 28,2 % y 29,8 %, respectivamente, sin embargo, no hubo diferencias estadísticamente significativas al compararse ambos grupos de casos para cada una de estas manifestaciones clínicas, al categorizarse en presentes o no.
Tabla 1 Manifestaciones clínicas según infección del tracto urinario con urocultivo positivo o infección del tracto urinario con urocultivo no positivo y leucocituria significativa
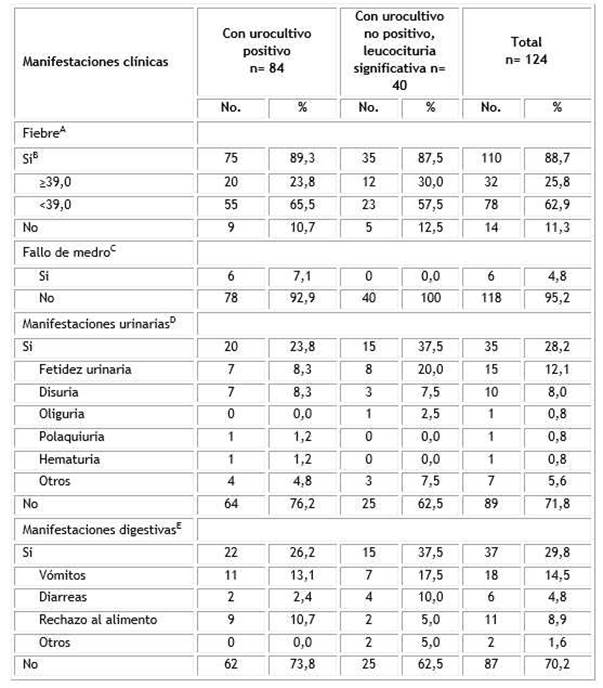
Porcentajes calculados de la n respectiva para cada columna.
A p= 0,9927; B p= 0,5524; C p= 0,1987; D p= 0,1707; E p=0,2816.
El reactante de fase aguda que mayor variación presentó fue la VSG (Tabla 2). En 88 pacientes (71,0 %) su valor fue mayor que el límite de referencia y superó al hallazgo de leucocitosis en que hubo 35 pacientes (28,2 %) y casi 3 veces más a los casos con PCR positiva que resultaron ser 26 (21,0 %). Para los reactantes de fase aguda no se detectaron diferencias estadísticamente significativas al contrastar los dos grupos de pacientes.
Tabla 2 Reactantes de la fase aguda según infección del tracto urinario con urocultivo positivo o infección del tracto urinario con urocultivo no positivo y leucocituria significativa
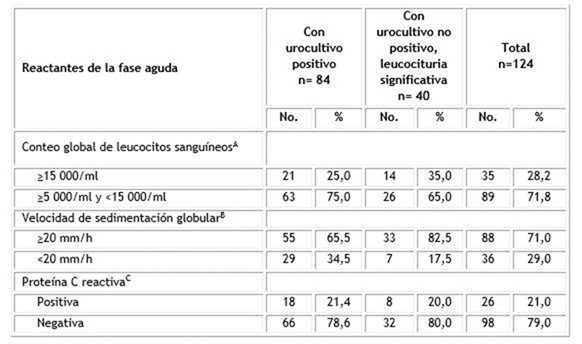
Porcentajes calculados de la n respectiva para cada columna.
A p=0,3456; B p=0,0817; C p=0,9575
Como parte de la evaluación de radioimagen, todos los pacientes tenían realizado US de riñón y vías urinarias, pero el estudio con UCGM solo se realizó en 10 niños para ambos grupos establecidos (Tabla 3). Resultaron con hallazgos positivos por el estudio ultrasonográfico 25 pacientes (20,2 %), comúnmente dilataciones pielocaliciales. Respecto a la UCGM, aunque solo se realizó en 10 pacientes, en 5 (50,0 %) se encontró alguna alteración, dos niños con doble sistema excretor complicado con reflujo vésico-ureteral y ureterocele y otros 3 con reflujo vésico-ureteral primario. No existió diferencias estadísticamente significativas en cuanto a los estudios de imágenes al cotejar los pacientes que tuvieron ITU confirmada por urocultivo positivo, como aquellos con ITU sospechada al no poder confirmarse por urocultivo, pero que tenían un examen de cituria con leucocituria significativa (>100 000 leucocitos/ml).
Tabla 3 Estudios imagenológicos según infección del tracto urinario con urocultivo positivo o infección del tracto urinario con urocultivo no positivo y leucocituria significativa
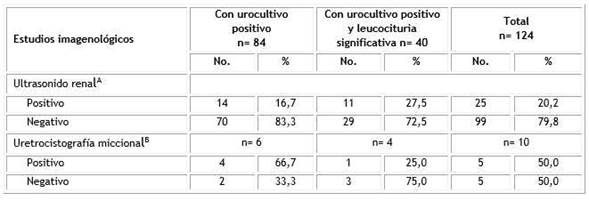
Porcentajes calculados de la n respectiva para cada columna; uretrocistografía miccional (solo se realizaron el estudio 10 pacientes)
A p= 0,2435; B p= 0,5186
Discusión
En este estudio se seleccionaron niños menores de 2 años de edad en que es más común la ocurrencia de ITU, principalmente en el primer año de vida como está descrito en la literatura.1 Como se conoce, los varones son afectados más frecuentemente por ITU en los primeros meses de vida y posteriormente y en toda la infancia las niñas son las que predominan6 tal como se demuestra en esta casuística. Otro aspecto reiterado en la literatura es que el microorganismo que ocasiona más comúnmente ITU en niños es E. coli y otras enterobacterias.11,12 Este mismo espectro de microorganismo es el que se encuentra en este estudio.
Se ha demostrado ampliamente que la leucocituria es un relevante marcador de ITU en niños, aunque puede también presentarse en otras causas infecciosas de piuria estéril entre las que se mencionan, las infecciones de transmisión sexual (gonorrea y clamidia), herpes virus simplex, adenovirus, citomegalovirus, tuberculosis renal, infecciones fúngicas y parasitarias (Trichomonas vaginalis y Schistosoma haematobium), así como otras afecciones no infecciosas, entre las que se enumeran, la fiebre, nefritis y otros procesos inflamatorios,13,14 la mayor parte de los cuales no son propias de niños de tan temprana edad menor de 2 años.
La Academia Americana de Pediatría (APP), publicó en el 2011 recomendaciones en las Guías Prácticas para la ITU en niños de 2 meses a 2 años de edad, en la cual incorporan a los criterios para definir ITU, un resultado de la microscopía de orina que mostrara leucocituria,15 reafirmadas en el año 2016,16 lo cual destaca la importancia que se le da a la presencia de la respuesta inflamatoria del riñón a la infección. Ying-Wai Cheng17 demuestra en niños menores de 8 semanas de edad con ITU, que aun en estas edades se produce una respuesta con incremento de leucocitos en orina por la infección, lo cual ocurrió en 93 % de los pacientes; no obstante hay diferencias en la intensidad de la leucocituria y aunque con pocas diferencias, también según el microorganismo causal. Alam opina, basado en estudios realizados por su equipo de investigadores, que el grado de concentración de la orina debe ser considerado cuando se interpreta el significado del conteo de leucocitos en un examen de microscopía,18. Otros,19 corroboran que el mayor grado de leucocituria se asocia significativamente con la presencia de ITU, resultado que obtienen mediante la comparación de lactantes de menos de 3 meses de edad con esta infección y otros sin ITU, como un factor independiente, por análisis multivariado.
En metaanálisis10 en niños, los resultados de la microscopía en muestras frescas de orina no centrifugada para el diagnóstico de ITU, indican la presencia de leucocituria con una sensibilidad de 74 % (rango de 67-90 %) y especificidad de 86 % (rango 82-90 %). En una cohorte de 188 440 niños menores de 15 años con ITU,20 encuentran en un examen microscópico de orina positivo (>10 000 leucocitos/ml), que la sensibilidad para ITU es 87,7 % (IC95%: 77,2-94,5 %) y especificidad 76,6 % (IC95 %: 72,5-80,5 %). Tzimenatos21 en 289 lactantes febriles con ITU encuentra que el urianálisis positivo es altamente sensible (0,94, IC95 %: 0,91-0,97) y específico (0,91, IC95 %: 0,90-0,91) para el diagnóstico de esta infección.
Según otro autor22 la sensibilidad de la leucocituria varía según el punto de corte que se tome para considerar positividad en la microscopía de orina, el valor de la sensibilidad se incrementa al considerar un punto de corte desde más de 10 leucocitos/mm3 a más de 100 leucocitos/mm3 en orina centrifugada (algo similar a considerar más de 100 000 leucocitos/ml en orina no centrifugada). Es así que en el presente estudio también asumimos este elevado punto de corte en el grupo de niños sin positividad del urocultivo, pero con manifestaciones clínicas de infección, junto con la leucocituria significativa, puesto que, además, con una leucocituria tan considerable, es muy difícil asociarla a otras causas que pueden cursar con incremento de leucocitos en orina pero menos notable.
Otras infecciones bacterianas como la sepsis también pueden ser presumidas y calificadas así aun sin contar con un cultivo positivo, por los mismos motivos que se mencionan aquí (no se pudo recoger la muestra para cultivo, o que el cultivo pudo resultar contaminado y también que algunos pacientes son tratados con antibióticos antes de realizar el cultivo, lo cual impide el crecimiento bacteriano en los medios de cultivo), siempre y cuando haya manifestaciones clínicas y marcadores de laboratorio de infección.
Se ha aceptado en las unidades de terapia intensiva el término “diagnóstico de sepsis con cultivo negativo”, que se aplica a situaciones en las que un lactante tiene manifestaciones clínicas de sepsis compatibles con la causa bacteriana, pero en quienes no se pudo detectar un microorganismo en los cultivos de sangre o líquido cefalorraquídeo.23,24
En otra revisión a propósito de la definición de sepsis, en particular en neonatos, los autores expresan que aunque el hemocultivo se considera como la prueba de oro para la infección, la sepsis clínica con cultivo negativo, se considera una entidad real en todos los grupos de edad.25 En la meningitis bacteriana ocurre a veces de manera similar, no se puede disponer de un cultivo bacteriano positivo, pero igualmente se considera y se actúa como si fuera esta la causa si la enfermedad se presenta con manifestaciones clínicas propias de esta infección, junto con marcadores de laboratorio de infección bacteriana, especialmente del examen citoquímico del líquido cefalorraquídeo.26
Un equipo de investigadores reunió una casuística de niños con manifestaciones clínicas de meningitis bacteriana, unos comprobada por cultivo y otros no, los cuales tuvieron una alta tasa de letalidad y secuelas, lo que les llevó a sugerir en sus conclusiones que muchos niños con meningitis, sospechada inicialmente como bacteriana, pero sin comprobación por cultivo o antígeno, pudieron haber tenido en realidad esta causa,27 como quiera, la presunción de causa bacteriana motivó la atención médica de los casos como se establece para esta causa, aún sin la comprobación por cultivo o antígeno.
Comúnmente se presentan casos en la práctica médica con manifestaciones clínicas y leucocituria significativa sugerente de ITU y el resultado del urocultivo es negativo, contaminado, o por determinadas circunstancias no se pudo recoger la orina para examen microbiológico. Esto constituye una situación frecuente en los servicios de pediatría, a la vez que es una situación embarazosa. Hemos revisado la literatura y no existen muchas publicaciones al respecto si se tratan de ITU o no, o si se debe mantener la terapéutica antibiótica una vez que se hubiera indicado en la evaluación inicial por detectar leucocituria en el examen microscópico de la orina.
Un estudio de 264 niños con su primera ITU febril,28 compara pacientes entre los cuales los autores consideran el grupo de pacientes con pielonefritis (comprobada por gammagrafía renal con ácido dimercaptosuccínico) y cultivo de orina negativo y estos casos tuvieron similares resultados con otro grupo de niños, también con pielonefritis pero con cultivo de orina positivo, en cuanto a niveles de PCR, VSG y conteo global de leucocitos sanguíneos; por lo que de hecho demuestra que hubo casos con ITU febril sin tener urocultivo positivo.
Una de las publicaciones que aparece en la literatura internacional toma como sujetos de estudio a mujeres adultas,29 pero lo interesante es que los autores identifican en mujeres sintomáticas de infección urinaria baja, a quienes se les realizaron cultivos de orina y además determinación cuantitativa de reacción de cadena de polimerasa (cRCP) para E. coli en orina, que en 63/211 (29,9 %) de las pacientes con cRCP positiva tuvieron urocultivo negativo para este mismo microorganismo, por lo que los autores concluyen que algunas mujeres con manifestaciones clínicas de ITU baja típicas y un resultado de urocultivo negativo aún tienen una ITU. Los autores alegan como explicación a este hecho el punto de corte que establecen algunos investigadores para calificar la positividad del recuento cuantitativo bacteriano por la pauta habitual en el urocultivo (pero en su estudio tomaron un punto de corte bien bajo de 102 UFC/ml), el hecho de que algunos microorganismos no crecen adecuadamente en los medios estándar para el cultivo de orina (que no se aplica a sus resultados referente a la E. coli), y por último, ofrecen otra hipótesis basada en trabajos publicados,30,31 de que algunas cepas de E. coli tienen la capacidad de persistir en “biofilms” intracelulares y causan inflamación y síntomas, no se pueden, por tanto, identificar en cultivos bacterianos convencionales, pero sí pueden serlo por cRCP.
La contribución de este estudio está en el hecho de que todos los niños presentaron manifestaciones clínicas de infección, unos más característica de esta localización y otros no, casi todos febriles, pero de manera más relevante es que todos tenían un examen microscópico de orina con leucocituria positiva, o sea, otro elemento más predictivo de ITU, y que para el grupo de niños con urocultivo no positivo la leucocituria fue bien evidente, calificada como leucocituria significativa (más de 100 000 leucocitos/ml).
Este estudio tiene como limitación el carácter retrospectivo y la información necesaria depende muchas veces de lo escrito en las historias clínicas de los pacientes. También que se mantuvieron los criterios conservadores de un resultado de cultivo semicuantitativo de orina en muestras obtenidas limpias por chorro medio al acecho de más de 100 000 UFC/ml, en el grupo que tenía ITU comprobada con este cultivo positivo y no como propone actualmente la Academia Americana de Pediatría, que establece más de 50 000 UFC/ml, pero esto realmente no influye en los resultados del trabajo.
Estos resultados permiten llegar a la conclusión de que la presencia de una leucocituria significativa (más 100 000 leucocitos/ml) en niños con manifestaciones clínicas de infección, fundamentalmente con fiebre, y que no se puede contar con un resultado positivo del urocultivo, se debe proporcionar la atención médica establecida para un paciente con ITU, pues aunque no cumple con el criterio de oro de urocultivo positivo, la sospecha de esta infección tiene mucha fuerza por tener hallazgos clínicos, de laboratorio y de radioimagen que no difieren del paciente que puede calificarse con ITU comprobada por cultivo.














