Introducción
Las infecciones de piel y tejidos blandos (IPTB) se definen como aquellas que afectan la piel, el tejido celular subcutáneo, la fascia y el musculo.1
Las IPTB constituyen una de las causas principales de consulta a nivel mundial. El aumento en su presentación puede estar relacionado con el deterioro de la integridad de la piel, la falta de higiene, el hacinamiento, la humedad, las inmunodeficiencias, las comorbilidades y el uso indiscriminado de antibióticos,2) además, están entre las infecciones más frecuentes en la población pediátrica por la facilidad de diseminación y la frecuencia con que los niños presentan lesiones cutáneas.1,2
Por otra parte, la osteomielitis es un proceso inflamatorio del tejido óseo causado por una infección de etiología bacteriana o micótica y se considera una importante causa de morbilidad en niños. Puede resultar de la inoculación de un germen por un trauma penetrante o por diseminación desde un foco contiguo, pero la causa más frecuente en los niños es la infección del hueso secundaria a bacteriemia. La incidencia es aproximadamente de 8 × 100 000 niños.3
Tanto las IPTB como la osteomielitis tienen en común que son causadas fundamentalmente por S. aureus. En los últimos años se ha descrito a nivel mundial un aumento de la incidencia de IPTB producidas por S. aureus meticilin resistente adquirido en la comunidad (SAMR-C), especialmente en la población pediátrica, y con frecuencia, en pacientes sin factores de riesgo.4
En la osteomielitis se va haciendo más común la presencia de SAMR-C según publicaciones de varias partes del mundo, lo cual implica complejidad en la terapéutica y en el pronóstico.5
En Cuba, se ha informado acerca del aumento de estas infecciones. Trabajos nacionales han concluido que las IPTB y todas las producidas por SARM-C en general, pueden considerarse como emergentes.6
En el Hospital Pediátrico Paquito González se ha visto un aumento del registro de las IPTB, y de huesos y articulaciones, en los últimos años, particularmente en la unidad de cuidados intensivos pediátricos (UCIP), incluso, asociadas a una importante mortalidad si se compara con otras causas de muerte.
Ante la ausencia de investigaciones científicas que describan este problema, los autores de este trabajo revisaron la base de datos computadorizada del Departamento de Estadística y de Microbiología para analizar a través de datos estadísticos, este fenómeno, así como sus posibles causas y describir aspectos clínicos y epidemiológicos de las infecciones graves de tejidos blandos, huesos y articulaciones, que constituye el objetivo de esta investigación.
Métodos
Estudio descriptivo, de corte transversal y retrospectivo. Se realizó una búsqueda en la base de datos computadorizada del Departamento de Estadística del Hospital Pediátrico Paquito González, de todos los egresos de la UCIP con diagnóstico de celulitis o absceso de tejidos blandos, fascitis, miositis, osteomielitis, sepsis severa y shock séptico, desde el 1ro. de enero de 2009 al 31 de diciembre de 2019.
Se identificaron 90 casos de IPTB y del sistema osteomioarticular, y 181 de sepsis severa o shock séptico de cualquier causa. De estos últimos, se excluyeron 6 casos debido a que las historias clínicas no contenían de forma clara los datos necesarios.
Se estudiaron las siguientes variables: localización de la infección de piel y tejidos blandos, grupo de edad, año del egreso y sitio de origen de la sepsis.
La celulitis se recogió según las categorías registradas en la base de datos del Departamento de Estadística: celulitis de miembros, de la cabeza y del tronco. La edad se organizó en los siguientes grupos: menor de 1 año, de 1a 4 años, de 5 a 9 años de 10 a 14 años y de 15 a 18 años.
Los sitios de origen de la sepsis fueron estructurados como: pulmonar, huesos, articulaciones y partes blandas, enteral, resto de los sitios y sin sitio demostrado.
Los datos se introdujeron en el programa estadístico SPSS, versión 15.0, para su análisis. Se determinó la frecuencia de los tipos de infecciones, de los sitios de origen de la sepsis y de los grupos de edad.
La incidencia de las IPTB, huesos y articulaciones, se distribuyó por años y se determinó la tendencia lineal. Los resultados se expresaron en valores absolutos y relativos.
El trabajo fue aprobado por el Comité de Ética de la Investigación del hospital y por el Consejo Científico de las instituciones participantes. La investigación se realizó conforme a los principios de la ética médica, la Declaración de Helsinki y las normas éticas institucionales y nacionales vigentes.
Los datos se obtuvieron solo con carácter investigativo. Los resultados no hacen alusión específica a ningún paciente ni se usarán con otro fin que no sea el científico. No se usaron fotos ni ningún otro elemento de identidad personal.
Resultados
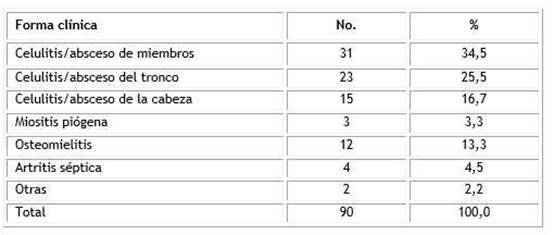
De acuerdo a los registros del Departamento de Estadística, 90 niños se admitieron en la UCIP desde enero de 2009 a diciembre de 2019 debido a IPTB, artritis séptica y osteomielitis. En relación con la celulitis o absceso, se destacó la localizada en los miembros por encima de otros sitios. La osteomielitis hematógena aguda y la artritis séptica se presentaron en 12 y 4 pacientes, respectivamente (Tabla 1).
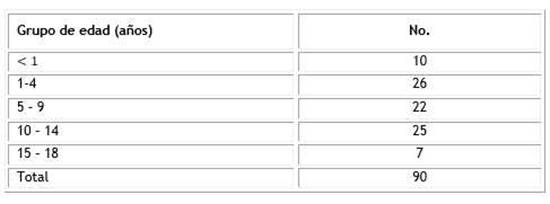
Se encontró una distribución casi homogénea en la incidencia por edades desde 1 año hasta 14 años. Solamente los lactantes y los de 15 a 18 años, se destacaron por tener menor número de pacientes (Tabla 2).
Tabla 2 Distribución de las infecciones de piel, tejidos blandos, huesos y articulaciones, según grupos de edad
El número de casos a través del tiempo mostró una franca tendencia al aumento de las IPTB. La osteomielitis y la artritis séptica tuvieron una distribución variable, sin tendencia evidente y la incidencia se limitó a un rango entre 0 y 3 casos por años (Fig. 1).
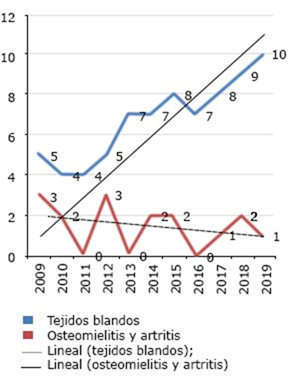
Fig. 1 Tendencia de las infecciones de piel, tejidos blandos, huesos y articulaciones, en los últimos 11 años.
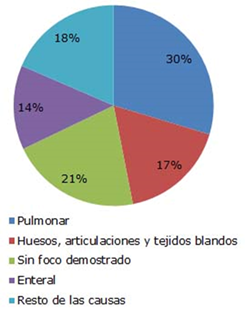
Se identificaron 181 historias clínicas con diagnóstico al egreso de sepsis grave o shock séptico en el período de estudio. De ellas, 175 resultaron útiles para este trabajo. Las IPTB, huesos y articulaciones constituyeron el segundo grupo más frecuente, detrás de las infecciones respiratorias, entre las afecciones que provocaron sepsis o shock séptico (Fig. 2).
Discusión
Los resultados demuestran que las infecciones graves de piel y sistema osteomioarticular no afectan mucho más a un grupo de edad que a otro. Puede pensarse que los niños mayores tendrían mayor riesgo al interactuar más con el medio ambiente y recibir heridas en la piel que constituirían puertas de entrada, sin embargo, los menores de 4 años fueron igualmente afectados.
Series pediátricas estadounidenses sobre bacteriemia estafilocócica han encontrado predominio de estas infecciones en los niños menores de 3 años.7) Resultados diferentes se han publicado en estudios latinoamericanos, cuyos autores observan infecciones invasivas por S. aureus, principalmente en escolares.8) En la revisión bibliográfica realizada por los autores, no se encontraron artículos de autores cubanos similares al presente, que se centren en infecciones graves de tejidos blandos, articulaciones y huesos en UCIP, condición que limitó la posibilidad de comparar nuestros resultados.
La tendencia al aumento de las infecciones estafilocócicas adquiridas en la comunidad y que requieren ingresos hospitalarios, ha motivado que los expertos consideren a estas infecciones como un problema emergente.9
Un estudio llevado a cabo en Argentina notificó un incremento de 12 veces en la tasa de incidencia entre 2004 y 2014. Dicho estudio también reveló el predominio de las IPTB (75 %) y de las infecciones osteoarticulares (8 %) sobre otras formsa clínicas.10) Muchos autores asocian este fenómeno a la elevada prevalencia de SAMR en la comunidad lo cual hace fallar el tratamiento de primera línea indicado inicialmente. Las infecciones estafilocócica por SAMR-C aumentan los costos y la estadía hospitalarios.11) La gravedad de las infecciones por S. aureus se ha asociado a muchos factores, algunos investigadores han sugerido que también SAMR-C se relaciona con enfermedad invasiva.12,13
Los registros de los últimos 11 años en el Hospital Pediátrico Paquito González dan cuenta de un elevado porcentaje de casos con sepsis o shock séptico asociados a un foco infeccioso primario ubicado en piel, tejidos blandos o sistema osteomioarticular, si se compara con estudios globales que han incluido a una gran cantidad de pacientes. Así, un estudio epidemiológico global que abarcó UCIP de países de varios continentes mostró que la piel solo representa 3,5 % entre los sitios primarios de infección que conllevaron a sepsis grave o shock séptico, y no recoge a huesos y articulaciones, como una categoría independiente.14
Si bien las cepas aisladas de S. aureus en el Hospital Pediátrico Paquito González tienen una alta resistencia a la cefoxitina (72,4 %), según registros actuales del Departamento de Microbiología, lo cual coincide con los resultados publicados por fuentes extranjeras y nacionalmente.15,16,17) En los últimos años se han dado a conocer investigaciones que no asocian la invasividad de S. aureus a esta alta resistencia a la cefoxitina, factor de virulencia, sino a la presencia de leucocidina de Panton-Valentine (LPV) que es una exotoxina producida por muchas cepas, que destruye los leucocitos y produce necrosis de los tejidos.
La LPV está codificada por los genes LukS/LukF, actúa en la membrana externa de los leucocitos polimorfonucleares, los monocitos y los macrófagos e induce la apertura de los canales de calcio; en consecuencia, produce la liberación de calcio y de mediadores inflamatorios, lo que deriva en apoptosis y necrosis. Las infecciones por S. aureus positivo para LPV producen infecciones de partes blandas rápidas, graves y sumamente mortales.18
En un estudio multicéntrico europeo, que incluyó a 13 hospitales de 7 países, SAMR originó menos de 10 % de las infecciones invasivas y no fue un factor específico de severidad. En cambio, la invasividad estuvo asociada a la presencia de LPV.19
Es probable, que el aumento de la incidencia de s. aureus portador del gen para LPV en Cuba, sea un factor que esté condicionado el número creciente de enfermedad estafilocócica grave que requiere cuidados intensivos. La incidencia de S. aureus LPV positivo varía en el mundo según estudios. En Europa se plantea desde 6,2 %,20) hasta 27,7 %.21) Es significativo que en Estados Unidos haya incrementado la incidencia de S. aureus LPV positivo, de 24 % en 2004 a 53 % en 2006 y a 54 % en 2008.22
La identificación genética de S. aureus portador del gen para LPV se realiza a través de la reacción en cadena de la polimerasa (PCR). Los autores de esta investigación no encontraron publicaciones acerca de la realización de este tipo de prueba en Cuba. Sobre la base de investigaciones recientes, la emergencia de cepas de S. aureus productoras de LPV podría constituir un factor de virulencia que explique la tendencia invasiva creciente de este patógeno en el hospital Paquito González de Cienfuegos.
Debido a las propias limitaciones de un trabajo con recogida de los datos de forma retrospectiva y a la escasez de recursos tecnológicos, no se pudieron explorar variables que permitieran ahondar más en esta hipótesis.
Se concluye que ha habido un aumento sostenido de las infecciones de piel y tejidos blandos que requieren ingreso en la unidad de cuidados intensivos del citado hospital en los últimos 11 años. Estas infecciones de conjunto con las infecciones de huesos y articulaciones, constituyen un problema creciente de salud puesto que provocan sepsis grave y shock séptico con una incidencia significativa.
Para abordar con profundidad este fenómeno, se recomienda realizar estudios más integrales, con mayor número de variables y determinaciones de laboratorio que actualmente no están disponibles.