Introducción
La vacuna antituberculosa bacilo Calmette-Guerin (BCG) es una vacuna viva, atenuada, que induce una respuesta inmune celular compleja que puede prevenir la tuberculosis (TB) meníngea y miliar.1,2,3,4,5
Aunque este es el principal efecto demostrado, estudios recientes plantean además una probable función de prevención de la infección tuberculosa en menores de 5 años5 y protección indirecta contra enfermedades infecciosas y la muerte en el primer año de vida.1
Existen múltiples vacunas BCG en el mundo, pero todas derivan de la misma cepa madre conservada en condiciones de laboratorio.4,6 Cuba, según datos del Programa Nacional de Inmunización, utiliza un producto liofilizado (BB-NCIPD Ltd, Sofía, Bulgaria) con poca reactogenicidad.
Tras la administración del BCG se desarrolla una pápula en el sitio vacunal, que crece hasta la semana 5, se ulcera y posteriormente deja una cicatriz permanente. Esta cicatriz puede tardar hasta 6 meses o más en desarrollarse e incluso no aparecer en 10-15 % de los casos, cuando es administrada al momento de nacer, lo cual no afecta su poder inmunizante. La linfadenitis no abscedada ni supurada, menor de 1 cm, es poco frecuente y no se considera un efecto adverso.3,4,7
Es una vacuna que se considera segura, con pocas reacciones adversas. Estas pueden ser:2,4,7
Locales (formación de úlcera, costra y supuración intermitente, abscesos) que son las más frecuentes.
Regionales (adenitis supurada axilar, supraclavicular, masa mediastinal).
A distancia cuando afecta un solo sitio (casi siempre osteítis de las extremidades).
Diseminadas cuando afecta varios sitios distantes.
Algunas publicaciones utilizan el término BCGitis para las complicaciones locales y regionales y BCGosis para las osteítis y las formas diseminadas.2,6) Estos términos se pueden prestar a confusión por lo que no los utilizaremos, pero deben ser del conocimiento médico.
Las reacciones adversas más frecuentes son las locales y después las adenitis, se asocian a: dosis, edad al momento de la vacunación, tipo de vacuna, técnica y raramente a inmunodeficiencia.3,4,8
En el caso de las formas diseminadas se plantea que existe un riesgo incrementado de circulación del bacilo vacunal en individuos no inmunocompetentes.9) La infección diseminada es temprana, se manifiesta con síntomas sistémicos como fiebre, pérdida de peso, al menos dos áreas de compromiso más allá del sitio de vacunación y la identificación de Mycobacterium bovis BCG ya sea por cultivo, reacción en cadena de la polimerasa (PCR) o histopatología.2,6,10,11,12) El estudio de las lesiones demuestra granulomas caseificados, pero pobremente formados, con gran cantidad de histiocitos.2,13
Su incidencia es muy baja, entre 0,1 a 4,3 casos por millón de vacunados;14,15 puede ser superior en individuos con virus de la Inmunodeficiencia Humana (VIH)16 y en poblaciones con alto grado de consanguinidad.15,17
En 50 % de los casos se identifican inmunodeficiencias primarias (IDP), pero los estudios inmunológicos de rutina pueden ser normales y existir errores innatos, con deficiencias en las respuestas inmunes mediadas por interferón Gamma (INFγ), importante para la eliminación de patógenos intracelulares. Se describen 17 genes que pueden afectarse, con heterogeneidad alélica y que conducen a 32 fenotipos diferentes. A esta deficiencia inmune se le ha denominado síndrome de susceptibilidad mendeliana a enfermedades por micobacterias o MSMD (del inglés Mendelian Susceptibility to Mycobacterial diseases),2,13,14,17,18,19,20 aunque en dependencia del grado de afectación del INFγ pueden aparecer otras infecciones por gérmenes poco virulentos.20,21
El tratamiento con drogas antituberculosas de 1ra. línea es poco efectivo; M bovis es naturalmente resistente a la pirazinamida19,22) y puede existir un alto porcentaje de resistencia parcial a isoniacida.22La diseminación del BCG es una reacción adversa severa, la evolución depende del trastorno inmunitario subyacente y tiene una alta letalidad.2,6,7,12,22) Esta afección no es fácilmente reconocida en sus inicios y si no hay una alta sospecha clínica, puede retardarse el diagnóstico y la posibilidad de un tratamiento temprano.23) Es por ello que el Centro de Referencia Nacional de tuberculosis infantil (CNTBI) que radica en el Hospital Pediátrico Centro Habana y funciona coordinadamente con las Comisiones de TB infantil de cada provincia, se ha motivado a revisar diferentes casos, con el objetivo de describir una serie de cinco casos con infección vacunal diseminada
Presentación de casos
Todos los datos que se presentan se obtuvieron de la historia clínica de los enfermos. Se realizaron estudios inmunológicos de rutina en el Instituto de Hematología e Inmunología de la Habana.
El CNTBI, creado en 1995, evaluó cinco casos (años 2006, 2008, 2010, 2011 y 2014), de diferentes provincias del país, que habían recibido tratamiento con drogas de 1ra. línea para TB, sin respuesta, en los cuales se confirma el diagnóstico de BCG diseminado por la clínica, el estudio histológico típico, la presencia de bacilos mediante coloración de Zielh-Nielsen en cuatro y cultivo de M bovis vacunal en dos (casos 3 y 5) (Tabla).
Tabla Datos de la serie de casos con BCG diseminado
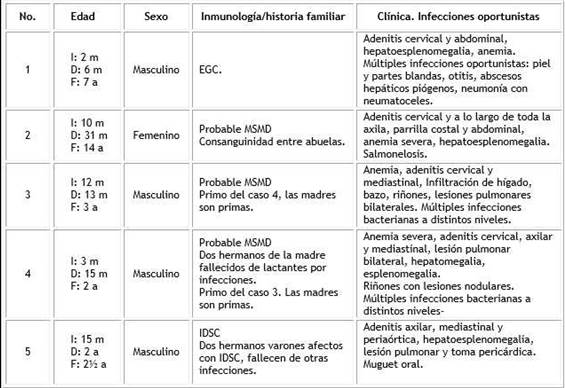
I: edad de Inicio; D: edad de diagnóstico; F: edad de fallecimiento; m: meses; a: años; ECG: enfermedad granulomatosa crónica; IDSC: inmunodeficiencia severa combinada; MSMD: síndrome de susceptibilidad mendeliana a infecciones por micobacterias.
En el caso 1 se consideró por inmunología un paciente característico de enfermedad granulomatosa crónica (EGC), por las múltiples infecciones y abscesos desde el nacimiento en la piel, pulmones, hígado e infección del sistema nervioso. La prueba de nitroazul de tetrazolio (NBT) fue dudosa, pero sabemos que tiene limitaciones importantes, con resultados falsos positivos y negativos. El diagnóstico es más específico, mediante la citometría de flujo y su prueba de 1,2,3-dihidrorodamina (DHR),11,24) pero no pudo ser realizada. Los estudios de inmunidad celular y humoral fueron normales. En este paciente no se pudo demostrar M bovis y los granulomas forman parte de la IDP sospechada (EGC). El criterio diagnóstico se basó en la histología con presencia de granulomas desorganizados, caseificados, predominio de histiocitos, no descritos en esta IDP24) y la respuesta terapéutica favorable con drogas de 2da. línea, posterior a un tratamiento inefectivo por 2 meses del esquema de 1ra. línea. También tuvo respuesta favorable al INFγ.
Todos los pacientes presentaban como síntomas generales un síndrome febril prolongado, con pobre ganancia de peso y retardo pondo estatural; además de adenopatías abscedadas y supurativas axilares y en diversos grupos regionales a distancia, así como hepatosplenomegalia. La anemia fue otro hallazgo importante en cuatro de ellos, que requirió transfusiones. El sitio del BCG se mantuvo húmedo, supurando desde los primeros meses en cuatro niños (Figs. 1, 2, 3, 4).
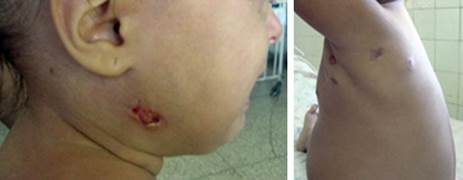
Fig. 1 Paciente 2, a la edad de 2 años, probable MSMD. Adenitis supuradas alrededor de toda la axila izquierda. Herida granulomatosa después de escisión y biopsia de adenopatía derecha. Distensión abdominal por hepatosplenomegalia. Palidez marcada.
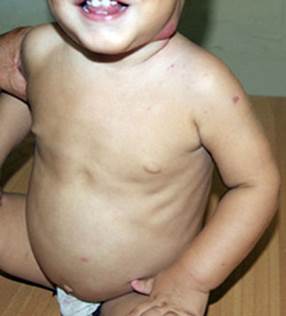
Fig. 2 Paciente 3, a la edad de 2 años, probable MSMD. Sitio vacunal ulcerado y húmedo, adenitis abscedada submaxilar izquierda, tiraje intercostal, distensión abdominal por hepatosplenomegalia.
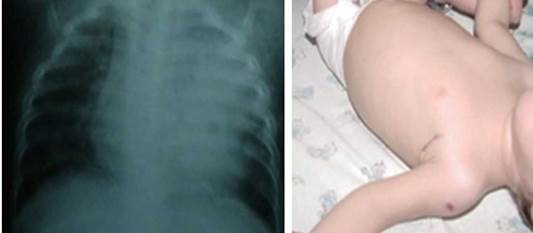
Fig. 3 Paciente 4, 16 meses, probable MSMD. Lesiones inflamatorias persistentes en LSI de aspecto heterogéneo con algunas cavitaciones. Sitio vacunal ulcerado y húmedo, retardo pondoestatural severo, hepatosplenomegalia.
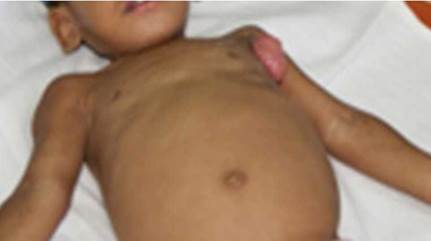
Fig. 4 Paciente 5, 2 y medio años. IDSC. Desnutrición, palidez marcada, distensión abdominal por hepatosplenomegalia, lesión granulomatosa húmeda en axila izquierda, tiraje intercostal.
Considerando los nacimientos vivos ocurridos en Cuba y la cobertura vacunal BCG de 98-99 %25 en el periodo 1996-2020, unos 25 años, la incidencia fue de 0,16 casos por millón de vacunados.
En la tabla se resumen sus características principales. Se observa un predominio del sexo masculino (80 %), con una edad de inicio del cuadro con un promedio de 8,4 meses (2-15 meses), que contrasta con un promedio de edad al diagnóstico de 17,8 meses (6-31 meses). En tres enfermos (casos 3, 4 y 5) la edad al fallecer era de 3 o menos años, con muy corto intervalo entre la edad de comienzo, el diagnóstico y el fallecimiento.
En todos los pacientes estudiados existió sospecha inicial de adenitis BCG y posteriormente de TB; la posibilidad de BCG diseminado la establece el CNTBI al ser consultado. El promedio de sitios con lesiones fue de cuatro, ningún niño presentó afectación neurológica, cutánea ni ósea atribuible al BCG diseminado. Todos presentaron infecciones oportunistas y se destacan en este sentido los casos 1, 3 y 4 con múltiples y frecuentes infecciones. Se describe consanguinidad en tres enfermos e historia familiar de otros enfermos fallecidos con diagnóstico o sospecha de IDP en otros tres. En el paciente 5 se confirmó una inmunodeficiencia severa combinada.
En los tres pacientes restantes se plantea probable MSMD, en los cuales no pudo realizarse estudios genéticos confirmatorios que demostraran la mutación presente. En ellos coincidió la consanguinidad y en dos se refirieron otros enfermos en la familia. Los dos pacientes varones relacionados en la familia (casos 3 y 4) tuvieron un cuadro muy severo, con múltiples procesos infecciosos y muerte temprana a pesar del tratamiento. Sin embargo, la única niña del grupo tuvo una supervivencia mayor, con solo brotes de reactivación del BCG diseminado y un único episodio de salmonelosis.
Todos recibieron al diagnóstico drogas de 2da. línea combinadas en ocasiones con rifampicina y etambutol. Se utilizaron amikacina, terizidone, proteinamida, azitromicina, quinolonas y clofazimina en diferentes esquemas, con buena tolerancia en general. El INF𝛾 se utilizó con buenos resultados, aunque sin sistematicidad en el caso1 y por poco tiempo en el caso 4. En los restantes pacientes no modificó el cuadro clínico.
Discusión
Los informes de incidencia de BCG diseminado varían en diferentes países, desde 1 en 50 mil vacunados con exclusión de pacientes VIH,2, entre 2 a 3,4 por millón de vacunados7 y 0,1 a 4,3 casos por millón de vacunados pero con tendencia a incrementarse.15) Cuando se administra la vacuna BCG a recién nacidos de madres VIH positivas el riesgo es muy elevado si hay trasmisión vertical, de 407 a 1300 por 100 mil casos.16
No podemos descartar la existencia de otros pacientes con BCG diseminado desde que se establece el CNTBI y posterior al 2014, pero es poco probable, dadas las características clínicas, la severidad que se describe en estos enfermos, además de la sospecha lógica de TB y mala respuesta al tratamiento, que condiciona su interconsulta con el CNTBI. Cuba cuenta con un único sistema de salud, totalmente accesible y gratuito,26 por lo que este tipo de casos generalmente tiene atención de salud.
La edad de inicio de la diseminación es generalmente muy temprana, sigue a la vacunación,6,7,12,13,22,27,28,29) aunque en un estudio iraní la media de edad de inicio fue 43 ± 27,36 meses.15 En algunos casos de EGC puede aparecer más tardíamente,28) de forma similar en pacientes con MSMD que pueden debutar incluso durante la adolescencia.2,19
La literatura revisada coincide con predominio del sexo masculino,12,28,30) lo que pudiera estar en relación con que la inmunodeficiencia de base tiene con frecuencia un patrón de herencia ligado al sexo.(24, 29,31) También es relevante la herencia autosómica recesiva, sobre todo en poblaciones con alta frecuencia de matrimonios consanguíneos, como Irán15 y la India.19
Es muy importante la historia familiar de otros enfermos con BCG diseminado o IDP diagnosticada o sospechada por múltiples cuadros infecciosos o fallecimientos por esta causa en el primer año de la vida.6,10,17,19,22) Este antecedente no fue valorado en los casos 2, 3, 4 y 5 (Tabla) y hubiera contribuido a una sospecha diagnóstica más temprana e incluso a no recomendar la vacunación BCG temprana en un recién nacido con historia de IDP en la familia.6,15,32
Puede confirmarse una IDP en aproximadamente la mitad de los casos de BCG diseminado.17,20,28
Es la primera manifestación clínica hasta en el 60 % de casos de EGC;2) constituye una de las deficiencias inmunes más diagnosticadas en diferentes series de casos.12,17,27,28
En una cohorte de 349 pacientes con IDSC, de diferentes países y vacunados con BCG, se describe 51 % de infecciones asociadas al BCG, sobre todo en los vacunados al nacimiento.2
Se describen múltiples mutaciones en la MSMD,15,22,33 la más frecuente es la deficiencia autosómica recesiva del receptor β1 de la interleucina 12 (IL-12Rβ1). Mutaciones en IL-12Rβ1 y el receptor 1 de INFγ (INFγR1) abarcan el 8 0 % de los casos.6) Mientras más profunda es la deficiencia de INFγ, existe mayor predisposición a la infección por micobacterias poco virulentas,(3) aunque estas infecciones BCG, en algunos casos, pueden ser localizadas y no ser severas.2) En 55 pacientes con MSMD, procedentes de 10 centros en la India, la diseminación del BCG fue la manifestación más habitual (82 %).19 Otras IDP son menos frecuentes.10,12,14,30,32
Como infecciones oportunistas se describen la salmonelosis,14,15,19) candidiasis15,19 y micobacterias no TB, como más frecuentes.14,32,33
El tratamiento con INFγ puede ser útil en niños con EGC28 y en algunos casos con MSMD donde no hay afectación del receptor.19 La respuesta al tratamiento con drogas de 2da. línea es muy variable, con casos que mantienen años sin recidivas y otros que fallecen tempranamente, muy relacionado con la mutación subyacente.2,7,19
En el síndrome de inmunodeficiencia adquirida el riesgo de diseminación es muy alto, cuando se vacunan a los hijos de mujeres con VIH, por lo que se recomienda por la Organización Mundial de la Salud (OMS), la vacunación selectiva, si se define la no trasmisión.16 Las últimas recomendaciones de la OMS, 2018, con relación al VIH plantean que los individuos con una condición estable y que esté tomando antiretrovirales, pueden recibir la vacuna.34
El presente trabajo tiene la limitación de no disponer de todos los recursos de laboratorio para el diagnóstico y el consejo genético a las familias.
Se concluye que aunque la vacuna BCG raramente presenta diseminación del bacilo vacunal, debe sospecharse esta entidad en niños pequeños, con las características severas y sistémicas que se describen, con manifestaciones sugestivas de tuberculosis que no responden al tratamiento antituberculoso de 1ra. línea.
Se recomienda que en madres embarazadas con consanguinidad familiar o familiares cercanos con probable IDP, se considere preferible el no vacunar con BCG al recién nacido hasta tanto se defina la inmunocompetencia del niño.















