My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de Salud Animal
On-line version ISSN 2224-4700
Rev Salud Anim. vol.38 no.1 La Habana Jan.-Apr. 2016
COMUNICACIÓN CORTA
Implementación de un Sistema de Gestión de la Calidad en la Unidad de Diagnóstico de Virología Animal
Introduction of a quality management system into the Unit of Animal Virology Diagnosis (UDVA)
Yalainne Obret, Armando Vega, Carmen Laura Perera, Arsenio Betancourt
Centro Nacional de Sanidad Agropecuaria (CENSA), Apartado 10, San José de las Lajas, CP 32 700, Mayabeque, Cuba. Correo electrónico: yalainne@censa.edu.cu.
RESUMEN
La Organización Mundial de Salud Animal (OIE) recomienda a los laboratorios de diagnóstico realizar sus ensayos en correspondencia con un Sistema de Gestión de la Calidad (SGC). La Unidad de Diagnóstico de Virología Animal (UDVA) se propuso la planificación del SGC bajo los requisitos de la NC ISO/IEC 17025: 2006 y se incluyeron requisitos de Bioseguridad establecidos en la Resolución 180/2007 sobre Seguridad Biológica. Se estableció el sistema de documentación, como soporte del sistema de gestión, que tiene como documento principal el manual de la calidad, con 20 secciones que describen el cumplimiento de los requisitos de la norma de referencia. Para demostrar la competencia del laboratorio, se participó en 10 ensayos de aptitud internacionales para el diagnóstico de la peste porcina clásica (PPC) con resultados satisfactorios. La implementación del sistema de gestión de la calidad propició el reconocimiento como candidato a laboratorio de referencia de la OIE para el diagnóstico de la PPC en América Latina y el Caribe y la designación del laboratorio para organizar ensayos de aptitud para la detección de esta enfermedad.
Palabras clave: Sistema de Gestión de la Calidad, laboratorio de referencia.
ABSTRACT
The Animal Health Organization (OIE) recommends diagnosis laboratories to develop their assays in correspondence with a quality management system (QMS). The Animal Virology Laboratory at the National Center for Animal and Plant Health proposed the planning of a QMS under the requirements of the NC ISO/IEC 17025:2006, and the biosecurity requirements established in the 180/2007 Resolution on Biological Safety were included. The documentation system as support of a QMS was established, which as main document had the quality manual with 20 sections describing the execution of the requirements included in the standards of reference. The laboratory competence was demonstrated by its participation in 10 assays of international proficiency for testing Classical swine fever (CSFV) with satisfactory results. The introduction of a system of quality management propitiated the laboratory recognition as a candidate to the OIE Reference Laboratory for CSFV diagnosis in Latin America and the Caribbean and its designation to organize proficiency testing to detect this disease.
Key words: Quality Management System, reference laboratory.
La calidad de los resultados analíticos se asegura desde la toma de la muestra y continúa con el traslado, la determinación analítica, el control de la calidad y el informe de los resultados. En la actualidad, todas estas actividades se gestionan como sistema. Con el objetivo de brindar servicios científico-técnicos de excelencia, la Unidad de Diagnóstico de Virología Animal, que pertenece al Centro Nacional de Sanidad Agropecuaria (CENSA), implementó un Sistema de Gestión de la Calidad para demostrar la competencia técnica del laboratorio y la validez de sus resultados (1).
La base para la organización del SGC tuvo como referencia la NC ISO/IEC 17025: 2006, se incorporaron requisitos de Buenas Prácticas de Laboratorio (BPL) descritos por la Regulación 37: 2012 del CECMED que enriquecieron el sistema, requisitos de la NC ISO 9001: 2008 aplicados en áreas externas a la UDVA (1) y requisitos de bioseguridad exigidos por la Resolución 180/2007. Además, se incluyó la participación en ensayos de aptitud como una forma del laboratorio de demostrar su competencia en la detección de la peste porcina clásica (PPC) que es considerada una enfermedad de declaración obligatoria por la Organización Mundial de Sanidad Animal (OIE) (4).
Para llevar a cabo la implementación del sistema de gestión de la calidad, la dirección de la UDVA designó al responsable de la calidad, el cual estuvo asesorado por el departamento de gestión de la calidad del centro (1). La primera acción llevada a cabo consistió en la modificación de diferentes procedimientos normalizados de operaciones (PNO) y registros de los procedimientos normalizados de operaciones (RPNO) de los métodos analíticos, la limpieza de locales, los instructivos de equipos, el control de reactivos, fregado-esterilización de materiales y soluciones de trabajo, metrología y bioseguridad.
Se modificó el reglamento del laboratorio y se confeccionaron los registros de deposición de desechos y de limpieza de refrigeradores y congeladores. Asimismo, se modificaron las instalaciones para que cumplieran con lo exigido por el Centro de Seguridad Biológica (5). El cumplimiento de los requisitos de bioseguridad incorporados a los métodos analíticos y procedimientos de gestión del sistema permitió la renovación exitosa de la licencia para el manejo de agentes biológicos, que emite el Centro Nacional de Seguridad Biológica para la explotación de las instalaciones (6).
Se confeccionaron nuevos procedimientos técnicos, entre los que se pueden citar los relacionados con la creación de bancos de líneas celulares y control interno de la calidad; también se elaboraron documentos de gestión, como el tratamiento de trabajos no conformes y la revisión por la dirección. Del mismo modo, se rediseñó la documentación relacionada con la entrada de muestras y la elaboración del informe de diagnóstico virológico para garantizar la trazabilidad en los trabajos de servicio.
Se incorporaron los documentos generados en áreas externas a la UDVA, entre los que se destacan los procedimientos para la elaboración de contratos con los clientes, el control de documentos, las compras y suministros, las auditorías internas, las acciones correctivas y preventivas, el fregado y la esterilización de los materiales, la limpieza de gabinetes de seguridad biológica, los registros de funciones, las responsabilidades y la capacitación del personal.
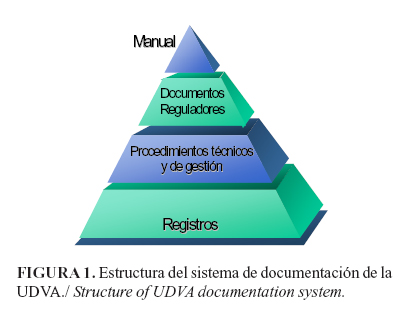
Se elaboró el Manual de la Calidad, el cual constituyó el documento que describe el SGC; este tiene 22 capítulos que cumplen con los requisitos exigidos por la NC ISO/IEC 17025: 2006. De esta manera quedó estructurada la documentación del sistema (Figura 1).
La UDVA ha participado en 10 ensayos de aptitud organizados por el laboratorio de Referencia de la OIE para la detección de la PPC; es el único laboratorio participante de América Latina, junto a otros 27 laboratorios de referencia de la Unión Europea que mantienen un alto nivel de desarrollo (7).
En los ensayos de aptitud realizados en el periodo 2005-2014 se lograron resultados coincidentes, en su mayoría, con los del laboratorio de referencia (7, 8).
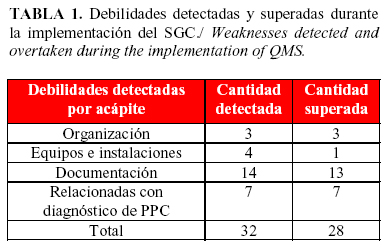
El papel de la auditoria en el SGC se evidenció a partir de la realizada por el laboratorio de referencia de la OIE en el marco de un proyecto de hermanamiento para el diagnóstico de la PPC. Como resultado se encontraron debilidades, lo que indujo al diseño e implementación del SGC (Tabla 1).
La segunda auditoría externa de seguimiento realizada por el laboratorio de referencia de la OIE, después de un año de funcionamiento del SGC, comprobó la ejecución efectiva de las acciones correctivas implementadas. De las mismas, solo quedan por resolver aquellas que requieren grandes inversiones, nos referimos a las relacionadas con mantenimiento de las instalaciones y la adquisición de algunos equipos de reserva en caso de roturas de los que se encuentran en uso, sin necesidad de solicitar servicios fuera de la UDVA.
Se controló la aplicación del sistema con la realización de auditorías internas y se realizó una revisión anual por la dirección que propuso un plan de mejora para el siguiente periodo (1).
La implementación del SGC propició la obtención de la categoría candidato a Laboratorio de Referencia de la OIE para el diagnóstico de la PPC en América Latina y el Caribe. Bajo esta condición la OIE designó al laboratorio para llevar a cabo la organización de ensayos de aptitud para el diagnóstico de la PPC, según la norma NC ISO/IEC 17043:2011. Los reconocimientos por la OIE elevaron el prestigio internacional de la unidad de diagnóstico viral, lo que constituye un reto a la mejora continua.
REFERENCIAS
1. NC ISO/IEC 17025: 2006 Requisitos generales para la competencia de los laboratorios de calibración y ensayo.
2. CECMED Regulación 37: 2012. Buenas Prácticas de Laboratorio para el Control de Medicamentos.
3. NC ISO 9001: 2008. Sistemas de Gestión de la Calidad. Requisitos.
4. Paton DJ, Greiser-Wilke I. Classical swine fever- an update. Res Vet Sci. 2003;75:69-178.
5. CITMA. Resolución 103. (2002). Reglamento para el establecimiento de los requisitos y procedimientos de seguridad biológica en las instalaciones en las que se hace uso de agentes biológicos y sus productos, organismos y fragmentos de estos con información genética.
6. CITMA. Resolución 180 (2002). Reglamento para el otorgamiento de la autorización de seguridad biológica, 2007.
7. Institute for virology. Department of infectious diseases, CSF ILCT (Clasical swine fever, inter-laboratory comparison tests). Report on results of interlaboratory comparison test for classical swine fever by national reference laboratories of eu member states. Hannover, Germany. 2014. Disponible en: http://www.tiho-hannover.de.
8. CSF ILCT. Institute for Virology. Department of infectious diseases, Report on results of interlaboratory comparison test for classical swine fever by national reference laboratories of eu member states. Hannover, Germany. 2013. Disponible en: http://www.tiho-hannover.de.
Recibido: 26-6-2015.
Aceptado: 2-2-2016.