My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Cultivos Tropicales
Print version ISSN 0258-5936
cultrop vol.33 no.4 La Habana Oct.-Dec. 2012
Caracterización fenotípica de aislados de rizobios procedentes de la leguminosa forrajera Canavalia ensiformis
Phenotypical characterization of rhizobia isolates from forage legume Canavalia ensiformis
Ionel Hernández Forte,I Dra.C. María C. Nápoles García,II Pedro R. Rosales Jenqui,III M.Sc. Guianeya Pérez Hernández,IV Roberto Baños Gordillo,V Juan F. Ramírez PedrosoVI
IReserva Científica del departamento de Fisiología y Bioquímica Vegetal, Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, Mayabeque, CP 32 700.
IIInvestigador Titular del departamento de Fisiología y Bioquímica Vegetal, Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, Mayabeque, CP 32 700.
IIIEspecialista del departamento de Fisiología y Bioquímica Vegetal, Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, Mayabeque, CP 32 700.
IVAspirante a Investigador del departamento de Investigaciones, Instituto de Investigaciones de Pastos y Forrajes, avenida Independencia, s/n, km 8½, Boyeros, Ciudad de La Habana
VEspecialista del departamento de Extensionismo, Instituto de Investigaciones de Pastos y Forrajes, avenida Independencia, s/n, km 8½, Boyeros, Ciudad de La Habana.
VI Investigador Auxiliar, Estación Experimental de Pastos y Forrajes de Cascajal, Villa Clara, Cuba.
RESUMEN
El objetivo del presente trabajo fue caracterizar fenotípicamente aislados de rizobios procedentes de la leguminosa forrajera Canavalia ensiformis. Se caracterizaron doce aislados, cinco posibles miembros del género Rhizobium/Sinorhizobium, siete posibles integrantes del género Bradyrhizobium y dos cepas comerciales, BR 2001 y BR 2003a. Para la caracterización fenotípica de los aislados bacterianos se estudió su capacidad de utilizar seis fuentes de carbono, la tolerancia a condiciones de acidez y a diferentes niveles de cloruro de sodio (NaCl), la resistencia a seis antibióticos así como su crecimiento en tres temperaturas de incubación. Se determinó además la capacidad de estos aislados de producir polihidroxibutiratos (PHB). Todos los aislados estudiados utilizaron la lactosa, glucosa y manitol como fuentes de carbono. Uno de los aislados de rápido crecimiento resultó el más tolerante a pH 4.5. Los aislados posibles miembros del género Rhizobium/Sinorhizobium toleraron una mayor concentración de NaCl que los posibles integrantes del género Bradyrhizobium. Tres de los aislados de rápido crecimiento fueron resistentes a los seis antibióticos utilizados. Cuando los aislados fueron incubados a 370C todos, con excepción del el aislado CP3 y la cepa comercial BR 2001, presentaron un crecimiento similar al control. El aislado CP10, de lento crecimiento, tuvo la capacidad de producir las mayores concentraciones de PHB (0.023 g.L-1).
Palabras clave: Rhizobium, Bradyrhizobium, acidez, salinidad.
ABSTRACT
The objective of this work was to characterize phenotypically rhizobia isolates from forage legume Canavalia ensiformis. Twelve isolates (five possible members of the Rhizobium genus, seven possible members of Bradyrhizobium genus) and two commercial strains, BR 2001 and BR 2003a were characterized. For the phenotypic characterization of the bacterial isolates, their capacity to use six carbohydrates as carbon source, their tolerance to acid condition and different levels of NaCl, and the resistence to six antibiotic, were studied; as well as their growing in three incubation temperatures. In addition, the capacity of these isolates to produce polyhidroxibutirates (PHB) was determinated. All rhizobia isolates used lactose, glucose and mannitol as carbon source. One rapid growing isolate was the most tolerant to pH 4.5. The isolates possible members of the Rhizobium/Sinorhizobium genus were more tolerant to NaCl than the isolates possible members of Bradyrhizobium genus. Three of the rapid growing isolates were resistent to six antibiotics. When the isolates were incubated at 370C, all of them except the CP3 isolate and one commercial strain, BR 2001, grown similar to control. The CP10 slow growing isolate had the capacity to produce the biggest PHB concentration (0.023 g.L-1).
Key words: Rhizobium, Bradyrhizobium, acidity, salinity.
INTRODUCCIÓN
Canavalia ensiformis (canavalia) es una planta rústica de altos rendimientos de granos y forraje, capaz de proveer alimentos en áreas marginales, donde el cultivo de otras leguminosas no tendría éxito (1, 2). En Cuba, la canavalia es ampliamente utilizada como abono verde pues aporta más de 150 kg N.ha-1 y hasta 5 t.ha-1 de masa seca. Esta leguminosa, además, permite elevar sosteniblemente los rendimientos de cultivos como el maíz, con una sustitución parcial o total de fertilizantes (3, 4).
Canavalia se cultiva en áreas ganaderas cuyos suelos se caracterizan por su baja fertilidad y se encuentran afectados por diferentes factores biológicos, físicos y químicos (5, 6). Estos factores afectan el proceso de fijación del nitrógeno, evento que se produce como consecuencia de la relación simbiótica que se establece entre las leguminosas y los rizobios del suelo (7). Por tal motivo se afecta también el establecimiento de las leguminosas en estos suelos, razón por la cual la mayoría de las praderas naturales en Cuba presentan una baja calidad nutrimental, predominando las gramíneas en comparación con las leguminosas1.
La caracterización fenotípica de rizobios adaptados a condiciones estresantes en los suelos constituye una de las primeras etapas para la obtención de un inoculante efectivo, que permita un mejor establecimiento de las leguminosas y con ello incrementar la producción de alimentos y reducir el empleo de fertilizantes nitrogenados. A pesar de la amplia utilización de técnicas de biología molecular en la caracterización de estas bacterias, se mantienen muchos de los análisis fenotípicos tradicionales pues estos evalúan las funciones fisiológicas y ecológicas de la célula favoreciendo su ubicación taxonómica2. Basado en lo anterior, el objetivo del presente trabajo fue: caracterizar fenotípicamente aislados de rizobios procedentes de la leguminosa forrajera Canavalia ensiformis.
MATERIALES Y MÉTODOS
Material microbiano
El estudio se realizó con 12 aislados de rizobios provenientes de nódulos de la leguminosa forrajera Canavalia ensiformis (canavalia), pertenecientes a la colección de cepas de rizobios del Laboratorio de Microbiología del Instituto Nacional de Ciencias Agrícolas (INCA). Además se utilizaron dos cepas comerciales, la BR 2001 y la BR 2003a, las que proceden de una de las empresas brasileñas EMBRAPA.
En estudios anteriores se determinó la posible distribución taxonómica de estos aislados de rizobios mediante el estudio de sus características morfo-culturales y fisiológicas (Tabla I) (8).

Estudio de las características fisiológicas
Se prepararon cultivos de los aislados en erlenmeyers de 100 mL de volumen, conteniendo 20 mL de medio líquido Manitol Extracto de Levadura (YEM, por sus siglas en inglés) (9), los cuales fueron inoculados con una asada cada uno de los aislados de rizobios previamente crecidos en el mismo medio sólido.
Los cultivos líquidos fueron incubados durante 24 horas (para los posibles miembros del género Rhizobium/Sinorhizobium) y 72 horas (para los posibles miembros del género Bradyrhizobium) a 280C y en condiciones de agitación a 150 rpm. Posteriormente se inocularon alícuotas de 10 µL de los cultivos obtenidos sobre placas Petri con medio sólido en las siguientes condiciones experimentales:
1. Asimilación de azúcares. Se utilizó para ello medio sólido Bergensen (10) a pH 6.8 con la adición de rojo congo. Este medio contenía individualmente las siguientes fuentes de carbono a una concentración de 10 g.L-1: sacarosa, glucosa, ramnosa, lactosa, galactosa y manitol. Se incubaron a 280C durante 10 días.
2. Tolerancia a condiciones de acidez (ensayo cuantitativo). El ensayo cuantitativo de tolerancia a la acidez se realizó con el objetivo de determinar la tolerancia y el crecimiento solo de los aislados posibles miembros del género Rhizobium, Can2, Can3, Can4, Can5, Can 6 y la cepa comercial BR 2003a la cual forma parte también de este género bacteriano.
Se emplearon placas con medio YEM sólido a pH 4.5, siguiendo una metodología en la cual se clasifican a los rizobios en tolerantes a esta condición de acidez si tienen la capacidad de cubrir con su crecimiento desde la tercera hasta la cuarta zona en la placa Petri (11). Como control se cultivaron estos aislados en el mismo medio a pH 6.8. Las placas se incubaron a 280C durante 10 días. Se determinó además el diámetro de las colonias de cada uno de los aislados en ambas condiciones de pH, a las 48 horas de incubación.
3. Tolerancia a salinidad. Para evaluar la tolerancia de los aislados bacterianos a la salinidad, se utilizaron placas con medio YEM sólido a pH 6.8 con rojo congo y se adicionaron diferentes concentraciones de cloruro de sodio (NaCl): 0, 0.5, 1.0, 1.5, 2.0, 2.5 y 3.0 %. Como control del experimento se utilizó el medio YEM con su correspondiente concentración de NaCl (0.01 %) (9). Todas las placas se incubaron a 280C durante 10 días.
4. Resistencia a antibióticos. En medio YEM sólido con rojo congo y pH 6.8 se adicionaron los antibióticos en la concentración: Cloramfenicol (20 µg.mL-1), Ampicilina (50 µg.mL-1), Tetraciclina (12.5 µg.mL-1), Ácido nalidíxico (20 mg.mL-1), Kanamicina (50 mg.mL-1) y Estreptomicina (50 mg.mL-1). Las soluciones stock de estos antibióticos fueron preparadas según la Guía de Protocolos y Purificación (12). Como control del experimento fue utilizado el mismo medio sin antibióticos. Las placas se incubaron a 280C durante 10 días.
5. Efecto de diferentes temperaturas de incubación. Los diferentes aislados fueron cultivados en placas con medio YEM sólido y rojo congo a pH 6.8. Las placas se incubaron a 4, 28 y 370C durante 10 días. La temperatura de 280C fue utilizada como control del experimento.
6. Producción de polihidroxibutiratos (PHB). La determinación de PHB se realizó según la metodología descrita por Finkelstein (13). La concentración de PHB (g.L-1) se calculó según una curva patrón de PHB puro mediante la expresión matemática: y= 0,02x, r2= 0,89.
Diseño y análisis estadístico
Los resultados del ensayo cuantitativo de la tolerancia a la acidez y de la producción de PHB por los aislados de rizobios, fueron analizados mediante el test de comparación de medias de Tukey para (a£0.05) y graficados con el programa SigmaPlot 2001. En cada caso se realizaron tres réplicas por tratamiento.
RESULTADOS Y DISCUSIÓN
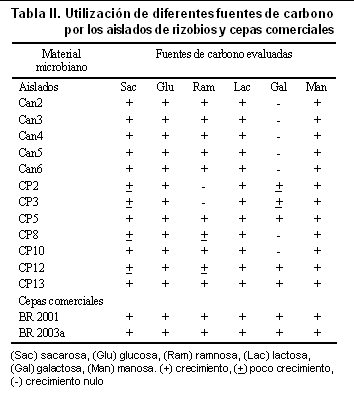
Evaluación de la utilización de diferentes fuentes de carbono
De las fuentes de carbono evaluadas, la glucosa, la lactosa y el manitol permitieron el crecimiento de todos los aislados de rizobios estudiados (Tabla II). El manitol es utilizado comúnmente en los inoculantes comerciales como fuente de carbono para el crecimiento de estos microorganismos. El hecho de que todos los aislados hayan crecido en presencia de este compuesto reafirma la utilidad que se le ha conferido como componente esencial de estos medios de cultivo.
Los aislados CP5, CP12 y CP13 así como las cepas comerciales, tuvieron la capacidad de crecer en todas las fuentes de carbono evaluadas, lo que evidencia la presencia de una gran variedad de mecanismos enzimáticos en estas bacterias que les permiten degradar diversos compuestos.
Resultados similares fueron obtenidos por otros autores cuando realizaron una caracterización de bacterias provenientes de nódulos de la leguminosa Indigofera tinctoria (14).
Para los rizobios, tener la capacidad de utilizar una gran diversidad de azúcares como fuente de carbono, constituye una ventaja adaptativa que les permite competir con otros microorganismos en la rizosfera de las leguminosas.
La galactosa resultó ser el carbohidrato menos utilizado por los aislados de rizobios. Este resultado discrepa con los obtenidos por varios autores cuando trabajaron aislados de rizobios provenientes de diversas variedades de la leguminosa Indigofera. En estos estudios los autores observaron que el 100 % de los aislados bacterianos, tuvieron la capacidad de crecer en medio YEM utilizando la galactosa como fuente de carbono y formaron colonias cuyo diámetro varió de 5,3 a 10,3 mm a las 72 h de incubación a 300C (15).
Los aislados Can2, Can3, Can4, Can5 y Can6, posibles integrantes del género Rhizobium/Sinorhizobium, tuvieron la capacidad de crecer en sacarosa, coincidiendo con lo planteado en la literatura (16), donde se hace referencia a esta fuente de carbono como uno de los sustratos de preferencia por los rizobios de crecimiento rápido.
Aunque se plantea que los rizobios de lento crecimiento presentan una mayor afinidad por las pentosas como la ribosa, xilosa y L-arabinosa (15), los aislados que constituyen posibles miembros del género Bradyrhizobium crecieron en los disacáridos sacarosa y lactosa, lo cual podría deberse en el caso de la sacarosa, al reconocimiento por parte de estos rizobios del residuo de fructofuranosa presente en la estructura disacarídica de este azúcar.
Conocer a profundidad las diferentes fuentes de carbono que utilizan los rizobios no solo permite su conservación en condiciones de laboratorio, sino también utilizar sus potencialidades en la elaboración de inoculantes.
Determinación de la tolerancia a la acidez
Durante los 10 días de incubación todos los aislados crecieron hasta la cuarta zona de crecimiento en las condiciones de pH 4.5, por lo que se consideran tolerantes a este nivel de acidez (10). Resultados similares fueron obtenidos al estudiar determinados aislados de rizobios provenientes de suelos amazónicos (17). La estabilización del crecimiento ocurrió a los dos días de incubación para todos los aislados en ambos niveles de pH, excepto para la cepa comercial BR 2003a, que presentó un crecimiento más acelerado a pH 6.8, pues a las 24 h ya había alcanzado la cuarta zona de crecimiento.
Todos los aislados, con excepción de Can4, presentaron un comportamiento similar entre ellos en ambas condiciones de pH evaluadas. Se obtuvieron diferencias significativas en el diámetro de sus colonias, detectándose a pH 6.8 mayores valores de esta variable que a pH 4.5 (Figura 1). Esto evidencia que aunque estas bacterias se multiplican y crecen en condiciones de acidez en el medio, este factor ejerce un efecto negativo sobre el crecimiento, lo que ha sido ampliamente discutido en la literatura para el caso de los rizobios (18, 19).
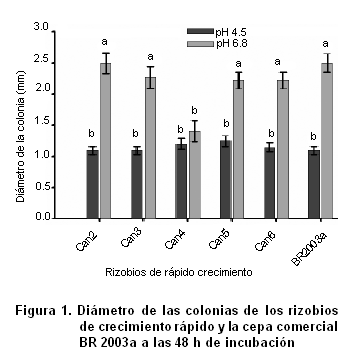
A pesar de las similitudes fisiológicas encontradas en los aislados estudiados, el aislado Can4 mostró un comportamiento diferenciado, sin diferencias significativas (a£0.05) entre ambas condiciones de acidez estudiadas. El resultado sugiere que este aislado es el más tolerante a pH 4.5, condición de acidez en el medio de cultivo que no afectó su crecimiento durante las 48 h de incubación (Figura 1).
Evaluación del crecimiento en diferentes niveles de NaCl
Los aislados posibles miembros del género Rhizobium toleraron una mayor concentración de NaCl en el medio de cultivo que los posibles integrantes del género Bradyrhizobium (Tabla III), resultados que coinciden con lo planteado por otros autores (20). De esta manera en estudios anteriores sobre la influencia de diferentes concentraciones de NaCl en el crecimiento de algunas cepas, se detectó que los rizobios de rápido crecimiento tienen la capacidad de acumular más rápidamente poliaminas (estabilizador osmótico) y utilizan con mayor rapidez nutrimentos necesarios para el crecimiento y la multiplicación en comparación con los rizobios de lento crecimiento (21). Sin embargo, se han identificado especies del género Sinorhizobium en las que se reprimían genes relacionados con el metabolismo central, factores de elongación, ADN ligasas, proteínas chaperonas y algunas de las proteínas que intervienen en el proceso de división celular; al incrementarse las concentraciones de NaCl en el medio de cultivo (22).
Además se ha planteado que una de las estrategias empleadas por los microorganismos sometidos a estrés salino para mantener su viabilidad en el medio es la llamada «estrategia del soluto compatible», que consiste en que los microorganismos mantienen el balance osmótico mediante pequeñas moléculas que son sintetizadas por ellos o son tomadas del medio donde se encuentran disponibles, con el objetivo de permitir el funcionamiento adecuado de las enzimas bacterianas. Algunos polioles como el glicerol y arabinitol, azúcares y sus derivados (sacarosa, trehalosa, glucosil-glicerol), aminoácidos y derivados de aminas cuaternarias como la glicina betaína, constituyen solo algunos ejemplos de estos variados grupos de compuestos (23).
Muchos estudios se han dirigido al aislamiento, identificación y caracterización de aislados de rizobios tolerantes a altas concentraciones de NaCl, con el objetivo de incrementar la materia orgánica de los suelos, disminuir la erosión de los mismos así como mejorar el establecimiento de las leguminosas en los suelos afectados por esta limitante (24, 25).
En este sentido al inocular cepas de rizobios tolerantes a la salinidad en la leguminosa forrajera Clitoria ternatea, cultivada en suelos salinos, notaron un aumento en la nodulación y en la masa seca de las plantas comparado con un testigo sin inocular (26).
Evaluación de la resistencia-sensibilidad a antibióticos
Los aislados Can2, Can3, Can4 y la cepa comercial BR 2001 resultaron resistentes a todos los antibióticos evaluados (Tabla IV). Para los rizobios la capacidad de crecer en presencia de una gran variedad de antibióticos, le brinda ciertas ventajas adaptativas que favorece la competencia por un sitio en la rizosfera y por tanto la colonización de las raíces de la leguminosa, impidiendo a su vez el establecimiento de microorganismos fitopatógenos.
Ninguno de los aislados posibles miembros del género Bradyrhizobium tuvo la capacidad de crecer en los medios suplementados con 50 mg.mL-1 de Kanamicina y 50 mg.mL-1 de Estreptomicina. Tanto la Kanamicina como la Estreptomicina son antibióticos que actúan sobre la subunidad 30 S del ribosoma bacteriano e impiden la síntesis proteica. En el caso particular de la Estreptomicina actúa durante la iniciación de este proceso impidiendo la realización de las etapas posteriores (27).
Todos los aislados de rizobios tuvieron la capacidad de crecer en el medio suplementado con 20 µg.mL-1 de Cloramfenicol. La tolerancia intrínseca a este antibiótico fue observada también en aislados de rizobios provenientes de fríjol caupí (Vigna unguiculata) (28). Sin embargo, se ha descrito la susceptibilidad a este antibiótico de aislados pertenecientes al género Rhizobium (29).
Los aislados de rizobios utilizados en este ensayo fueron obtenidos a partir de nódulos efectivos presentes en las raíces de las plantas de canavalia, por lo que durante el proceso simbiótico que tuvo lugar en estas plantas, la tolerancia de los rizobios a los posibles antibióticos presentes en el suelo, pudiera haber tenido un papel importante en la neutralización de efectos antagónicos por parte de otros microorganismos.
Crecimiento en diferentes temperaturas de incubación
Cuando los aislados de rizobios fueron incubados a 4oC, ninguno de ellos mostró crecimiento, mientras que cuando se sometieron a una temperatura de 37oC todos, excepto CP3 y la cepa comercial BR 2001, presentaron un crecimiento similar al control (28oC) (Tabla IV).
Similares resultados fueron discutidos en trabajos realizados anteriormente donde ninguno de los aislados de rizobios utilizados, tuvieron la capacidad de crecer a 5oC. En este sentido se ha planteado en la literatura que temperaturas inferiores a 5oC inhiben completamente el desarrollo de los rizobios procedentes de las zonas tropicales (30). Las bajas temperaturas provocan la inhibición del crecimiento por la pérdida de la fluidez de la membrana plasmática, afectándose el transporte de los nutrientes y la formación de los gradientes protónicos (27).
En trabajos previos se ha expuesto que el rango de temperatura de crecimiento para los rizobios aislados de las zonas tropicales se encuentra entre 25 y 30oC3. Este comportamiento pudiera estar vinculado al hecho de que este grupo de bacterias no tiene la capacidad de formar endosporas, las cuales constituyen estructuras de resistencia en estos microorganismos que le permiten resistir factores desfavorables (31). A pesar de lo planteado en la literatura, con excepción del aislado CP3 y la cepa comercial BR 2001, el resto de los aislados posibles miembros del género Bradyrhizobium, tuvieron la capacidad de crecer a 37oC. La variabilidad en el comportamiento de estos aislados de rizobios pudiera responder a un proceso de adaptación natural debido a factores estresantes externos, que como la temperatura en los suelos, actúan de forma continua en los rizobios (32).
Determinación cuantitativa de Polihidroxibutiratos (PHB)
Los aislados que presentaron una mayor concentración de este polímero fueron Can2, Can6, CP5 y CP10, este último resultó ser el aislado con la concentración más elevada de PHB, alcanzando un valor de 0.023 g.L-1. La mayoría de los aislados, incluyendo las cepas comerciales, resultaron tener concentraciones de este homopolímero por debajo de 0.005 g.L-1 (Figura 2).
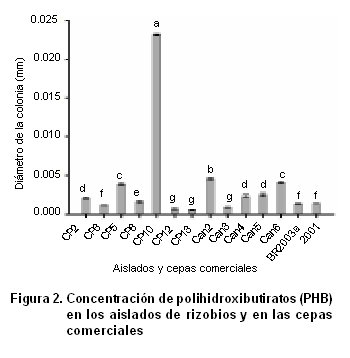
Según lo planteado en otros trabajos realizados en relación con la síntesis de PHB este proceso está asociado a desbalances nutrimentales en los rizobios con un exceso de la fuente de carbono, generalmente mono y disacáridos o ácidos grasos, y como respuesta a diversos factores de estrés ambiental (33).
Teniendo en cuenta que la determinación de PHB se llevó a cabo en condiciones de crecimiento controladas, las concentraciones obtenidas de este homopolímero solo dependieron de la capacidad genética para producirlo en cada uno de los aislados.
Las altas concentraciones de PHB encontradas en el aislado CP10, rizobio de lento crecimiento y posible miembro del género Bradyrhizobium, pudieran estar relacionadas con la presencia en el genoma bacteriano de varias copias de los genes involucrados en las vías de síntesis de PHB, lo cual ha sido informado en cepas pertenecientes a este género (34). De esta forma el aislado CP10 presenta mayores ventajas competitivas en el suelo que otros microorganismos, ya que cuenta con una reserva intracelular de carbono y energía, que puede ser movilizada para proteger a la célula ante factores ambientales dañinos como pueden ser las altas temperaturas, la radiación ultravioleta, el choque osmótico y la presencia de agentes oxidantes (35).
Desde el punto vista práctico, numerosos estudios se han encaminado a la utilización de rizobios para la obtención de PHB y el empleo de éste polímero en la fabricación de variadas piezas mediante procesos de moldeo por inyección y extrusión1. Por otro lado, algunos autores han realizado estudios de optimización de medios de cultivo y de las condiciones de fermentación en la obtención de PHB, con el objetivo de hacer más económico y eficiente el proceso productivo de este polímero. Tal es el caso de la optimización de las concentraciones de nutrimentos en un medio de cultivo a base de sacarosa, extracto de levadura y extracto de suelo, para aumentar el rendimiento PHB-biomasa utilizando la cepa Mesorhizobium plurifarium (4033) (36). En cuanto a las condiciones del proceso fermentativo se pudiera ejemplificar con un estudio realizado con cepas de Rhizobium tropici en el cual se optimizaron el pH inicial de la fermentación y las condiciones de agitación-aereación del proceso productivo (37).
CONCLUSIONES
Se evidencia una superioridad cualitativa de los aislados de rizobios con respecto a las cepas comerciales empleadas en cuanto a tres aspectos: 1) la tolerancia a las condiciones de acidez (pH 4.5) que mostró el aislado Can4, lo cual sugiere la presencia de mecanismos de adaptación que le permiten sobrevivir en tales condiciones; 2) la tolerancia a las condiciones de salinidad en el medio, donde los aislados posibles miembros del género Rhizobium toleraron una mayor concentración de NaCl que la cepa comercial BR 2001 perteneciente al género Bradyrhizobium; 3) la capacidad del aislado CP10 de producir mayores concentraciones de PHB en las condiciones de cultivo empleadas en este ensayo.
AGRADECIMIENTOS
El colectivo de autores quiere agradecer a la técnico de laboratorio Alicia Hernández y a la auxiliar Magalis Rivera, del departamento de Fisiología y Bioquímica Vegetal, Instituto Nacional de Ciencias Agrícolas (INCA), por haber contribuido decisivamente a la obtención de los resultados aquí expuestos.
REFERENCIAS
1. Martín, G. M.; Costa Rouws, J. R.; Urquiaga Rivera, S. /et al./. Rotación del abono verde Canavalia ensiformis con maíz y micorrizas arbusculares en un suelo nitisol ródico eútrico de Cuba. Agronomía Tropical, 2007, vol. 57, no. 4, p. 313-321.
2. Oropesa, K.; Pentón, G. y Martín, G. J. Efecto de la fertilización biológica y/o mineral en la producción de forraje de morera (Morus alba L.). Pastos y Forrajes, 2011, vol. 34, no. 3, p. 295-302.
3. Guerra, J. G. M.; Ndiaye, A.; de Assis, R. L. /et al./. Cultivos de cobertura como indicadores de procesos ecológicos. Revista de Agroecología, 2007, vol. 22, no. 20, p. 1-3.
4. Martín, G. M.; Rivera, R.; Arias, L. /et al./. Efecto de Canavalia ensiformis y micorrizas arbusculares en el cultivo del maíz. Revista Cubana de Ciencia Agrícola, 2009, vol. 43, no. 2, p. 7.
5. Sánchez, S.; Crespo, G.; Hernández, M. /et al./. Factores bióticos y abióticos que influyen en la descomposición de la hojarasca en pastizales. Pastos y Forrajes, 2008, vol. 31, no. 2, p. 1.
6. Crespo, G. Recuperación de la fertilidad del suelo en áreas ganaderas degradadas. Revista Cubana de Ciencia Agrícola, 2009, vol. 43, no. 4, p. 355.
7. Kantar, F.; Shivakumer, B. G.; Arrese-Igor, C. /et al./. Climate Change and Management of Cool Season Grain Legume Crops. Efficient Biological Nitrogen Fixation Under Warming Climates. Turkía. Springer, 2010, p. 283-306.
8. Hernández, I.; Pérez, G.; Nápoles, M. C. /et al./. Selección de aislados de rizobios provenientes de nódulos de la leguminosa forrajera Canavalia ensiformis. Cultivos Tropicales, 2012, vol. 33, no. 3, p. 27-33.
9. Vincent, J. M. A manual for the practical study of root-nodule bacteria. /J. M. Vincent. En: International Programme Handbook. No. 15. England : Oxford. Blackwele scientific publications, 1970.
10. Bergensen, F. J. The Growth of Rhizobia in Synthetic Media. Austral. J. Boil. Sci., 1961, vol. 14, p. 349-360.
11. de Oliveira, L. A. y de Magalhaes, H. P. Quantitative evaluation of acidity tolerance of root nodule bacteria. Rev. Microbiol., 1999, vol. 30, no. 3, p. 2-3.
12. Protocols and Purification Guide. Third edition. Promega Corporation, USA. N0 P1610. 1996.
13. Finkelstein, R. A.; Boesman-Finkelstein, M.; Sengupta, D. K. /et al./. Colonial opacity variations among the Choleragenic vibrios. Microbiology, 1997, vol. 143, p. 23-34.
14. Leelahawonge, C.; Nuntagij, A.; Teaumroong, N. /et al./. Characterization of root-nodule bacteria isolated from the medicinal legume Indigofera tinctoria. Ann Microbiol., 2010, vol. 60, p. 65-74.
15. Kumari, B. S.; Raghu Ram, M. y Mallaiah, K. V. Studies on exopolysaccharide and indole acetic acid production by Rhizobium strains from Indigofera. African Journal of Microbiology Research., 2009, vol. 3, no. 1, p. 10-14.
16. Graham, P. H.; Viteri, S. E.; Mackie, F.; Vargas, A. A. T. /et al./. A variation in acid soil tolerance among strains of Rhizobium phaseoli. Field Crops Res., 1982, vol. 5, p. 121-128.
17. Freitas Chagas, A.; de Oliveira, L. A. y de Oliveira, A. N. Tolerância à acidez e alumínio tóxico por isolados de rizóbios de solos no Amazonas, Brasil. Acta Amazonica, 2009, vol. 39, no. 2, p. 467-470.
18. Campanharo, M.; Lira Junior, M. A.; Clístenes, W. /et al./. Acidez do solo na fixação biológica de nitrogênio em feijoeiro comum. Revista Brasileira de Ciências Agrárias, 2010, vol. 5, no. 3, p. 285-290.
19. Aloisio Junior, F. CH.; de Oliveira, L. A. y Nascimento de Oliveira, A. Tolerância à acidez e alumínio tóxico por isolados de rizóbios de solos no Amazonas, Brasil. Revista Brasileira de Ciências Agrárias, 2009, vol. 39, no. 2, p. 467-470.
20. Ali, S. F.; Rawat, L. S.; Meghvansi, M. K. /et al./. Selection of stress-tolerant rhizobial isolates of wild legumes growing in dry regions of Rajasthan, India. Journal of Agricultural and Biological Science, 2009, vol. 4, p. 13-18.
21. Marquina, M. E.; González, N. E. y Castro, Y. Caracterización fenotípica y genotípica de doce rizobios aislados de diversas regiones geográficas de Venezuela. Rev. Biol. Trop., 2011, vol. 59, no. 3, p. 1017-1036.
22. Fujihara, S. y Yoneyama, T. Effects of pH and osmotic stress on cellular polyamine contents in the soybean rhizobia Rhizobium fredii P 220 and Bradyrhizobium japonicum A 1017. Appl. Environ. Microbiol., 1993, vol. 59, p. 1104-1109.
23. González-Hernández, J. C. y Peña, A. Estrategias de adaptación de microorganismos halófilos y Debaryomyces hansenii (Levadura halófila). Rev Latinoam Microbiol., 2002, vol. 44, no.3, p. 137-156.
24. Vriezen, J. A. C.; de Bruijn, F. J. y Nüsslein, K. Responses of Rhizobia to desiccation in relation to osmotic stress, oxygen, and temperature. Applied and Environmental Microbiology, 2007, vol. 73. no. 11, p. 3451-3459.
25. Nichols, P.; Malik, A.; Stockdale, M. /et al./. Salt tolerance and avoidance mechanisms at germination of annual pasture legumes: importance for adaptation to saline environments. Plant Soil, 2009, vol. 315, p. 241-255.
26. López, R.; Eichler-Löbermann, B.; Gómez, E. /et al./. Response of Leucaena leucocephala cv. Peru to Rhizobium inoculation under salt stress. Landbauforsch Völkenrode, 2007, vol. 4, no. 57, p. 307-311.
27. Madigan, M. T.; Martiniko, J. M. y Parker, J. Brock Biology of Microorganisms. United States of America: Be njamin Cumm ings, 2011. 1152. 032164963X.
28. Cuadrado, B.; Rubio, G. y Santos, W. Caracterización de cepas de Rhizobium y Bradyrhizobium (con habilidad de nodulación) seleccionados de los cultivos de fríjol caupi (Vigna unguiculata) como potenciales bioinóculos. Rev. Colomb. Cienc. Quím. Farm., 2009, vol. 38, no.1, p. 78-104.
29. Singh, B.; Kaur, R. y Singh, K. Characterization of Rhizobium strain isolated from the roots of Trigonella foenumgraecum (fenugreek). African Journal of Biotechnology, 2008, vol. 7, no. 20, p. 3671-3676.
30. Matos, G.; Ormeño, E. y Zúñiga, D. Diversidad de los rizobios que nodulan el cultivo de pallar (Phaseolus lunatus L.) en la Costa central del Perú. Ecología., 2001, vol. 1, no.1, p. 42-49.
31. Hamdi, Y. A. La fijación biológica del nitrógeno. Roma FAO, 1985, p. 160.
32. Bécquer, C. J.; Prévost, D. y Prieto, A. Caracterización fisiológica-bioquímica de cepas de rizobios, aislados en leguminosas forrajeras. Revista de Biología, 2000, vol. 14, no. 1, p. 4-6.
33. Nikel, P. I.; De Almeida, A.; Melillo, E. C. /et al./. New Recombinant Escherichia coli Strain Tailored for the Production of Poly (3-Hydroxybutyrate) from Agroindustrial By-Products. Appl. Environ. Microbiol., 2006, vol. 72, no. 6, p. 3949-3954.
34. Aneja, P.; Dai, M.; Lacorre, D. A. /et al./. Heterologous complementation of the exopolysaccharide syn-thesis and carbon utilization phenotypes of Sinorhizobium meliloti Rm1021polyhydroxyalkanoate synthesis mutants. FEMS Microbiol. Lett., 2004, vol. 239, no. 1, p. 277-283.
35. Kadouri, D.; Jurkevitch, E. y Okon, Y. Involvement of their serve material poly-b-hydroxybutyratein Azospirillum brasilense stress endurance and root colonization. Appl. Environ. Microbiol., 2003, vol. 69, p. 3244-3250.
36. Lasala, F.; Martínez, J.; Núñez, R. /et al./. Producción de polihidroxialcanoatos (PHA) por bacterias diazótrofas II. Estudio de la biosíntesis a escala de zaranda con Mesorhizobium plurifarium (4033). Revista Biología, 2004, vol. 18, no. 2, p. 136-146.
37. Franco, Y.; Gómez, G.; Núñez, R. /et al./. Optimización de las condiciones de fermentación para la producción de polihidroxibutirato por Rhizobium tropici. Revista CENIC Ciencias Biológicas, 2009, vol. 40, no. 1, p. 53-57.
Recibido: 13 de abril de 2012
Aceptado: 6 de junio de 2012
Ionel Hernández Forte, Reserva Científica del departamento de Fisiología y Bioquímica Vegetal, Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, Mayabeque, CP 32 700. Email: ionel@inca.edu.cu