My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Cultivos Tropicales
Print version ISSN 0258-5936
cultrop vol.33 no.4 La Habana Oct.-Dec. 2012
Inoculación de hongos micorrízicos arbusculares (HMA) por dos vías diferentes en el cultivo del tomate (Solanum lycopersicum L.)
Arbuscular mycorrhizal fungi (AMF) inoculation by two different ways in tomato (Solanum lycopersicum L.) crop
M.Sc. Yonaisy Mujica Pérez
Investigador Aspirante del departamento de Biofertilizantes y Nutrición de las Plantas, Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, Mayabeque, Cuba. CP 32 700.
RESUMEN
Con el objetivo de evaluar la respuesta productiva del cultivo del tomate (Solanum lycopersicum L.) a la inoculación con hongos micorrízicos arbusculares del género Glomus por dos vías diferentes (sólido y líquido), se realizó este estudio en las áreas experimentales del departamento de Servicios Agrícolas, perteneciente al Instituto Nacional de Ciencias Agrícolas (INCA). Las cepas de hongos micorrízicos arbusculares (HMA) empleadas fueron: Glomus cubense (INCAM 4) y Glomus mosseae (INCAM 2), a partir de las cuales se obtuvieron cuatro dosis de inoculantes líquidos. Como inóculo sólido se utilizó en producto comercial EcoMic®. Se emplearon diez tratamientos y las evaluaciones se realizaron a los 30 y 55 días después del trasplante y en la cosecha; determinando variables fúngicas (frecuencia e intensidad de la colonización y proteína total en suelo), índices foliares (contenido foliar de nitrógeno, fósforo y potasio) y el rendimiento agrícola del cultivo (t.ha-1). La inoculación con HMA en soporte líquido resultó efectiva para el cultivo del tomate al comparar los resultados encontrados con el tratamiento inoculado con el biofertilizante sólido.
Palabras clave: micorriza, tomate, inoculación, Solanum lycopesicum L.l.
ABSTRAC
In order to evaluate productive response of tomato (Solanum lycopersicum L.) to inoculation with arbuscular mycorrhizal fungi of Glomus gender for two different ways (solid and liquid), a study was performed at experimental areas of the Department of Agricultural, belonging at National Institute of Agricultural Sciences. Strains of arbuscular mycorrhizal fungi (AMF) used were: Glomus cubense (INCAM 4) and Glomus mosseae (INCAM 2), which were obtained four doses of liquid inoculants. As solid inoculum was used in commercial product EcoMic®. Ten treatments were used and assessments were performed at 30 and 55 days after transplanting and at harvest, determining fungal variables (colonization frequency and intensity of and total protein in soil), foliar index (leaf content of nitrogen, phosphorus and potassium) and agricultural crop yield (t.ha-1). AMF inoculation in liquid media was effective for growing tomatoes by comparing results with the treatment inoculated with the bio solid.
Key words: mycorrhizal, tomato, inoculation, Solanum lycopersicum L.p.
INTRODUCCIÓN
En la rizosfera, fracción de suelo con influencia directa de las raíces de las plantas, cohabitan numerosos microorganismos que pueden influir positivamente en el crecimiento y desarrollo vegetal (1). Entre dichas interacciones se destaca la simbiosis que se establece entre las plantas y los hongos micorrízicos arbusculares (HMA) en diferentes ecosistemas agrícolas y naturales (2).
Dentro de las ventajas que obtienen de dicho proceso encontramos el incremento en la absorción de nutrientes minerales, la resistencia a condiciones de estrés, además de mejorar la estructura del suelo, sobre todo en la estabilidad de sus micro agregados, unido al rol importante que desempeñan estos microorganismos en la reserva de carbono del mismo (3). Los hongos micorrízicos arbusculares son considerados como la asociación simbiótica de mayor importancia para la agricultura, encontrándose resultados satisfactorios en cereales, hortalizas, granos y plantas ornamentales (1).
En los últimos años se han desarrollado diversas tecnologías para la reproducción de los HMA, siendo la más utilizada aquella que involucra a una planta hospedera en un sustrato sólido (4), debido a su condición de simbiontes obligados. En tal sentido, en el Instituto Nacional de Ciencias Agrícolas de Cuba, se comercializa un biofertilizante a partir de estos simbiontes (EcoMic®), con el cual se han obtenido resultados satisfactorios en leguminosas (5), en maíz (6) y en hortalizas como el tomate (7).
Teniendo en cuenta estos antecedentes, a partir del año 2000 se inician nuevos estudios científicos con el propósito de obtener un nuevo biofertilizante a partir de estos hongos pero en formulación líquida (LicoMic®) (8), teniendo como principales ventajas asegurar las inoculaciones por la vía del fertirriego, además de reutilizar la arcilla que se emplea en el proceso de reproducción.
Por tal motivo, el objetivo fundamental de este trabajo fue evaluar la respuesta productiva del cultivo del tomate (Solanum lycopersicum L.) a la inoculación con hongos micorrízicos arbusculares del género Glomus por dos vías diferentes (sólido y líquido) a campo abierto.
MATERIALES Y MÉTODOS
Condiciones Experimentales Generales
Los experimentos se desarrollaron en las áreas de producción del Departamento de Servicios Agrícolas (DSA) del Instituto Nacional de Ciencias Agrícolas, ubicado en el municipio de San José de las Lajas provincia Mayabeque durante dos campañas consecutivas (2008-2010). En la Tabla I se muestran las características químicas del suelo utilizado clasificado como Ferralítico Rojo Lixiviado (9) y se correlaciona con un Nitisol ferrálico (éutrico, ródico) (10).
Se utilizó el tomate (Solanum lycopersicum L. variedad Amalia) como planta modelo y las semillas se sembraron en un semillero tradicional durante 25 días. Los experimentos se realizaron entre los meses de noviembre-marzo. El semillero se estableció en noviembre (2008 y 2009) y se fertilizó con la fórmula completa NPK (9-13-17) a la dosis de 0,20 kg.m-2. En diciembre se prosiguió con la etapa de trasplante y se aplicó el mismo portador mineral a la dosis de 1 t.ha-1 en todas las parcelas, fraccionado en dos períodos: una primera aplicación en el momento del trasplante y la segunda 30 días posterior al mismo.
Inoculantes micorrizógenos
El inoculante líquido LicoMic® se formuló a partir de dos especies de hongos micorrízicos arbusculares (HMA) provenientes del cepario certificado del INCA: Glomus mosseae (Nicol. y Gerd., enmendado por Gerdeman y Trappe) (cepa INCAM 2) y Glomus cubense (Y. Rodr. & Dalpé) (cepa INCAM 4) (13). Para el desarrollo de esta investigación ambas especies fueron sometidas a un proceso de propagación en un sustrato proveniente de un suelo Hidromórfico Gley Vértico Carbonatado (9). Posteriormente, se formularon cuatro dosis del inoculante líquido (5, 10, 20 y 40 esporas de HMA como promedio por planta para cada cepa estudiada) atendiendo al total de plantas a sembrar por parcela.
Para el inoculante sólido (EcoMic®) se procedió la inoculación con la tecnología de recubrimiento de las semillas (14) a la dosis de 2 gramos.planta-1 (40 esporas como promedio) en el momento de la siembra, mientras que las diferentes dosis de LicoMic® se aplicaron siete días después de la germinación (ddg) a razón de 2 mL.planta-1.
Diseño experimental y evaluaciones
Se siguió un diseño completamente aleatorizado con 10 tratamientos y se realizaron cuatro repeticiones de cada tratamiento (Tabla II).

Las parcelas experimentales tenían un área total de 28 m2, en un marco de plantación de 1,40 m x 0,25 m (cuatro surcos). El área de cálculo fue de 0,35 m2 para las variables fúngicas e indicadores de crecimiento de las plantas y de 7 m2 para determinar el rendimiento del cultivo.
Se evaluaron los siguientes indicadores:
Indicadores fúngicos (30 y 55 días después del trasplante (ddt)): las muestras de raíces fueron teñidas mediante la técnica de tinción de raíces (15) y se determinó la frecuencia (16) e intensidad de la colonización a través de la metodología de los interceptos (17).
Proteína total en suelo (mg.g-1) (cosecha): mediante la extracción con la técnica de presión y calentamiento (18).
Índices foliares de las plantas (cosecha): los contenidos de nutrientes foliares (% de N, P y K) se determinaron por los métodos descritos en el manual de laboratorio de técnicas analíticas del INCA (19).
Rendimiento (70 ddt): se calculó para un promedio de tres cosechas en el cultivo (t.ha-1).
Análisis Estadístico
Los datos fueron analizados mediante el software SPSS para Windows (SPSS 11.5). Todos los caracteres cumplían los supuestos de normalidad y homogeneidad de varianza por lo cual se procedió a efectuar un análisis de varianza según modelo de clasificación simple al dato original*. Para la discriminación de medias se utilizó el procedimiento de Duncan con una significación de un 5 % en los casos en que el ANOVA resultó significativo.
RESULTADOS Y DISCUSIÓN
El grado de predominio de las especies microbianas en las raíces de las plantas está dado por el nivel de interacción planta-microorganismo y en la Figura 1 se describe el comportamiento de la frecuencia de colonización micorrízica para los dos momentos evaluados durante el ciclo experimental.
En la Figura 1A se muestra en comportamiento de la frecuencia de colonización a los 30 ddt y se encontró que los tratamientos inoculados con EcoMic® y los formulados con LicoMic® para las dos especies en estudio (Glomus mosseae y Glomus cubense) en la dosis de 20 y 40 esporas.planta-1 alcanzaron los valores más altos, con niveles cercanos al 40 %. Para las restantes dosis del inoculante líquido se encontró que mantuvieron un comportamiento similar, independientemente de la especie en estudio. En sentido general, la respuesta de este indicador fue positiva, ya que los niveles encontrados superaron al tratamiento testigo.
Por otra parte, a los 55 ddt (Figura 1B) se encontró que todos los tratamientos inoculados, ya fueran con el inoculante sólido o líquido y en cualquiera de las dosis y especies evaluadas, mostraron valores significativamente superiores comparados con el testigo no inoculado, lo que permite destacar que ambos biofertilizantes resultaron ser eficientes para el cultivo del tomate. Los valores máximos alcanzados en este ensayo (55 %) fueron superiores si se comparan con los obtenidos en el cultivo del trigo cultivado en suelos de la misma área experimental, donde se reportan cifras cercanas al 48 % y 53 % para tratamientos inoculados con EcoMic® y LicoMic® respectivamente (20).
Al observar los valores de la intensidad de la colonización micorrízica (Figura 2) se muestra que los mayores porcentajes estuvieron en los tratamientos inoculados con respecto al testigo, comportamiento que se corresponde con la frecuencia de colonización alcanzada por el cultivo del tomate. Se observa en la Figura 2A que los valores de intensidad de la colonización son más bajos si se comparan con el segundo muestreo. Este fenómeno se explica porque al inicio del establecimiento de la simbiosis micorrízica, la actividad fúngica está enfocada solo a colonizar la planta, pero posteriormente se incrementan el contenido de hifas en el interior de la membrana plasmática y las estructuras arbusculares (21).
Por otra parte, en la Figura 3 se describe el contenido de proteína total en suelo al finalizar el ciclo experimental, destacándose con valores muy cercanos a 13 mg.g-1 los tratamientos inoculados con EcoMic® y los formulados con LicoMic® para las dos especies en estudio (Glomus mosseae y Glomus cubense) en la dosis de 20 y 40 esporas por planta. Estos valores son superiores si se comparan con los encontrados para diferentes condiciones de manejo de suelo, donde se plantea que en presencia de ambientes conservados el contenido de proteínas totales aumenta (22). Por otra parte, en el cultivo del trigo se obtuvieron niveles de esta glicoproteína superiores en los tratamientos inoculados en relación con el testigo (20).
En el tratamiento testigo, el contenido de proteína total en suelo fue bajo lo que puede ser atribuible a la presencia de algunas estructuras fúngicas no competitivas con las inoculadas presentes en el suelo donde se realizó el estudio. No obstante, los resultados de esta variable coinciden con otros estudios realizados, donde se demuestra que la glicoproteína producida por los HMA contribuye a estabilizar microagregados en el suelo, estabilizan la materia orgánica del mismo y por lo tanto mejoran sus propiedades físicas (23).
En la Tabla III se describen los contenidos foliares de los elementos nutricionales nitrógeno, fósforo y potasio. Los contenidos de nitrógeno foliar (%) encontrados muestran que hubo mayor movilidad de este nutriente en las plantas micorrizadas, destacándose las inoculadas con EcoMic® y LicoMic® (20 y 40 esporas por planta) independientemente de la especie de HMA estudiada, coincidiendo con otros resultados que avalan la traslocación de dicho elemento por las hifas del hongo una vez colonizada la planta (24).
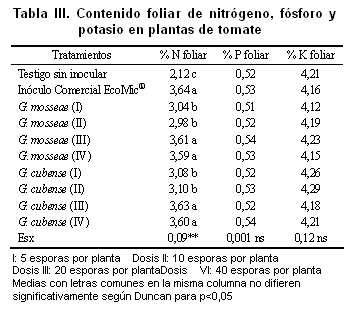
El porcentaje de fósforo foliar no reflejó diferencias significativas para ninguno de los tratamientos en estudio, lo cual puede deberse a los contenidos de este elemento registrados por el análisis de suelo (Tabla I), que es tomado por las plantas de la solución del suelo a través de su sistema radical y en este caso en particular por la interacción tripartita planta-micorrizas arbusculares (simbiosis micorrízica) y suelo, e indicando un buen desarrollo del cultivo.
Los contenidos foliares de potasio resultaron semejantes para los diferentes tratamientos evaluados, mostrando niveles satisfactorios para este cultivo. Por otra parte, se plantea que como este elemento se mueve con mayor facilidad en la solución del suelo, en la actualidad se profundiza en estudios sobre los posibles mecanismos que intervienen en el transporte directo de estos iones por las hifas del hongo (25).
En el rendimiento agrícola del cultivo del tomate (Figura 4), se encontró una respuesta positiva de los tratamientos inoculados en relación con el testigo no inoculado, destacándose ambas vías de inoculación en relación con el tratamiento testigo. Para los tratamientos con inoculante líquido se encontró que ambas especies mostraron una respuesta adecuada para el cultivo, lo que coincide con los criterios ya establecidos para la selección de especies en función del tipo de suelo, donde Glomus cubense se recomienda como promisoria para suelos Ferralíticos Rojos (26).
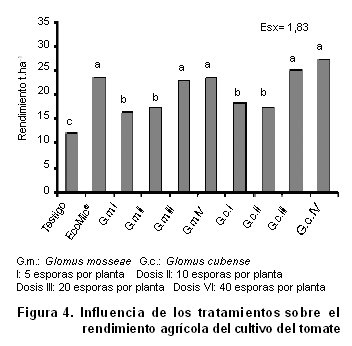
Al realizar un análisis integral de los resultados de este estudio se encontró una relación positiva entre el funcionamiento fúngico y la respuesta productiva del cultivo del tomate, destacando que la asociación tripartita (micorriza arbuscular-cultivo-suelo) favorece el desarrollo y la producción de dicha hortaliza.
En sentido general, los resultados de esta investigación demuestran que la inoculación con HMA en soporte líquido resultó efectiva para el cultivo del tomate, al comparar los resultados encontrados con el tratamiento inoculado con el biofertilizante sólido, pero se recomienda continuar las investigaciones encaminadas a optimizar las dosis de inoculación.
Referencias
1. Anwar, S. Z. y Pichtel, J. Mycorrhizae: An Overview. Mycorrhizae: Sustainable Agriculture and Forestry. Springer Science + Business Media B. V. 2008. p. 1-35. ISBN: 978-1-4020-8769-1.
2. Adesemoye, A. O. y Kloepper, J. W. Plant-microbes interactions in enhanced fertilizer-use efficiency. Appl. Microbiol. Biotechnol., 2009, vol. 85, p. 1-12.
3. Anwar, Z.; Sayeed, M. y Futai, K. Mycorrhizae: Sustainable Agriculture and Forestry. (Ed) Anwar, Z.; Sayeed, M. and Futai, K. 2008, 365 p. ISBN: 978-1-4020-8769-1.
4. Daniel Uribe, D.; Sánchez-Nieves, J., y Vanegas, J. Role of Microbial Biofertilizers in the Development of a Sustainable Agriculture in the Tropics. En: Soil Biology and Agriculture in the Tropics. (Ed.) Springer-Verlag Berlin Heidelberg, 2010. p. 235-250.
5. Mohammadi, K.; Khalesro, S.; Sohrabi, Y. y Heidari, G. A Review: Beneficial Effects of the Mycorrhizal Fungi for Plant Growth. J. Appl. Environ. Biol. Sci., 2011, vol. 1, no. 9, p. 310-319, ISSN: 2090-4215.
6. Zhu, X. C.; Song, F. B. y Xu, H. W. Arbuscular mycorrhizae improves low temperature stress in maize via alterations in host water status and photosynthesis. Plant Signaling & Behavior, 2010, vol. 5, no. 5, p. 591-593.
7. Fundora, L. R.; Rodríguez, Yaquelín; Mena, Aracely; González, P. J.; Rodríguez, P.; González-Peña, Dianevys. Estabilidad de la eficiencia de la cepa Glomus mosseae en la respuesta del tomate a condiciones de estrés hídrico fuera de su período óptimo. Cultivos Tropicales, 2008, vol. 29, no. 4, p. 47-53. [Consultado 15 junio del 2012]. Disponible en: <http://redalyc.uaemex.mx/src/inicio/ArtPdfRed.jsp?iCve=193214911006> .
8. Fernández, F.; Dell Amico, J. y Pérez, Y. Inoculante micorrizógeno líquido. Oficina Cubana de la Propiedad Industrial. Cuba, Patente No 23479. 2009.
9. Hernández, A.; Pérez, J. M.; Bosch, D. y Rivero, L. Nueva versión de clasificación genética de los suelos de Cuba. La Habana. 1999, Agrinfor. 64 p.
10. IUSS Working Group WRB. World Reference Base for soil resources. World Soil Resources Reports, FAO, Rome, 2006, no. 103, 128 p.
11. Gerdemann, J. W. y Nicholson, T. H. Spore of mycorrhizae endogone species extracted from soil by wet sieving and decanting. Trans. Brit. Mycol. Soc., 1963, p. 235-244.
12. Herrera R. A.; Ferrer R. L.; Furrazola E. y Orozco M. O. Estrategia de funcionamiento de las micorrizas VA en un bosque tropical. Biodiversidad en Iberoamérica. Ecosistemas, Evolución y Procesos sociales. (Eds. Maximina Monasterio) programa Iberoamericano de Ciencia y Tecnología para el desarrollo. 1995, Subprograma XII, Diversidad Biológica, Mérida.
13. Rodríguez, Y.; Dalpé, Y.; Séguin, S.; Fernández, K.; Fernández, F. y Rivera, R. A. Glomus cubense sp. nov., an arbuscular mycorrhizal fungus from Cuba. MYCOTAXON, 2011, vol. 118, p. 337-347.
14. Fernández, F.; Gómez, R.; Vanegas, L. F.; Noval, B. M. de la y Martínez, M. A. Producto inoculante micorrizógeno. Oficina Nacional de Propiedad Industrial. Cuba, Patente No. 22641. 2000.
15. Mosse, B. The establishment of vesícula-arbuscular mycorrhizal under aseptic conditions. J. Gen. Microbiol., 1962. vol. 27, p. 509-520.
16. Phillips, J. M. y Hayman, D. S. Improved procedure for clearing roots and staining parasitic and vesiculararbuscular mycorrhizal fungi for rapid assessment of infection. Trans. Brit. Mycol. Soc., 1970. p. 158-161.
17. Giovanetti, M. y Mosse, B. An evaluation of techniques for measuring vesicular-arbuscular mycorrhizal infection in roots. New Phytol., 1980, no. 84, p. 489-500.
18. Trouvelot, A.; Kough, J. y Gianinazzi Pearson, V. Mesure du Taux de Mycorhization VA d’un Systeme Radiculaire. Recherche de Methodes d’Estimation ayantune Signification Fonctionnelle. Proceedings of the 1st European Symposium on Mycorrhizae: Physiological and Genetical Aspects of Mycorrhizae, INRA, Paris. 1986. p. 217-222.
19. Wright, S. E.; Nichols, K. A. y Schmidt, W. F. Comparison of efficacy of three extractants to solubilize glomalin on hyphae and in soil. Chemosphere, 2006. vol. 64, no. 7, p. 1219-1224.
20. Paneque, V. M.; Calaña, J. M.; Calderón, M.; Borges, Y.; Hernández, T. C. y Caruncho, M. Manual de técnicas analíticas para análisis de suelo, foliar, abonos orgánicos y fertilizantes químicos. Ediciones INCA, 2010, 160 p, ISBN: 978-959-7023-51-7.
21. Plana, R.; González, P. J.; Dell’Amico, J. M.; Fernández, F.; Calderón, A.; Marrero, Y. Efecto de dos inoculantes micorrízicos arbusculares (base líquida y sólida) en el cultivo del trigo duro (Triticum durum). Cultivos Tropicales, 2008, vol. 29, no. 4, p. 35-40. [Consultado 15 junio del 2012]. Disponible en: <http://redalyc.uaemex.mx/src/inicio ArtPdfRed.jsp?iCve=193214911011> .
22. Fernández, F.; Dell’Amico, J. M.; Angoa, M. y de la Providencia I. E. Use of a liquid inoculum of the arbuscular mycorrhizal fungi Glomus hoi in rice plants cultivated in a saline Gleysol: A new alternative to inoculate. Journal of Plant Breeding and Crop Science, 2011, vol. 3, no. 2, p. 24-33.
23. Morell, F.; Hernández, A.; Fernández, F. y Toledo Y. Caracterización agrobiológica de los suelos Ferralíticos Rojos lixiviados de la región de San José de las Lajas, en relación con el cambio en el manejo agrícola. Cultivos Tropicales, 2006, vol. 27, no. 4, p. 13-18.
24. Helgason, B. L.; Walley, F. L. y Germida, J. J. No-till soil management increases microbial biomass and alters community profiles in soil aggregates. Applied Soil Ecology, 2010, vol. 46, p. 390-397.
25. Cornejo, P.; Borie, F.; Rubio, R. y Azcon, R. Influence of nitrogen source on the viability, functionality and persistence of Glomus etunicatum fungal propagules in an Andisol. Applied Soil Ecology, 2007. vol. 35, no. 2, p. 423-431.
26. Varma, A. State of the Art, Genetics and molecular Biology, Eco-Function, biotechnology, Eco-Physiology, Structure and systematics. Ed: Ajit Varma, 2008, 797 p.
27. Rivera, R.; Fernández, F.; Fernández, K.; Ruiz, L.; Sánchez, C. y Riera, M. Advances in the management of Effective Arbuscular Mycorrhizal Symbiosis. In: Mycorrhizae in Crop Producttion. 2007, p. 151-188.
Recibido: 6 de abril de 2011
Aceptado: 10 de abril de 2012
M.Sc. Yonaisy Mujica Pérez, Investigador Aspirante del departamento de Biofertilizantes y Nutrición de las Plantas, Instituto Nacional de Ciencias Agrícolas (INCA), gaveta postal 1, San José de las Lajas, Mayabeque, Cuba. CP 32 700. Email: ymujica@inca.edu.cu




![Resistance to Tomato Yellow Leaf Curl Virus (TYLCV-IL [CU]) in F2 tomato (S. lycopersicum, L.) populations segregating for Ty-1 y Ty-2 genes](/img/en/prev.gif)









