INTRODUCCIÓN
El quitosano es un biopolímero lineal de monómeros de glucosamina y una pequeña cantidad de monómeros de N-acetil-glucosamina, derivado por desacetilación parcial de la quitina, la cual es reconocida como el segundo polisacárido más abundante en la naturaleza después de la celulosa 1. El quitosano es un reconocido bioestimulante agrícola por causar efectos biológicos en las plantas como son la promoción del crecimiento y desarrollo y la protección anti estrés a través de la activación del metabolismo vegetal. De esta forma, la estimulación del crecimiento y desarrollo en las plantas por polímeros y oligómeros de quitosano es el resultado del beneficio de la acumulación de nutrientes esenciales, del proceso de fotosíntesis y la acumulación de carbohidratos, de la activación de enzimas del metabolismo del carbono y el nitrógeno y del aumento del contenido de metabolitos secundarios 2-5.
Algunos autores han informado beneficios en el desarrollo de la soya con quitosano y sus derivados con diferentes masas moleculares, concentraciones, formas y momentos de aplicación de estos compuestos 6-9. En particular, la mayor parte de las investigaciones realizadas en el cultivo con la aspersión foliar han empleado concentraciones altas de quitosano y sus derivados (de 1 a 40 g L-1), con consecuencias significativas en su desarrollo que, inclusive, han reducido los efectos negativos causados por estreses abióticos 3,10. Sin embargo, resultados previos en el cultivar IS-27 demuestran el efecto positivo de concentraciones menores a 1 g L-1 de un polímero y un oligómero de quitosano, en la nodulación y el crecimiento in vitro11. Dichas concentraciones no se han evaluado en este cultivar mediante aspersión foliar del polímero.
Por lo anterior, el objetivo del presente trabajo fue evaluar el efecto de diferentes concentraciones (1, 10, 50, 100, 500 y 1000 mg L-1) de quitosano, aplicadas en las etapas V1 y V2 por aspersión foliar, en indicadores de la nodulación, la fisiología y el crecimiento vegetativo de soya cv IS-27 inoculada con Azofert-S®, en condiciones controladas.
MATERIALES Y MÉTODOS
Polímero de quitosano
El polímero de quitosano comercial (PANVO Chemicals, India) fue caracterizado por el Grupo de Productos Bioactivos del INCA, mediante viscosimetría y espectrometría infrarroja, mostrando entre sus características físico-químicas una masa molar de 100 kDa y un grado de acetilación del 13,7 %, respectivamente. A partir de una solución madre de 10 g L-1 de quitosano disuelto en ácido acético (1 %) y ajustada a pH= 5,2 con KOH, se tomaron alícuotas para preparar las diferentes concentraciones a evaluar: 1, 10, 50, 100, 500 y 1000 mg L-1 para su aplicación foliar en plantas de soya.
Análisis químico del suelo
En la ejecución del experimento se utilizó un suelo proveniente del Instituto Nacional de Ciencias Agrícolas (INCA), que se clasificó físicamente como Ferralítico Rojo Lixiviado típico, éutrico 12. El análisis químico de este suelo se realizó en el Laboratorio de Biofertilizantes y Nutrición de las Plantas de la propia institución, a partir de muestras colectadas entre 0 y 20 cm de profundidad 13. El suelo presentó valores bajos de materia orgánica (16,1 g kg-1), pH (H2O) ligeramente ácido (6,23), contenido alto de fósforo (P) disponible (180 mg kg-1) y potasio (K+) intercambiable (1,23 Cmolc kg-1), así como altos contenidos de calcio (Ca2+) (29,25 Cmolc kg-1) y magnesio (Mg2+) (9,75 Cmolc kg-1) intercambiables, sin presencia de sodio (Na+). Estos valores resultan adecuados para el cultivo de la soya, que requiere una fertilidad media 14.
Condiciones de cultivo
Las semillas de soya cv IS-27 se inocularon con el inoculante comercial Azofert-S® a base de la cepa ICA 8001 de B. elkanii, en una dosis de 200 mL por cada 50 kg de semilla y con una concentración de 1x1010 unidades formadoras de colonias por mililitro (UFC mL-1), en el momento de la siembra. Las semillas se dejaron secar por una hora antes de sembrarse en macetas plásticas de 1370,25 cm3 de volumen y 1,2 kg de capacidad de suelo, a razón de dos plantas por maceta. Las plantas se cultivaron en una cámara de crecimiento, con un ciclo de 16/8 horas luz/oscuridad, temperatura entre 25-27 ºC y humedad relativa del aire entre 50-70 %. Se conformaron ocho tratamientos en total, seis de ellos correspondieron a las concentraciones de quitosano, que se asperjaron foliarmente (1 mL por planta) en dos etapas (V1 y V2) de crecimiento de la soya y, dos tratamientos controles sin presencia de quitosano: uno inoculado (CI) y otro no (CA). Se seleccionaron treinta plantas por tratamiento (n=30) para realización de las evaluaciones morfoagronómicas y fisiológicas relacionadas con la nodulación y el crecimiento de las plantas.
Evaluaciones en las plantas
Entre las variables de nodulación evaluadas se realizó el conteo del número de nódulos distribuidos en la raíz principal (RP) y raíces secundarias (RS) además de los totales (NT) formados por planta. Igual, fue determinado por pesadas, la masa seca de los nódulos por secciones radiculares, luego de colocarse en la estufa a 75 ºC durante tres días y el porcentaje de efectividad nodular (%) según la coloración rojiza en el interior de los nódulos con un corte transversal de los mismos.
A los 15 días (V1), 22 días (V2) y 29 días (V3-V4) de cultivadas las plantas se colectaron muestras de terceros trifoliolos para desarrollar la actividad enzimática nitrato reductasa (NR) 15, excepto en el primer momento (V1) que se tomó el primer trifoliolo para comparar los tratamientos controles (absoluto e inoculado). En todos los casos, las hojas se cortaron en segmentos de aproximadamente 1-1,5 cm y se pesaron 0,25 g antes de colocarse en tubos de ensayo, conformándose tres repeticiones de cada muestra foliar y leídas a una longitud de onda de 540 nm. Se realizó una curva patrón de nitrito de sodio (NaNO2) en un rango de concentración desde 2 hasta 24 nmol y los datos se expresaron en nitrito producido (μmol NO-2) min-1 mg-1 de masa fresca (MF) de hojas.
La concentración de macronutrientes se determinó por análisis químico en nódulos y terceros trifoliolos, tales como el N por el método Nessler, el P por la formación de azul de molibdeno y el K por fotometría de llama (mg kg-1 de muestra seca) 13. Se realizó la determinación de los iones Ca, Mg, Mn, Fe, Zn y Na (mg kg-1) por espectrofotometría de absorción atómica de llama (Rayleigh, modelo WFX-210, China), a partir de la digestión de muestras secas molinadas (0,5 g) de ambos órganos de soya con ácido nítrico (HNO3, 4 mL) concentrado, en horno microondas por 20 minutos. De acuerdo a la norma ISO-11466 (1995) se realizaron curvas patrones y diluciones con agua desionizada para cada elemento, excepto para Ca y Mg que se diluyeron en una solución de cloruro de lantano (0,2 %). También, el contenido relativo de clorofilas totales se determinó en los terceros trifoliolos con un medidor portátil (MINOLTA SPAD* 502 plus), por lo que los valores se muestran como unidades spad.
En cuanto a las variables de crecimiento se evaluó el número de hojas trifoliadas, el diámetro del tallo (mm) medido con un pie de Rey electrónico digital (0-150 mm, China), la longitud del tallo y radical (cm). La masa seca (g planta-1) de los órganos de soya se determinó en una balanza analítica Sartorius CPA 3245, luego de colocar las muestras en una estufa de aire forzado (BINDER, USA) durante 72 horas, a 75 ºC hasta obtener peso contante. Además, se deshojaron las plantas por método destructivo para determinar el área foliar (cm2) de todas las hojas trifoliadas de cada planta, que se escanearon con un escáner de mesa (Canon MG2520) y todas las imágenes se procesaron con el software Adobe Photoshop CS, (versión 8, 2003).
Análisis estadístico de los datos
El experimento, con un diseño completamente aleatorizado, se repitió dos veces y se muestran los resultados de una de las repeticiones experimentales. A los datos obtenidos se les verificó los supuestos de normalidad y homogeneidad de varianza por las Pruebas de Kolmogorov - Smirnov y Levene, además de realizarles un ANOVA de Clasificación Simple. Los tratamientos controles se compararon mediante la Prueba t de Student en la etapa V1 de crecimiento para la determinación de la actividad enzimática NR. Se utilizó el paquete estadístico Statgraphics (versión 5, 2011). La comparación de las medias resultantes se realizó por la Prueba de Tukey HSD p< 0,05 y los gráficos se realizaron en SigmaPlot, (versión 11, 2008).
RESULTADOS
Al evaluar el efecto del quitosano aplicado por aspersión foliar de soya se observa una superioridad de las concentraciones 10 y 50 mg L-1, en la formación de nódulos en la raíz principal (RP), además de 500 mg L-1 en las raíces secundarias (RS), en comparación con el CA; mientras que en el número de nódulos totales (NT), se destacaron las concentraciones antes mencionadas, respecto a los controles. Los incrementos de estas concentraciones de quitosano oscilaron entre 32 y 74 %, respecto a las plantas inoculadas con Bradyrhizobium (Figura 1).
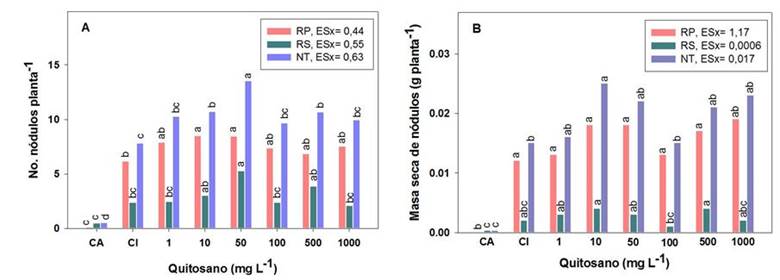 Medias con letras iguales no difieren estadísticamente para p< 0,05, según la Prueba de Rangos Múltiples de Tukey HSD. ES X: Error estándar del experimento (n = 30)
Medias con letras iguales no difieren estadísticamente para p< 0,05, según la Prueba de Rangos Múltiples de Tukey HSD. ES X: Error estándar del experimento (n = 30)Figura 1 Efecto de diferentes concentraciones de quitosano aplicadas por aspersión foliar en el número y la masa seca de nódulos totales (NT), de la raíz principal (RP) y de raíces secundarias (RS), de plantas de soya cv IS-27 inoculadas con B. elkanii
Aún, cuando se encontraron grandes diferencias en el número de nódulos, las diferencias en la masa seca de los mismos fueron menor, entre las plantas inoculadas (CI) y las tratadas con quitosano por aspersión foliar (Figura 1). El quitosano aplicado por aspersión foliar de soya no modificó la masa seca de los nódulos formados en las raíces principales de las plantas inoculadas. Sin embargo, la masa seca de los nódulos formados en las raíces secundarias (RS) se benefició con las concentraciones 10 y 500 mg L-1 de quitosano, mientras que la masa de los nódulos totales se benefició con las concentraciones 10, 50, 500 y 1000 mg L-1 de quitosano, con incrementos en esta variable, de aproximadamente entre 40 y 67 %, respecto al CI (Figura 1).
En la Tabla 1, se aprecia la actividad enzimática nitrato reductasa (NR) determinada en hojas colectadas en tres momentos del crecimiento vegetativo de plantas IS-27 de soya. Un primer momento (V1), en el cual no se había realizado la aspersión foliar de quitosano, para comparar los valores de las plantas controles. Los otros dos momentos fueron a los siete días de realizada cada aspersión foliar de quitosano.
En la fase V1 de crecimiento de las plantas, la prueba t de student arrojó diferencias significativas entre los controles (CA y CI), destacándose la inoculación de B. elkanii sobre las plantas no inoculadas en una mayor actividad NR (40 % de incremento) determinada en hojas (Tabla 1). En las siguientes etapas, las plantas asperjadas con quitosano produjeron mayores valores de nitrito (NO-2), que inmediatamente se convierten en amonio (forma asimilable por las plantas). Las concentraciones desde 10 a 500 mg L-1 de quitosano, contribuyeron a la acumulación de esta actividad en ambos momentos. Sin embargo, en la fase V2, hubo incrementos entre 10 y 28 %, respecto al control inoculado; mientras que en V3, los incrementos de actividad con quitosano estuvieron entre 0,5 y 4,3 veces por encima del valor de actividad del control inoculado a pesar de tener los valores absolutos más bajos (Tabla 1).
Tabla 1 Efecto de diferentes concentraciones de quitosano aplicadas por aspersión foliar en el comportamiento de la actividad Nitrato reductasa en el crecimiento (V1-V4) de plantas de soya inoculadas con B. elkanii, en condiciones controladas
| Quitosano mg L-1 | Act. NO3 reductasa (μmol NO2-) min-1 mg-1 MF foliar) | ||
| V1 | V2 | V3-V4 | |
| CA | 4,3013 | 11,443 e | 0,851 d |
| CI | 6,0544 | 13,343 cd | 0,926 d |
| Q-1 | 11,733 de | 0,866 d | |
| Q-10 | 15,791 ab | 2,327 bc | |
| Q-50 | 17,119 a | 3,281 b | |
| Q-100 | 15,523 ab | 4,816 a | |
| Q-500 | 16,715 a | 4,933 a | |
| Q-1000 | 14,287 bc | 1,389 cd | |
| ES X |
|
0,285** | 0,264* |
Medias con letras iguales no difieren estadísticamente para p< 0,05, según la Prueba de Rangos Múltiples de Tukey HSD. ES X: Error estándar del experimento (n = 4)
La aplicación foliar de quitosano no modificó la respuesta encontrada en la concentración de N en los órganos de soya más allá del incremento obtenido con la inoculación de las semillas con la bacteria, excepto con la concentración de 1000 mg L-1 en los nódulos que aumentó en 10 % el contenido de N, respecto al CI (Tabla 2 y 3).
Tabla 2 Efecto de la aspersión foliar de quitosano en la concentración de nutrientes determinados en nódulos de plantas de soya inoculada con B. elkanii
| Quitosano (mg L-1) | Concentración de nutrientes en nódulos (mg kg-1) | ||||||||
| N | P | K | Ca | Mg | Mn | Fe | Zn | Na | |
| CA | 1,28 b | 0,258 c | 15,0 e | 16,83 c | 29,0 d | 0,18 b | |||
| CI | 6,85 bc | 0,63 a | 1,81 ab | 1,50 ab | 0,660 a | 11,2 f | 17,11 c | 29,2 cd | 0,90 a |
| Q- 1 | 6,26 d | 0,61 ab | 1,79 ab | 1,55 ab | 0,420 b | 10,5 f | 19,17 bc | 31,9 bcd | 0,11 b |
| Q- 10 | 6,13 d | 0,59 ab | 1,78 ab | 1,60 ab | 0,130 d | 15,1 e | 20,78 b | 33,3 abc | 0,21 b |
| Q- 50 | 6,73 c | 0,60 ab | 1,84 ab | 1,65 a | 0,040 d | 30,7 a | 26,98 a | 35,2 ab | 0,70 a |
| Q- 100 | 7,25 ab | 0,49 ab | 1,90 a | 1,70 a | 0,090 d | 25,0 c | 19,50 bc | 29,7 cd | 0,15 b |
| Q- 500 | 6,94 bc | 0,57 ab | 1,69 b | 1,83 a | 0,099 d | 28,2 b | 19,00 bc | 36,6 a | 0,16 b |
| Q- 1000 | 7,56 a | 0,45 b | 1,88 ab | 1,80 a | 0,091 d | 21,8 d | 18,80 bc | 34,1 ab | 0,16 b |
| ES X | 0,079 | 0,021** | 0,034 | 0,045** | 0,021 | 0,3 | 0,42** | 0,7 | 0,03** |
Medias con letras iguales no difieren estadísticamente para p< 0,05, según la Prueba de Rangos Múltiples de Tukey HSD. ES X: Error estándar del experimento (n = 2). Nd: no se determinó la concentración de los macronutrientes N, P y K en los nódulos de las plantas controles (CA) por no haber suficiente muestra para su determinación
Tabla 3 Efecto de la aspersión foliar de quitosano en la concentración de nutrientes determinados en hojas de plantas de soya inoculada con B. elkanii
| Quitosano (mg L-1) | Concentración de nutrientes en hojas (mg kg-1) | ||||||||
| N | P | K | Ca | Mg | Mn | Fe | Zn | Na | |
| CA | 4,65 c | 0,41 | 2,29 | 1,49 c | 0,131 cd | 14,1 e | 18,22 b | 31,9 b | 0,38 c |
| CI | 6,56 a | 0,41 | 2,24 | 1.60 c | 0,418 b | 15,8 de | 18,00 b | 35,1 ab | 0,30 c |
| Q- 1 | 5,36 bc | 0,42 | 2,44 | 1,60 c | 0,187 c | 47,1 ab | 17,50 b | 35,4 ab | 0,71 b |
| Q- 10 | 5,57 b | 0,42 | 2,33 | 2,00 bc | 0,515 a | 48,0 ab | 19,00 ab | 38,3 a | 0,17 d |
| Q- 50 | 7,25 a | 0,48 | 2,39 | 2,50 ab | 0,149 cd | 26,8 c | 21,85 ab | 23,6 c | 0,88 a |
| Q- 100 | 5,67 a | 0,42 | 2,57 | 2,75 a | 0,129 cd | 43,6 b | 27,50 a | 24,0 c | 0,89 a |
| Q- 500 | 5,57 b | 0,41 | 2,45 | 3,00 a | 0,099 d | 49,0 a | 22,32 ab | 25,9 c | 0,86 a |
| Q- 1000 | 7,21 a | 0,41 | 2,20 | 3,00 a | 0,089 d | 19,5 d | 22,82 ab | 24,5 c | 0,80 ab |
| ES X | 0,13 | 0,03 | 0,078 | 0,10 | 0,008 | 0,83 | 1,61 | 0,7 | 0,02 |
Medias con letras iguales no difieren estadísticamente para p< 0,05, según la Prueba de Rangos Múltiples de Tukey HSD. ES X: Error estándar del experimento (n = 3)
En los trifoliolos de soya, la concentración de P y K no mostraron diferencias significativas entre los tratamientos (Tabla 2) y de forma general, tampoco hubo diferencias a nivel de los nódulos, excepto las concentraciones 100 y 1000 mg L-1, que redujeron el contenido de K y P respecto al CI, en un 5 y 40 %, respectivamente (Tabla 3).
Aunque la inoculación con Bradyrhizobium no aumentó los niveles de Ca y Mn respecto al CI, sí se elevaron ambos nutrientes con varios de los tratamientos de quitosano en ambos órganos evaluados (Tabla 2 y 3). Las concentraciones entre 50 y 1000 mg L-1 aumentaron el contenido de Ca entre 56 y 87 % en las hojas y 10 y 22 % en los nódulos, estando el mayor incremento con 500 mg L-1. Por su parte, el aumento del contenido de Mn en las hojas ocurrió con las aplicaciones de quitosano entre 1 y 500 mg L-1 con incrementos entre 70 y 200 % por encima de los controles, siendo el mejor tratamiento 500 mg L-1, mientras en los nódulos los incrementos ocurrieron entre 50 y 1000 mg L-1, estando el mejor comportamiento con 50 mg L-1 y con aumentos entre 94 y 170 % respecto al CI que, a su vez, redujo en 34 % el contenido de Mn obtenido con el CA.
La inoculación con la bacteria simbionte aumentó el contenido de Mg en 219 y 156 % en hojas y nódulos de las plantas respectivamente, sin embargo, la aplicación de todas las concentraciones de quitosano redujeron entre 123 y 370 % en las hojas, excepto la concentración de 10 mg L-1 que aumentó un 23 % el valor de Mg del control inoculado. Similar comportamiento ocurrió en los nódulos. Todos los tratamientos de quitosano sin excepción, redujeron el contenido de Mg, respecto a la inoculación entre 57 y 1550 % (Tabla 2 y 3).
Los niveles de Fe no se vieron afectados por la inoculación con Bradyrhizobium en ambos órganos y solo fueron aumentados respecto al CA con la aplicación de 100 mg L-1 de quitosano en las hojas con un 53 % de incremento y con 10 y 50 mg L-1 en los nódulos que aumentaron 21 y 58 %, respectivamente (Tabla 2 y 3).
En hojas de soya, las concentraciones desde 50 a 1000 mg L-1 de quitosano redujeron la concentración de Zn y aumentaron la concentración de Na, mientras aumentaron el Zn en los nódulos, excepto 100 mg L-1. La inoculación no afectó el comportamiento de Zn en ambos órganos (Tabla 2 y 3).
El quitosano afectó la concentración de macronutrientes y oligoelementos determinados en los órganos de soya inoculada con Bradyrhizobium, en dependencia de la concentración del polímero y del órgano de la planta. De forma general, los nutrientes en los nódulos se incrementaron con 50 mg L-1 de quitosano y en los terceros trifoliolos, con las concentraciones más bajas (1 y 10 mg L-1), excepto el nitrógeno en ambos órganos de las plantas.
El contenido relativo de clorofilas totales se benefició con la aplicación de las concentraciones de 10 a 500 mg L-1 de quitosano, que incrementaron la variable entre un 6 y 8,4 %, respecto a las plantas no inoculadas aunque sin diferencias con el control inoculado (Figura 2).
 Medias con letras diferentes indican diferencias significativas entre los tratamientos, según la Prueba de Rangos Múltiples de Tukey HSD. Error estándar del experimento (ES X = 0,451, n= 30)
Medias con letras diferentes indican diferencias significativas entre los tratamientos, según la Prueba de Rangos Múltiples de Tukey HSD. Error estándar del experimento (ES X = 0,451, n= 30)Figura 2 Efecto de diferentes concentraciones de quitosano aplicadas por aspersión foliar en el contenido relativo de clorofilas totales (spad) de terceros trifoliolos de soya cv IS-27 inoculada con B. elkanii
La respuesta en el crecimiento vegetativo de soya con la aplicación foliar de quitosano mostró diferencias significativas en todas las variables morfoagronómicas evaluadas en la fase V4 (Tabla 4).
Tabla 4 Respuesta morfoagronómica de soya inoculada con B. elkanii, con la aplicación de diferentes concentraciones de quitosano por aspersión foliar de las plantas
| Quitosano mg L-1 | Número hojas | Diámetro tallo (mm) | Longitud tallo (cm) | Longitud radical (cm) | Masa seca aérea (g) | Masa seca radical (g) | Área foliar (cm2) |
| CA | 3,46 b | 2,39 b | 43,62 b | 33,65 b | 0,480 c | 0,170 b | 192,00 c |
| CI | 3,82 ab | 2,47 b | 50,75 a | 35,39 ab | 0,581 bc | 0,175 ab | 198,65 bc |
| Q-1 | 3,86 a | 2,37 b | 43,27 b | 38,47 ab | 0,614 ab | 0,190 ab | 199,68 bc |
| Q-10 | 3,89 a | 2,47 b | 46,05 ab | 34,21 ab | 0,647 ab | 0,199 ab | 195,60 bc |
| Q-50 | 3,93 a | 2,54 b | 47,03 ab | 35,99 ab | 0,680 ab | 0,185 ab | 203,40 abc |
| Q-100 | 3,93 a | 2,51 b | 49,69 a | 38,94 a | 0,600 ab | 0,177 ab | 201,57 abc |
| Q-500 | 4,11 a | 2,75 a | 50,84 a | 34,81 ab | 0,674 ab | 0,245 a | 297,00 a |
| Q-1000 | 4,00 a | 2,79 a | 48,45 ab | 38,93 a | 0,715 a | 0,240 a | 218,73 ab |
| ES X | 0,074** | 0,045 | 1,06 | 1,17 | 0,03 | 0,017 | 5,56 |
Medias con letras iguales no difieren estadísticamente para p< 0,05, según la Prueba de Rangos Múltiples de Tukey HSD. ES X: Error estándar del experimento (n = 30)
Todas las concentraciones de quitosano favorecieron la emisión de hojas en las plantas, aunque sin diferencias significativas con CI. Las concentraciones mayores (500 y 1000 mg L-1) de quitosano estimularon el diámetro del tallo de las plantas, con incrementos entre un 10 y 16 %, con respecto a los controles CA y CI; así como la masa seca radical, que se diferenció solo del CA, con incrementos de aproximadamente 44 % (Tabla 4).
La longitud del tallo fue estimulada con las concentraciones 100 y 500 mg L-1, con diferencias de la concentración menor (1 mg L-1) asperjada y el CA. Similar resultado fue encontrado en la longitud radical, pero con las concentraciones 100 y 1000 mg L-1 (Tabla 1). Sin embargo, todas las concentraciones del quitosano aplicadas por aspersión foliar estimularon la masa seca de la parte aérea, entre 48,96 y 23,06 %, con relación a los controles CA y CI. La concentración de 1000 mg L-1 fue quién más se destacó en incrementar este indicador (Tabla 4).
Las concentraciones mayores de quitosano favorecieron el área foliar de soya, específicamente, la concentración de 500 mg L-1 que elevó la variable en un 49,24 %, diferenciándose de 1 mg L-1 y de los dos controles (Tabla 4).
El quitosano aplicado por aspersión foliar benefició la respuesta morfoagronómica de la soya inoculada con B. japonicum. La mayor respuesta estimuladora del crecimiento de las plantas se tuvo con las concentraciones de 100 a 1000 mg L-1 de quitosano, fundamentalmente, en el diámetro del tallo, la biomasa seca y el área foliar.
DISCUSIÓN
En este trabajo se evaluó el efecto de diferentes concentraciones de un polímero de quitosano en la nodulación, la actividad enzimática nitrato reductasa foliar, la concentración de macro y oligoelementos en nódulos y terceros trifoliolos y el contenido de clorofilas; así como el crecimiento vegetativo de soya cv IS-27 inoculada con Bradyrhizobium elkanii, en condiciones de cámara de crecimiento. En los procesos antes mencionados, se observó un efecto beneficioso de la aplicación foliar del polímero (fases V1 y V2) en la mayoría de las variables analizadas en la fase V4 de las plantas (Figuras 1 y 2, Tablas 1, 2, 3 y 4).
Las distintas concentraciones de quitosano aplicadas por aspersión foliar en soya inoculada con B. elkanii, influyeron positivamente en la nodulación de las plantas, con los mayores incrementos en el número y la masa seca nodular, respecto a las plantas que solo se inocularon, con las concentraciones 10, 50 y 500 mg L-1 del polímero (Figura 1 A y B). El incremento de ambas variables se traduce en un mayor contenido de bacteroides, lo que incrementaría la tasa de fijación del nitrógeno 16. Estos resultados confirman lo obtenido por otros autores en el número de nódulos y la actividad de reducción de acetileno (ARA) en soya, mediante otras formas de aplicación de compuestos de quitosano, en concentraciones de 40, 50 y 1000 mg L-1 (17-19.
Por otra parte, varios trabajos en leguminosas informan el efecto beneficioso de la inoculación con biofertilizantes respecto a las plantas que no han sido inoculadas 20-23, lo que es consistente con los resultados obtenidos en este estudio. Las plantas que no se inocularon apenas nodularon, lo que demuestra la efectividad de la cepa de Bradyrhizobium, la concentración celular y dosis del inóculo utilizado, respecto a la población residente de bradyrizobios en el suelo empleado (Figura 1). Esto corrobora lo informado por otros autores 23,24.
Las plantas de los distintos tratamientos inoculados presentaron un número de nódulos adecuados para la etapa vegetativa, de tamaño uniforme y se localizaron, fundamentalmente, en la corona y en la raíz principal de las plantas (Figura 1 A y B), lo que se atribuye a una efectividad de la inoculación. Esto se corroboró con el 100 % de nódulos efectivos encontrados en todos los tratamientos. Algunos autores plantean que la ocurrencia y distribución de los nódulos en las plantas hospederas dependen del desarrollo radical, de las condiciones del suelo y de la especie de leguminosa. En el caso de la soya, los nódulos se ubican mayoritariamente en la raíz principal 25,26. A partir de lo informado por estos autores, el incremento del número de nódulos en el presente estudio, quizás sea resultado del aumento del desarrollo radical por la inoculación de las plantas y a las condiciones favorables del suelo.
La actividad enzimática Nitrato reductasa (NR) puede presentarse en diferentes órganos y proporciona una estimación del contenido de N en la planta y, muy a menudo, se correlaciona con su crecimiento y rendimiento 27,28. En el trabajo, la inoculación de las semillas con B. elkanii causó aumentos de la actividad NR en las hojas como se ha demostrado para este cultivo y otras leguminosas inoculadas con Bradyrhizobium29,30. Los mayores valores de NR se alcanzaron en la fase V2, que luego disminuyeron en V3-V4, inclusive, muy inferiores a los obtenidos en V1 (Tabla 1). Esto pudo deberse a que en esta última fase el aporte de N está más relacionado con la fijación del nitrógeno simbiótico 31.
Por su parte, la aspersión foliar del quitosano estimuló la enzima NR en soya, en dependencia de la concentración empleada. Aumentos de la actividad enzimática se han informado por investigadores 32,33 en diversos cultivos, que dependieron de la concentración y la especie vegetal tratada, con la aspersión foliar de las concentraciones de quitosano evaluadas en nuestro trabajo. Las concentraciones 10 y 50 mg L-1 de quitosano en este trabajo, favorecieron el número y la masa seca de los nódulos formados, pero redujeron la actividad NR en hojas durante la etapa V3-V4 de crecimiento de la soya. Sin embargo, en esta etapa, la actividad NR se benefició con las distintas concentraciones de quitosano a partir de 10 mg L-1, en menor medida 1000 mg L-1, con relación a las plantas controles (Tabla 1). Lo anterior demuestra que el aporte de N con las concentraciones más bajas de quitosano pudo deberse más al proceso de fijación biológica del nitrógeno, mientras que con las concentraciones medianas pudo estar más relacionado a la actividad NR.
Es sabido que las plantas inoculadas con Bradyrhizobium favorecen el estado nutricional de la soya en relación a las plantas que no se inoculan 23,34 porque activan cambios metabólicos en la planta, específicamente el incremento del contenido de proteínas, nitrógeno y otros nutrientes 35, lo cual se traduce en una mejora del rendimiento de las leguminosas y ha sido explotado en la agricultura durante años. El efecto que algunos autores le atribuyen a la inoculación es constatado en el trabajo, con los incrementos de la concentración de magnesio, manganeso y sodio en nódulos; así como también, nitrógeno y magnesio en hojas, respecto a las plantas no inoculadas (Tablas 2 y 3). Estos nutrientes minerales influyen en el desarrollo nodular, en la FBN y en el crecimiento de las plantas, en cantidades, momentos y modos diferentes 36,37.
A su vez, las concentraciones más bajas de quitosano también estimularon la concentración de algunos nutrientes, fundamentalmente los oligoelementos (Tablas 2 y 3), que coincidieron en estimular la formación y la masa seca de los nódulos en las raíces de soya, lo que sugiere que dichas concentraciones favorecieron el proceso simbiótico del cultivo. Este planteamiento es motivo de futuras investigaciones para dilucidar el posible mecanismo de estimulación del quitosano. Similares resultados de incrementos del contenido de nutrientes en leguminosas se han informados con la aplicación conjunta de quitosano y biofertilizantes a base de bacterias diazotróficas libres, con 40 % de incrementos en el contenido de nitrógeno en plantas de caupí (Vigna unguiculata) y maíz (Zea mays) 34,38. Se ha informado que el quitosano aumenta la disponibilidad y la absorción de nutrientes en plantas con otras formas de aplicación 5,19,39.
En este estudio, el fósforo se encontró en mayores concentraciones en los nódulos que en hojas (Tablas 2 y 3). Se ha comprobado que los nódulos son importantes sumideros de este nutriente porque se requiere para la interacción simbiótica, la nodulación y la fijación biológica del nitrógeno (FBN) 36. Estos procesos están fuertemente influenciados por la disponibilidad de fósforo en el suelo. Teniendo en cuenta lo anterior, la disponibilidad de fósforo en el suelo donde se crecieron las plantas de soya fue elevada (Tabla 1), lo que pudo favorecer su absorción por la planta.
Por su parte, el quitosano a la concentración de 1000 mg L-1 incrementó la concentración de nitrógeno en los nódulos, pero disminuyó la concentración de fósforo (Tabla 2), quizás como resultado del gasto energético que se requirió para mantener la FBN, la translocación de fotosintatos a las hojas desde los nódulos y su asimilación en este órgano.
Es conveniente destacar que el polímero también aumentó la concentración de calcio y manganeso en ambos órganos de soya (Tablas 2 y 3). Incrementos de estos nutrientes se han informado en pepino 40 y otros cultivos 41,42, con la aplicación de quitosano. El calcio actúa como un mensajero secundario en los procesos metabólicos relacionados con la morfogénesis, el desarrollo y la protección de las plantas ante estreses a (bióticos) 43. De igual modo, el manganeso induce la síntesis de poliamidas que son requeridas para el crecimiento de las plantas y la detoxicación de especies reactivas de oxígeno, principalmente en las etapas iniciales de la interacción simbiótica 36.
En hojas de diferentes especies de plantas se ha comprobado una mejora en la eficiencia de la utilización de la luz, la estabilidad de las clorofilas e incrementos en el diámetro de los cloroplastos con la aplicación de quitosano 5. También, Hasanah & Sembiring 44 informaron incrementos de las clorofilas y la densidad estomática, en hojas de soya con la aplicación previa de quitosano. Además, según Soundararajan 45, existe una relación positiva entre el contenido de clorofilas y la asimilación del carbono en soya, cómo resultado de un incremento lineal de la tasa fotosintética y de la actividad de las enzimas Gliceraldehido-3-fosfato deshidrogenasa (GAPDH) y Ribulosa-bifosfato carboxilasa (Rubisco).
Por lo anterior, el aumento del contenido relativo de clorofilas en los trifoliolos entre 6 y 8 %, con las concentraciones entre 10 y 500 mg L-1 de quitosano respecto al control absoluto (CA), y del área foliar hasta el 49 % (500 mg L-1), debe favorecer una mayor fotosíntesis de las plantas y por ende, la disponibilidad de azúcares para la síntesis de nuevos asimilados, lo que puede ser una ventaja agroproductiva de las plantas asperjadas con el polímero. La soya, como típica planta C3 es más dependiente de la función dual de la enzima Rubisco, por lo que los tratamientos con quitosano deben desplazar el equilibrio fotosíntesis-respiración en favor del primer proceso y por tanto hacia un mejor crecimiento vegetativo, lo cual se demuestra con la ganancia de una mayor masa seca aérea y radical en las plantas de este trabajo con determinadas concentraciones.
Aunque no se conoce totalmente el mecanismo de acción a través del cual el quitosano aumenta el crecimiento y la productividad de los cultivos, si se ha informado un efecto antitranspirante cuando se aplica por aspersión foliar 42. El quitosano causa el cierre estomático en las hojas 46 y evita la pérdida de agua por transpiración (efecto antitranspirante), lo cual reduce el consumo de agua por la planta y regula su disponibilidad para los distintos procesos de la planta, siendo esto esencial en plantas C3 en beneficio de la fotosíntesis. A lo anterior se le debe adicionar el incremento encontrado, con la aplicación de quitosano, en el contenido de algunos nutrientes esenciales relacionados con el desarrollo vegetativo como el calcio, hierro y manganeso.
El quitosano estimuló las variables morfoagronómicas, el contenido relativo de clorofilas y el desarrollo radicular, fundamentalmente, a las concentraciones de 100 a 1000 mg L-1, específicamente, la aplicación 500 mg -1 de quitosano mejoró el número de hojas en un 19 %, la masa seca aérea en más de un 40 %, la masa seca radical y el área foliar en un 55 %. Estos resultados confirman lo obtenido por otros autores, con la aspersión foliar de quitosano en leguminosas y otras especies de plantas 22,23,47,48. Sin embargo, la sola inoculación con el simbionte mejoró el comportamiento general de las plantas, la concentración de nitrógeno foliar (40 %), el número de hojas (10 %) y la masa seca aérea (21 %).
En consecuencia, y a partir de los resultados obtenidos, el efecto en el crecimiento de las plantas de soya, encontrado en este trabajo, se debió a un aumento en el contenido de nutrientes disponibles en la planta, tanto como resultado de la inoculación con Bradyrhizobium como por la aplicación adicional de quitosano que en dependencia de la concentración empleada, mejoró la fijación biológica del N y la actividad de la enzima NR más allá del efecto de la inoculación, lo que potencialmente mejora el contenido proteico y de compuestos nitrogenados del que dispone la planta para su crecimiento. A lo anterior, debe añadirse una mejora en el proceso fotosintético de las plantas evaluadas. Es por ello que los estudios futuros en este tema deben estar encaminados a conocer cómo se comportan ambas formas de entrada y transporte de nitrógeno en soya, en diferentes órganos (nódulos, raíz y hojas) y dinámicas de tiempo, cuando se aplica quitosano por aspersión foliar, y se inocula con Bradyrhizobium, para dilucidar el aporte de cada vía al crecimiento y la productividad de IS-27 y en indicadores relacionados con la fotosíntesis.
Teniendo en cuenta los resultados alcanzados en la nodulación, la fisiología y el crecimiento vegetativo de las plantas inoculadas con Bradyrhizobium y asperjadas foliarmente con quitosano, estos pudieran repercutir en el incremento de los rendimientos de soya cv IS-27, algo por demostrar a escala productiva. En tal dirección se demostró que existe una correlación positiva entre las clorofilas (0,85) y área foliar (0,743) con la tasa fotosintética de plantas de soya en la etapa V4 de crecimiento y de esta, a su vez, con el rendimiento del cultivo 49.
CONCLUSIONES
La aspersión foliar de quitosano en las etapas V1 y V2 del cultivar IS-27 estimuló la nodulación, la concentración de macronutrientes y oligoelementos en nódulos y hojas de las plantas y el crecimiento de soya inoculada con B. elkanii, en condiciones controladas hasta la etapa V4, en dependencia de la concentración del polímero.
La actividad enzimática Nitrato reductasa foliar en las etapas V2 y V3 se incrementó con la aplicación de las concentraciones de 10 a 500 mg L-1 de quitosano, que también, aumentó el contenido de clorofilas totales. A su vez, las plantas solo inoculadas con Bradyrhizobium elkanii favorecieron la actividad de la nitrato reductasa de las plantas de soya hasta la etapa V3, en relación a las plantas que no se inocularon.











 text in
text in 


