My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Medicina Tropical
On-line version ISSN 1561-3054
Rev Cubana Med Trop vol.49 no.2 Ciudad de la Habana May-Aug. 1997
Instituto de Medicina Tropical "Pedro Kourí"
Normalización de técnicas inmunohistoquímicas para la detección de antígenos del virus dengue en tejidos embebidos en parafina
Lic. JOSÉ LUIS PELEGRINO,1 Dr. ERNESTO ARTEAGA,2 Lic. ANAR J. RODRÍGUEZ,3 Lic. EFRAÍN GONZÁLEZ,4 Téc. MARÍA DEL C. FRONTELA5 y Dra. MARÍA GUADALUPE GUZMÁN6
- Master in Sciences. Investigador Agregado.
- Especialista de I Grado en Anatomía Patológica.
- Aspirante a Investigador.
- Tecnológo en Anatomía Patológica.
- Técnico en Anatomía Patológica.
- Especialista de II Grado en Microbiología.
RESUMEN
Las técnicas inmunohistoquímicas (IHQ) pueden ser de gran utilidad para la detección de antígenos del virus del dengue en tejidos infectados. En este trabajo se muestran los resultados obtenidos con el empleo de 2 métodos IHQ: uno directo y otro indirecto amplificado con un anticuerpo universal biotinilado y un sistema estreptavidina peroxidasa (LSAB) (en ambos se utiliza la enzima peroxidasa). Estos métodos fueron aplicados en tejidos embebidos en parafina procedentes de ratones inoculados intracerebralmente con el virus del dengue. El objetivo es contar con una técnica en el laboratorio que permita identificar estos antígenos en los tejidos para ser aplicados en el diagnóstico y los estudios relacionados con la obtención de inmunógenos.
Descriptores DeCS: INMUNOHISTOQUIMICA/normas; ANTIGENOS VIRALES; VIRUS DEL DENGUE/inmunología; ADHESION EN PARAFINA; CEREBRO/virología; RATONES.
El dengue, en la actualidad, es la arbovirosis que produce mayores tasa de morbilidad y mortalidad en el mundo. El agente causal es un grupo de virus denominado con el mismo nombre, perteneciente a la familia Flaviviridae, género Flavivirus y constituye un complejo antigénico de 4 serotipos: dengue 1, dengue 2, dengue 3 y dengue 4. Éstos son transmitidos por mosquitos del género Aedes los vectores más importantes son: Aedes aegypti y Aedes albopictus. Clínicamente la infección puede manifestarse como fiebre indiferenciada, dengue clásico (DC) o fiebre hemorrágica del dengue (FHD), que puede derivar en síndrome de choque por dengue (SCD).2
Millones de personas contraen anualmente la infección por el virus dengue en numerosos países de Asia, África, islas del Pacífico y las Américas. Las epidemias de FHD/SCD ocurren, fundamentalmente, en el sureste asiático, donde afectan con preferencia a los niños. En la actualidad, en las Américas, el dengue se ha convertido en un grave problema de salud, dada la actividad endémico-epidémica asociada con los 4 serotipos del virus y la aparición de la fiebre hemorrágica.
El virus dengue se replica en el tejido linfoide y principalmente en células fagocíticas.3 Los estudios en humanos con FHD/SCD han demostrado la presencia del virus en monocitos y linfocitos de la sangre periférica. En el timo y en las áreas de linfocitos T de los ganglios linfáticos y el bazo, se puede observar una marcada linfocitosis o pérdida de linfocitos. En las áreas de los linfocitos B en los ganglios linfáticos y el bazo se observa proliferación de linfocitos y necrosis de los centros germinales.4 El hígado muestra necrosis focal, cuerpos de Councilman y hialinización de las células Kupffer. El compromiso de las glándulas suprarrenales es raro. En el riñón se han encontrado cambios proliferativos ligeros en relación con inmunocomplejos.5 Los cambios de la médula ósea incluyen detención de la maduración de los megacariocitos.6 Los cambios histopatológicos significativos son encontrados, fundamentalmente, en 3 sistemas de órganos principales: el hígado, el sistema reticuloendotelial y el sistema vascular.7
A pesar de que el virus se replica in vitro en células endoteliales humanas, no hay evidencias in vivo de la presencia del antígeno viral en las células del endotelio vascular.4 Cepas neuroadaptadas del virus dengue producen lesiones encefálicas típicas, predominantemente en el rinencéfalo de ratones jóvenes, lactantes y adultos. El antígeno viral es detectable por inmunofluorescencia en células reticuloendoteliales del hígado, los ganglios linfáticos y el bazo de ratones inoculados intraperitonealmente. Los ratones atímicos inoculados periféricamente con cepas de dengue adaptadas desarrollan una encefalitis fatal, y el antígeno viral se detecta en las neuronas, el músculo esquelético, el miocardio y las células Kupffer.
Los mecanismos patogénicos en las enfermedades producidas por el virus del dengue son difíciles de dilucidar por la ausencia de un modelo animal, la fragilidad de los vasos sanguíneos en los pacientes muy enfermos y la falta de lesiones patognomónicas severas en la autopsia.
La sospecha clínica del dengue se confirma en el laboratorio por aislamiento, serología y pruebas moleculares. Sin embargo, a veces la deficiente conservación de las muestras en su traslado a los centros de referencia o la muerte del paciente antes de la toma del suero de convalescencia impiden la realización de dichas pruebas. De ahí que la demostración de los antígenos del dengue en los tejidos de pacientes fallecidos, en especial en aquellos casos en los que se carece de otras pruebas para confirmar la causa viral, constituye una necesidad frecuente en nuestro medio.
Con el objetivo de detectar histológicamente antígenos, tanto virales como microbianos, se han empleado las técnicas inmunohistoquímicas. Éstos han jugado una importante función en la identificación de los agentes de muchas enfermedades infecciosas en secciones de tejidos, dada la disponibilidad y especificidad de los anticuerpos reactivos, la gran sensibilidad de los métodos y lo relativamente fácil del montaje de las técnicas, tanto para el diagnóstico como con propósitos investigativos.8 En nuestro trabajo nos planteamos la normalización de un método que permitiera la identificación de los antígenos de estos virus en tejidos parafinados para estos fines, con el uso de enzima, peroxidasa. Estas técnicas constituyen procedimientos sencillos, rápidos y económicos, los cuales pueden ser utilizados en el diagnóstico retrospectivo.
MÉTODOS
ANIMALES DE EXPERIMENTACIÓN Y CEPAS VIRALES EMPLEADAS EN LA NORMALIZACIÓN
Se utilizaron para el estudio ratones lactantes albinos suizos (OF1), de 24 a 48 h de nacidos, los cuales se dividieron en 2 grupos: A y B. Éstos fueron inoculados por vía intracerebral con una suspensión al 20 % peso/volumen con 20 mL de dengue 2 cepa A15 15 PR (procedente de un aislamiento de un paciente de dengue clásico de la epidemia de FHD en Cuba en 1981) y solución tampón fosfatada (PBS= phosfatase buffer solution), respectivamente. Los ratones fueron observados hasta la aparición de los síntomas posinoculación en los primeros, el grupo B (control) fue recogido también en ese momento. Posteriormente se sacrificaron mediante inhalación de éter y se extrajeron los cerebros.
PROCESAMIENTO DE LAS MUESTRAS
Los cerebros de los ratones fueron fijados en formaldehído al 10 % tamponado, por un período de 12 a 24 h. Luego fueron tratados en el procesador automático de tejidos Histokinette SAKURA Modelo VRX-23. El tiempo de procesamiento total fue de 12 h, 1 h para cada uno de los siguientes pasos: etanol al 70 %, etanol al 80 %, etanol al 95 % (2 pases), etanol absoluto (2 pases), xilol (3 pases) y parafina (3 pases). Posteriormente se hizo la inclusión en un bloque de parafina, de los que se obtuvieron secciones de 4 y 6 m por medio de un micrótomo horizontal LEICA. Los cortes se extendieron sobre láminas tratadas con Cromagel.
ANTICUERPOS ANTIDENGUE
Se utilizaron 2 tipo de anticuerpos, ambos preparados en nuestro laboratorio:
- Inmunoglobulinas policlonales humanas antidengue, preparadas a partir de varios sueros humanos procedentes de individuos con una infección secundaria a dengue, con títulos mayores de 1/1 280 por inhibición de la hemaglutinación, las cuales fueron precipitadas con sulfato de amonio y conjugadas por el método del peryodato,9 en el Laboratorio de Producción de Antígenos del Instituto de Medicina Tropical "Pedro Kourí" (IPK).
Anticuerpo monoclonal H3-6, producido en ratón contra complejo dengue en el Laboratorio de Anticuerpos Monoclonales del IPK, dirigido a un antígeno común a los 4 serotipos presente en la envoltura del virus.
FLUJO DE TRABAJO DIRECTO
Antes de comenzar el trabajo fue necesario someter los cortes de tejidos a los procesos siguientes:
- Desparafinación: se efectuó con xilol en 3 pasos: una inmersión durante 30 min a 60 °C y 2 inmersiones durante 15 min a temperatura ambiente.
- Rehidratación: las láminas fueron sumergidas en etanol absoluto por 10 min (2 veces) y en etanol al 90 % por 10 min (2 veces) también. Posteriormente se lavaron 3 veces con agua destilada.
Tratamiento con tripsina: Las láminas fueron divididas en 2 grupos, unas fueron sometidas a digestión enzimática y otras no. Se empleó tripsina (SIGMA) pH 7,8 al 0,1 % y 0,1 % de cloruro de calcio (BDH). Se incubó a 37 °C durante 20 min. Las láminas se lavaron 3 veces, 1 con agua destilada y 2 con PBS, pH 7,4.
Bloqueo: Se utilizaron cortes de tejidos de ratones inoculados con el virus y de ratones control, los cuales fueron bloqueados para inhibir la peroxidasa endógena con 90 mL de metanol (Riedel de Haen), 5 mL de agua destilada y 5 mL de peróxido de hidrógeno al 30 % (SIGMA). Se incubaron 20 min a temperatura ambiente. Las láminas se lavaron 3 veces con PBS y se secó el exceso de éste. Se goteó posteriormente suero de carnero diluido 1/100 y se incubó por 1 h en cámara húmeda a temperatura ambiente.
Anticuerpo: El tejido fue cubierto con el anticuerpo policlonal diluido 1/100 en PBS con 10 % de suero de carnero. Las láminas se dividieron en 2 grupos: unas fueron incubadas por 1 h en cámara húmeda a temperatura ambiente, y las otras fueron incubadas toda la noche en cámara húmeda a 4 °C.
La experiencia fue repetida con las siguientes diluciones del anticuerpo policlonal: 1/50, 1/100 y 1/200, en PBS con 10 % de suero de carnero. Las láminas se incubaron toda la noche a 4°C en cámara húmeda.
Revelado: Las láminas se lavaron con PBS 3 veces y se secaron. El revelado se realizó
con solución compuesta por 6 mg de 3.31 -diaminobenzidina (DAB) (SIGMA), 10 mL de PBS y 10 mL de peróxido de hidrógeno al 30 % (SIGMA). La oxidación de la DAB permite la visualización de gránulos de color pardo carmelitoso10. La reacción se detuvo antes de los 6 min con agua corriente. Se aplicó el colorante de contraste hematoxilina de Mayer, preparada con reactivos MERCK11 durante 5 min, después de los cuales se lavaron las secciones con agua corriente, se deshidrataron con etanol, se aclararon con xilol y se montaron con Bálsamo de Canadá, para ser observadas posteriormente al microscopio óptico de campo claro (OLIMPUS BH-2).
MONTAJE DEL MÉTODO INDIRECTO LSAB
En este procedimiento, conocido como método LSAB, el anticuerpo marcado con biotina y la enzima marcada con avidina son usados secuencialmente.12
Se aplicó el bloqueador de peroxidasa endógena por 20 min a temperatura ambiente. Las láminas fueron lavadas con PBS 3 veces y el exceso de líquido secado.
Como anticuerpo primario fue empleado el anticuerpo monoclonal (H3-6). La incubación fue 30 min en cámara húmeda a temperatura ambiente. Las diluciones del anticuerpo monoclonal fueron: 1/1 000, 1/1 250, 1/1 500, 1/1 750, 1/2 000, 1/3 000 y 1/4 000 en PBS. Posterior a la incubación se lavaron las láminas y se secaron. Se puso un control negativo con PBS en lugar del anticuerpo primario y también un control negativo con anticuerpo anti-Toxoplasma gondii obtenido en conejo.
Se empleó un kit comercial (Large Volumen Dako LSAB + Kit, Peroxidase, K0690), que consta de 2 reactivos: un anticuerpo secundario marcado con biotina, contra inmunoglobulina de conejo, ratón y cabra (universal) y un complejo estreptavidina-peroxidasa de rábano picante. El primer reactivo se goteó sobre el tejido hasta cubrirlo. Se incubó en cámara húmeda a temperatura ambiente durante 15 min. Se lavaron las láminas 3 veces con PBS. Posteriormente se aplicó el segundo reactivo y se incubó en iguales condiciones por 15 min. Se hicieron 3 lavados con PBS.
Se procedió al revelado con DAB, el contraste con hematoxilina y la observación microscópica. Para la observación se utilizó el microscopio (OLIMPUS BH-2) con magnificación panorámica de 40X para la identificación de inmunorreactividad, 100X para definir grados de intensidad de la reacción en las muestras con diferentes técnicas y diluciones y 400X para la caracterización morfológica de los precipitados. En muchos casos se utilizó también el objetivo de inmersión.
RESULTADOS
RESULTADOS OBTENIDOS CON EL MÉTODO DIRECTO EN TEJIDOS PARAFINADOS
Se emplearon láminas de cerebros inoculados con el virus y de cerebros de ratones control. De las primeras, algunas se incubaron con el anticuerpo policlonal diluido 1/100 1h y otras, toda la noche. En las láminas positivas que se incubaron 1h se observó una posibilidad tenue, y en las láminas positivas que se incubaron toda la noche se observó una positividad intensa. En ambos casos los controles fueron negativos.
La experiencia se repitió y se utilizaron láminas para cada una de las siguientes diluciones: 1/50, 1/100, 1/200, las que fueron incubadas durante toda la noche, se obtuvo una reacción positiva: muy intensa, intensa y moderada, respectivamente.
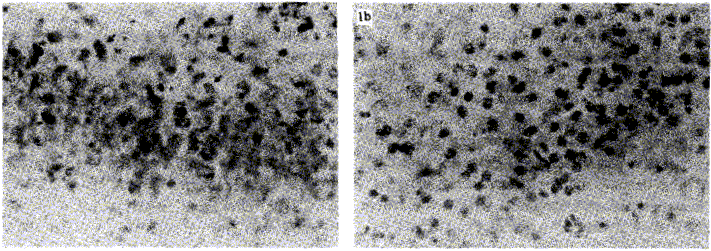
En la figura 1a se observa la inmunorreactividad citoplasmática en tejidos infectados por el virus del dengue. Por otra parte, la ausencia de inmunorreacción en una lámina con tejido cerebral de ratones control, se muestra en la figura 1b.
FIGURA 1. Método directo de inmunoperoxidasa en tejido cerebral de ratón 400X. a) Inmunorreactividad citoplasmática en tejidos infectados por el virus del dengue. b) Ausencia de inmunorreactividad en tejidos no infectados.
Algunas láminas de cada grupo fueron tratadas con tripsina. Tanto en los tejidos tripsinizados como en los no tripsinizados se probaron las diluciones del anticuerpo policlonal conjugado 1/50, 1/100, 1/200, la incubación se realizó durante toda la noche. Para los primeros se obtuvo una positividad muy intensa con la dilución 1/50 e intensa con las diluciones 1/100 y 1/200, y para los segundos, una positividad valorada como moderada para 1/50 y 1/100 y tenue para 1/200. Los controles fueron negativos al virus del dengue.
RESULTADOS OBTENIDOS CON EL MÉTODO LSAB EN TEJIDOS PARAFINADOS
En esta técnica se emplearon láminas con cortes de tejido cerebral infectado con el virus del dengue. Se probaron las siguientes diluciones del anticuerpo monoclonal: 1/1 000, 1/1 250, 1/1 500, 1/1 750, 1/2 000, 1/3 000 y 1/4 000, se obtuvo una inmunorreactividad positiva: intensa, muy intensa, intensa, intensa, moderada, tenue y nula, respectivamente.
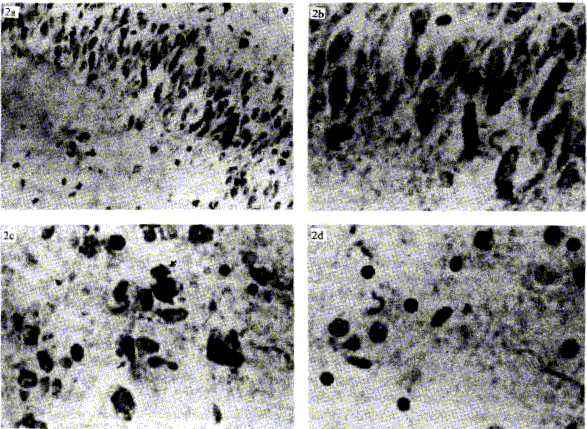
En las figuras 2a y 2b se pueden observar los depósitos citoplasmáticos de los complejos antígeno-anticuerpo en las neuronas de hipocampo, a los aumentos 400X y 1 000X, y en la figura 2c se observa la inmunorreactividad en las neuronas corticales. Se utilizaron como controles una lámina positiva cubierta con PBS en lugar del anticuerpo primario, y otra cubierta con anticuerpo anti-Toxoplasma gondii, en las cuales no se observó reacción positiva (figura 2d). No obstante a las altas diluciones empleadas: 1/1 000, 1/1 250, 1/1 500 y 1/1 750, se observa una ligera tinción de fondo.
FIGURA 2. Método indirecto de inmunoperoxidasa con avidina-biotina en cortes de tejido cerebral de ratón embebido en parafina. a) Depósitos citoplasmáticos granulares de los complejos antígeno-anticuerpo en las neuronas de hipocampo en los ratones infectados por el virus del dengue, 400X. b) Gran magnificación de la figura 1a, 1 000X. c) Inmunorreactividad en las neuronas corticales, 1 000X. d) Control negativo utilizando un anticuerpo primario anti-Toxoplasma gondii.
Los resultados obtenidos mediante el empleo de ambos métodos, directo e indirecto (que se explicaron de forma detallada) se sintetizan en la tabla.
TABLA. Resultados más relevantes obtenidos con los métodos directos e indirectos de la técnica inmunoperoxidasa. T:Digestión con tripsina: ++++ Muy intensa. +++: Intensa. ++ Moderada. + Tenue, 0: Nula.
| Método de coloración | Dilución | Intensidad de la reacción |
| Directo | 1/50 | ++++ |
| en tejidos | 1/100 | +++ |
| congelados | 1/200 | ++ |
|
| 1/50 | ++ |
| 1/100 | ++ |
|
| Directo | 1/200 | + |
| en tejidos | 1/50 (T) | ++++ |
| parafinados | 1/100 (T) | +++ |
| 1/200 (T) | +++ |
|
| 1/1 000 | +++ |
|
| 1/1 250 | ++++ |
|
| Indirecto | 1/1 500 | +++ |
| en tejidos | 1/1 750 | +++ |
| parafinados | 1/2 000 | ++ |
| 1/3 000 | + |
|
| 1/4 000 | 0 |
|
DISCUSIÓN
La presencia de antígenos del virus del dengue fue demostrada en los cerebros de ratones inoculados con el virus, mediante la observación microscópica de inmunoprecipitados citoplasmáticos de color pardo oscuro en las neuronas. Se obtuvo un buen contraste entre el tejido de fondo, teñido con hematoxilina de Mayer y las células con marcaje de antígenos.
En el cerebro de ratón o en los hematíes pueden existir alguna reacción inespecífica de fondo. Por esta razón, y para evitar los resultados falsos positivos, se corrieron conjuntamente controles negativos de cerebros de ratones inoculados con PBS o de cerebros de ratones inoculados con virus del dengue que no fueron cubiertos con anticuerpo primario.
Los diferentes ensayos de las técnicas inmunohistoquímicas que se realizaron, permitieron hallar las mejores diluciones de los anticuerpos y los tiempos de incubación más eficientes, así como la necesidad de utilizar procedimientos de digestión enzimática previos. La selección de los parámetros adecuados se basó en la nitidez de las láminas, un resultado positivo bien definido y un contraste claro entre los positivos y los controles.
Esta experiencia indica que el tiempo de incubación con el anticuerpo primario óptico, es durante toda la noche, 1 h de incubación es ineficiente, por falta de reconocimiento específico de los antígenos virales por parte de las inmunoglobulinas policlonales. Esto evidencia que una mayor exposición del anticuerpo frente al antígeno es proporcional a la intensidad de la reacción.
Además, se determinó que la dilución del anticuerpo que permite una mayor inmunorreactividad positiva para el método directo es 1/50, ésta es una dilución bastante baja si la comparamos con la necesaria para obtener una positividad intensa en la técnica indirecta.
Por otra parte, la tripsinización resultó ser necesaria en el método directo. La tripsina, al igual que otras enzimas proteolíticas, puede utilizarse para potenciar la reacción inmunohistoquímica, porque desenmascara los antígenos virales e incrementa el contraste entre la reacción específica y la coloración inespecífica de fondo.10
En el método indirecto LSAB se observó que la dilución del anticuerpo monoclonal, que permitió la visualización de una positividad muy intensa, fue 1/1 250. Constituyendo un sistema amplificador de la inmunorreactividad, capaz de detectar antígenos virales del dengue en la utilización de diluciones muy altas del anticuerpo primario. Además, requiere un tiempo de incubación con el anticuerpo primario de apenas 30 min, mucho menor que el necesario en el método directo.
Por otra parte, se comprobó la especificidad del método mediante la ausencia de reacción al aplicar el anticuerpo antiToxoplasma gondii, en lugar del anticuerpo monoclonal anticomplejo dengue. La ligera tinción de fondo que se observa puede deberse a interacciones de reactivos empleados con componentes inespecíficos de tejido.
Cada año se notifican millones de casos de personas infectadas por el virus del dengue, de las cuales centenares de miles desarrollan las formas más graves de la enfermedad, FHD y SCD. En las Américas se han registrado 2 epidemias importantes de ambas formas: la primera en Cuba, durante 1981, y la segunda en Venezuela entre 1989 y 1990. Actualmente la enfermedad se ha venido propagando a otros países de la región.2 Recientemente, otros países del Caribe, Centro y Suramérica han reconocido casos de FHD/SCD; sin embargo, hay una subnotificación debido, principalmente, a problemas relacionados con el diagnóstico clínico y de laboratorio.4
Dada la situación epidemiológica que exhibe esta enfermedad, se hace necesario disponer de pruebas diagnósticas que permitan emprender a tiempo las medidas de control y prevención.
Puesto que la letalidad de los pacientes de FHD/SCD hospitalizados, puede ser hasta de 5 %,2 hay casos en que el diagnóstico no puede hacerse mediante serología, por haberse producido la muerte del paciente y no disponerse del suero de convalecencia, a lo que se suma, a veces, el fracaso del aislamiento viral. En ellos sólo queda la opción del diagnóstico retrospectivo, en el que las técnicas inmunohistoquímicas gozan de gran aceptación.
Nuestros resultados son satisfactorios, y su aplicación a muestras humanas es factible, si se comparan con los obtenidos por Hall y otros en la demostración de antígenos del virus del dengue y del virus de la fiebre amarilla en tejidos embebidos en parafina.13 Otros autores han demostrado diferentes antígenos virales en tejidos, como los resultados obtenidos por Ricaurte y otros con fiebre amarilla,14 Sarmiento y otros,15 Faran y otros en la detección de antígenos del virus de la fiebre del Valle de Rift en secciones parafinadas de mosquitos transmisores,16 y en la determinación de los niveles séricos de inmunoglobulina A contra el antígeno de la cápside viral del virus Epstein-Barr.17 Muchos de estos autores utilizan diferentes variantes del método de la avidina-biotina como sistema amplificador de la reacción.
También las técnicas avidina-biotina se han utilizado en la detección de otros agentes no virales como Mycoplasma pulmonis en tejidos parafinados, y han mostrado una alta sensibilidad.18 Incluso, Milios y Leong demostraron que la técnica avidina-biotina peroxidasa puede detectar una gran variedad de antígenos en secciones histológicas estándar de tejidos normales y morbosos previamente teñidos con hematoxilina y eosina, sin reducción detectable de la sensibilidad.19
En el trabajo se normalizaron 2 métodos (directo e indirecto) de la técnica inmunohistoquímica que utiliza la enzima peroxidasa. Esto permite realizar estudios sobre la patogénesis del virus del dengue, para el diagnóstico de la enfermedad cuando se utilice el ratón como sistema de aislamiento y para el estudio de vacunas. Por otro lado, los métodos empleados ofrecen la posibilidad de ser utilizados en muestras de tejido humano.
SUMMARY
The immunohistochemical techniques may be very useful for the detection of antigens of the dengue virus in infected tissues. The results obtained with the use of 2 IHC methods: one direct and another indirect amplified with a biotin universal antibody and a streptavidin peroxidase system (LSAB) (the peroxidase enzyme is used in both) are shown in this paper. These methods were applied on paraffin-embedded tissues from mice that were inoculated with the dengue virus intracerebrally. Our objective is to have a technique at the laboratory allowing to identify these antigens in the tissues in order to apply them on the diagnosis and on the studies connected with the obtention of immunogens.
Subject headings: IMMNUNOHISTOCHEMISTRY/standards; ANTIGENS, VIRAL; DENGUE VIRUS/immunology; PARAFFIN EMBEDDING; BRAIN/virology; MICE.
REFERENCIAS BIBLIOGRÁFICAS
- Kurane I, Mady BJ, Ennis FA. Antibody-dependent enhancement of dengue virus infection. Rev Med Virol 1991;1:211-21.
- Organización Panamericana de la Salud. Alternativas para la prevención y control del dengue y del dengue hemorrágico en los países de Centroamérica. Washington: OPS/OMS, 1995:1-40.
- Guzmán MG. Dengue I: antecendentes históricos; agentes etiológicos, cuadro clínico. Rev Cubana Med Trop 1980; 3-2:123-30.
- Ramos C, García H, Villaseca JM. Fiebre hemorrágica y síndrome de choque por dengue. Salud Pública Mex 1993;35(1):39-55.
- Martínez E. Dengue hemorrágico en niños. Bogotá: Editorial INS, 1990:50-60.
- Monath TP. Flaviviruses. En: Field BN, Knipe DM, Chanock RM, Hirsch MS, Melnick JL, Monath TP, et al, eds. Virology. 2. ed. New York: Raven Press, 1990:763-814.
- Henchal EA, Putnak R. The Dengue viruses. Clin Microbiol Rev 1990;3:376-96.
- Bacchi CE, Grown AM, Bacchi MM. Detection of infectious disease agents in tissue by immunocytochemistry. Braz J Med Biol Res 1994;27(12):2803-20.
- Nakane PK. Recent progress in the peroxidase labelled antibody method. Ann NY Acad Sci 1975;254:203-10.
- Nadji M, Morales AR. Immunoperoxidase techniques: a practical approach to tumor diagnosis. Chicago: American Society of Clinical Pathologist P 1986:1-10.
- Luna LG, ed. Manual of histologic staining methods. 3 ed. New York: Mc Graw -Hill Book Company, 1968:12-20.
- Guesdon JL, Ternyrick T, Avramcas S. The use of avidin-biotin interaction in immunoenzymatics techniques. J Histochem Cytochem 1979;27:1131-9.
- Hall WC, Crowell TP, Watts DM, Barros VLR, Kruger H, Pinheiro F, et al. Demonstration of yellow fever and dengue antigens in formalin-fixed paraffin-embedded human liver by immunohistochemical analysis. Am J Trop Med Hyg 1991;45(4):408-17.
- Ricaurte O, Sarmiento L, Caldas ML, Rodríguez G, Altamar E. Evaluation of immunohistochemical method in yellow fever diagnosis. Informe del Grupo de Patologias. Bogotá: Editorial del Instituto Nacional de Salud, 1992:2-7.
- Sarmiento L, Rodríguez G, Boshell J. Diagnóstico immunohistoquímico del dengue en cortes de parafina. Biomédica 1995;15:10-5.
- Faran ME, Romoser WS, Routier RG, Bailey ChL. Use of the avidin-biotin-peroxidase complex immunocytochemical procedure for detection of Rift Valley fever virus in paraffin section of mosquitoes. Am J Trop Med Hyg 1986;35(5): 1061-7.
- Se Thoe SY, Sam CK, Cheng HM, Prasad U. Improved sensitivity of detection by avidin-biotin complex (ABC). Immunocytochemistry in Epstein-Barr virus serology. J Med Virol 1989;29:311-4.
- Brunnert SR, Dai Y, Kohn DF. Comparison of polymerase chain reaction and immunohistochemistry for the detection of Mycoplasma pulmonis in paraffin-embedded tissue. Lab Anim Sc 1994;44(3):257-60.
- Milios J, Leong ASY. The application of the avidin-biotin technique to previously stained histological sections. Stain Tech 1987;62(6):411-6.
Recibido: 27 de noviembre de 1996. Aprobado: 1 de marzo de 1997.
Lic. José Luis Pelegrino. Instituto de Medicina Tropical "Pedro Kourí". Apartado 601, Marianao 13, Ciudad de La Habana, Cuba.