My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Medicina Tropical
On-line version ISSN 1561-3054
Rev Cubana Med Trop vol.57 no.2 Ciudad de la Habana May-Aug. 2005
Instituto de Medicina Tropical Pedro Kourí
Estudio comparativo entre 2 conjugados para el diagnóstico por inmunofluorescencia directa de la rabia en Cuba
Dra. María de los A. Ribas Antúnez,1 Lic. Gretel Acosta Renom,2 Téc. Yahisel Tejero Suárez,3 Téc. Deneb García Martínez3 y Téc. Carina Rodríguez Valdez3
Resumen
Se realizó la comparación entre el conjugado de producción nacional elaborado por la empresa de productos biológicos Carlos J. Finlay, para el diagnóstico por inmunofluorescencia directa de la rabia, comparándolo con el conjugado antinucleocápside viral fabricado por BIORAD, que se comercializa al nivel internacional . Se estudiaron 150 muestras de cerebro de diferentes especies de animales recibidas en el Laboratorio de Referencia de Rabia del Instituto de Medicina Tropical Pedro Kourí durante los años 2000-2002. Al comparar ambos conjugados se obtuvieron valores de sensibilidad de 100 %, especificidad 94,3 % y concordancia 98 %. Los resultados discordantes fueron analizados mediante la reacción en cadena de la polimerasa y la prueba biológica en ratones.
Palabras clave : Rabia, inmunofluorescencia, conjugado.
En muchas áreas del mundo los conocimientos disponibles sobre la rabia son mínimos, lo que hace difícil poder apreciar todo el impacto que esta provoca sobre la salud humana y animal.
En Cuba se reportan anualmente aproximadamente 311 casos positivos de rabia en diferentes especies de animales y se ha producido en los últimos años un número limitado de muertes en humanos, asociadas a contactos con murciélagos. Para la confirmación de los casos positivos, el diagnóstico de laboratorio tiene un papel fundamental, porque junto a la vigilancia epidemiológica, ayuda a definir si se debe aplicar o no un tratamiento completo.
La técnica que actualmente se emplea en los laboratorios regionales del país es la inmunofluorescencia directa (IFD), esta se realiza a muestras de encéfalo de animales sospechosos de rabia y ha sido considerada en el nivel mundial como referencia para el diagnóstico.1
Se ha orientado, además, por el Comité de Expertos de Rabia, la realización de la prueba biológica (PB) para aislamiento viral u otro método diagnóstico de igual sensibilidad para estudiar casos que por IFD resulten negativos y que provengan de animales lesionadores altamente sospechosos de la enfermedad.2
El conjugado producido nacionalmente por la empresa de productos biológicos Carlos J. Finlay, se emplea en sustitución del conjugado antinucleocápside del virus de la rabia, el cual tiene un costo muy superior.
Uno de los objetivos del Laboratorio Nacional de Referencia de Rabia del Instituto de Medicina Tropical Pedro Kourí, ha sido comparar el conjugado de producción nacional con el conjugado comercial antinucleocápside rábico, para conocer si tiene los parámetros adecuados para ser empleado en el diagnóstico de la rabia en el nivel de los centros provinciales de salud.
Métodos
Muestras
Se estudiaron un total de 150 muestras de encéfalo recibidas en el Laboratorio Nacional de Referencia de Rabia del Instituto de Medicina Tropical Pedro Kourí, en el período comprendido entre los años 2000 a 2002, procedentes de todas las provincias del país. Se utilizaron diferentes especies de animales: 56 caninos, 47 mangostas, 26 felinos, 8 bovinos, 6 quirópteros, 3 ovinos, 2 porcinos y 2 roedores. A todas las muestras se les realizó la técnica de IFD con el conjugado comercial antinucleocápside rábico (BIORAD/Francia) y con el de producción nacional. Aquellas que presentaron resultados discordantes entre ambos conjugados fueron estudiadas por la técnica de reacción en cadena de la polimerasa (RCP) y la prueba biológica en ratones.
Técnicas empleadas
1. Inmunofluorescencia directa realizada con el conjugado de producción nacional.
Se prepararon portaobjetos con 2 improntas de muestras de cerebros de animales y controles positivos y negativos, los cuales se fijaron con acetona a - 20 °C durante 30 min. Se le adicionaron las suspensiones de cerebro de ratón sin infectar e infectadas unidas al conjugado (policlonal producido en carnero marcado con fluoresceína). Fueron incubadas a 37 °C durante 30 min, a continuación se lavaron con PBS (NaCl 100 mM, KCl 2 mM, Na2HPO4 10 mM, K2HPO4 1 mM, pH-7,2) durante 10 min y seguidamente con agua destilada por 5 min. Se secaron a temperatura ambiente. En último lugar, se observó al microscopio de fluorescencia. Se aplicó como aceite de inmersión una gota de glicerina tamponada.
Criterio de positividad
Se consideró positiva aquella muestra en la cual hubo fluorescencia en la impronta teñida con el cerebro de ratón sin infectar, y no la hubo en la teñida con el cerebro de ratón infectado con virus rábico inactivado. El criterio de negatividad estuvo definido por la ausencia de fluorescencia en ambas improntas.
2. Inmunofluorescencia directa realizada con el conjugado comercial antinucleocápside rábico (BIORAD, Francia).
Se realizó el procedimiento recomendado por los productores, preparándose portaobjetos con las diferentes muestras de cerebro a estudiar, así como de los controles positivos y negativos. Se fijaron con acetona a – 20 °C durante 30 min. Se resuspendió el conjugado antirrábico (conjugado monoclonal constituido por la proteína de la nucleocápside del virus de la rabia marcado con fluoresceína) en 3 mL de agua destilada y se centrifugó a 1 500 rpm durante 5 min. Al sobrenadante se le adicionó 150 mL de Azul de Evans como coloración de contraste, el cual se añadió a las impresiones de las muestras y se incubaron a 37 °C durante 30 min. Luego se lavaron 10 min con el tampón PBS y seguidamente 5 min con agua destilada. Se observó al microscopio de fluorescencia utilizando como aceite de inmersión una gota de glicerina tamponada.
Criterio de positividad
Se consideró positiva toda muestra que presentó al menos un foco fluorescente en alguna de las impresiones y como negativa la ausencia de fluorescencia.
3. Aislamiento del virus en ratones Balb/c (prueba biológica).
Fue realizada según la técnica empleada por Koprowski en 1996.3
4. Extracción de ARN.
Se realizó la extracción de ARN según lo planteado por Wright A y otros en el año 2002.4
5. Transcripción reversa (TR) y reacción en cadena de la polimerasa (RCP).
Se efectuó siguiendo el procedimiento utilizado por Nadin-Davis,5 empleando oligonucleótidos que fueron donados por el Servicio de Virología del Instituto de Salud Carlos III, Centro Nacional de Microbiología, Ministerio de Sanidad y Consumo, Mahadahonda, España. Estos oligos amplifican fragmentos del gen que codifica para la proteína N del virus de la rabia. La secuencia de los oligonucleótidos se muestra en la tabla 1.
Tabla 1. Secuencia de los oligonucleótidos empleados
| Oligonucleótidos | Secuencia (5 ►3) |
| 1R (+) | TTTGAGACTGCTCCTTTTG |
| 1F (-) | CCCATATAGCATCCTAC |
| 2R (+) | TATCTCTTCCTCAAAGTTCTT |
| 2F (-) | TACTGCTTATGAAGACTGTTC |
6. Análisis estadístico.
Se utilizó una estadística descriptiva a través de porcentajes. Para definir los niveles de sensibilidad, especificidad, concordancia, valores predictivos positivos y negativos se siguieron los criterios de Haynes.6 Se calcularon también los intervalos de confianza y el índice de Kappa.
Resultados
En este trabajo se realizó el estudio de 150 muestras de encéfalo (100 positivas y 50 negativas) al virus de la rabia mediante la técnica de inmunofluorescencia directa. Las 100 muestras positivas estudiadas coincidieron en los resultados al ser analizadas con el conjugado de producción nacional, pero al emplear el conjugado comercial antinucleocápside rábico, solo fueron positivas 97, existiendo 3 resultados discordantes (negativas con el conjugado comercial y positivas con el nacional), las cuales correspondían a un canino y una mangosta, ambos considerados animales lesionadores y un bovino de la vigilancia epidemiológica.
Al comparar los 2 conjugados, se ve que hubo una concordancia de 98 % (IC 95 %: 94; 99) una especificidad de 94,3 % (IC 95 %:88,1; 100) y una sensibilidad de 100 % con valores predictivos positivos (VPP) y valores predictivos negativos (VPN) de 97 % (IC 95 %: 93,7;100) y 100 %, respectivamente. El Índice de Kappa fue de 0,96 (IC 95 %: 91;1).
El mayor número de muestras positivas correspondieron a las mangostas y a los caninos, seguido por los felinos y en menor número los bovinos, ovinos, porcinos y quirópteros (tabla 2).
Tabla 2. Muestras positivas obtenidas con el conjugado nacional y comercial
| Origen de las muestras | No. de muestras | Vigilancia epidemiológica | Lesionadores a humanos | Positivas IFD conjugado comercial | Positivas IFD conjugado nacional |
| Mangostas | 36 | 9 | 27 | 35 | 36* |
| Caninos | 33 | 4 | 29 | 32 | 33* |
| Felinos | 18 | - | 18 | 18 | 18 |
| Bovinos | 7 | 4 | 3 | 6 | 7* |
| Ovinos | 3 | 2 | 1 | 3 | 3 |
| Porcinos | 2 | 1 | 1 | 2 | 2 |
| Quirópteros | 1 | - | 1 | 1 | 1 |
| Total | 100 | 20 | 80 | 97 | 100 |
* Una muestra discordante: positiva con el conjugado nacional y negativa con el comercial.
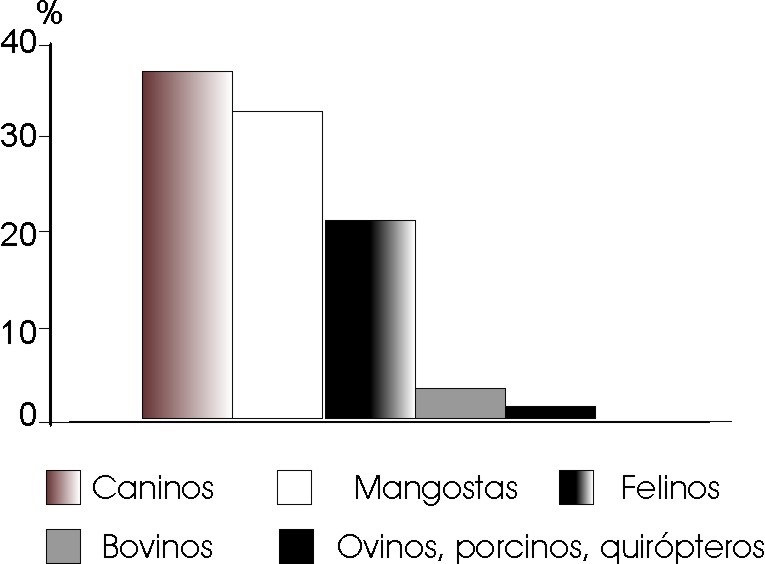
Se pudo observar que los animales lesionadores ocupan el mayor porcentaje de muestras positivas en el estudio con ambos conjugados, correspondiendo el primer lugar a los caninos con 36,3 %, seguidos por las mangostas (33,7 %), los felinos (22,5 %), los bovinos (3,75 %) y encontrándose la menor positividad en los ovinos, porcinos y quirópteros con 1,25 % (fig.).
Fig. Positividad en animales lesionadores.
Las 3 muestras no coincidentes fueron analizadas mediante las técnicas de TR-RCP y la inoculación en ratones lactantes, obteniéndose en ambas una respuesta negativa.
Discusión
Pocas enfermedades provocan más aprehensión en el ser humano que la rabia, sin embargo, el hecho de que puede ser evitada con el empleo de un efectivo y temprano tratamiento posexposición, ha impulsado el desarrollo de técnicas y metodologías diagnósticas que disminuyan el tiempo de obtención de los resultados, con altos niveles de confiabilidad.
La inmunofluorescencia directa es el procedimiento más ampliamente usado para el diagnóstico rápido de rabia. Ya en 1975, Kissling planteó que este método era capaz de identificar 98 de tejidos cerebrales infectados con el virus, coincidiendo en 99 con la prueba biológica en ratón.7
La IFD ha demostrado ser rápida y certera cuando es realizada por laboratorios competentes con reactivos de alta calidad y es considerada actualmente como la técnica de elección en el diagnóstico de la rabia.7,8
La buena correlación entre el conjugado comercial y el de producción nacional, demuestra que el conjugado evaluado posee altos niveles de sensibilidad, especificidad y concordancia. En estudios previos realizados donde se comparó con un conjugado comercial de procedencia mexicana y la prueba biológica en ratón, también se encontró una buena relación entre estos.9
El conjugado de producción nacional tiene la ventaja de ser producido a un costo muy inferior que el empleado en la compra del conjugado comercial, permitiendo el procesamiento de cientos de muestras anualmente.
Se ha reportado que altos valores de los parámetros sensibilidad, especificidad y concordancia, son imprescindibles para que la inmunofluorescencia sea considerada como una herramienta de gran valor diagnóstico. El criterio del empleo adicional de los valores predictivos positivos y negativos, se ha incluido en los últimos años como un acápite importante en la evaluación de pruebas de diagnóstico por la significación que, desde el punto de vista de confiabilidad, muestran sus resultados.10,11
En este estudio, a las muestras con resultados discordantes entre ambos conjugados, se les realizó la prueba biológica para aislamiento viral en ratones, cuyo valor fundamental consiste en detectar mínimas cantidades del virus de la rabia en muestras débilmente positivas; y la técnica de TR-RCP, la cual tiene la ventaja adicional de permitir la detección de este virus aun en muestras que no hayan sido bien conservadas, o que se encuentren en mal estado.3,12 Los resultados obtenidos, con la realización de ambas técnicas, indican la existencia de resultados falsos positivos con el uso del conjugado nacional.
En la preparación de este conjugado se emplea un anticuerpo policlonal, cuya especificidad es menor en comparación con el anticuerpo monoclonal contra la proteína de la nucleocápside viral del conjugado comercial. En 2 de estos casos, en los cuales los animales lesionaron al humano, se aplicó el tratamiento a los pacientes como aparece regulado en el Programa Nacional de Prevención y Control de la Rabia.
El hecho de que no se describan resultados falsos negativos en el estudio y de que estos sean reportados ocasionalmente en la literatura, es de gran importancia, pues en todas las enfermedades, y en el caso de la rabia en particular, la presencia de este tipo de resultado tiene implicaciones graves en cuanto a la conducta médica y la supervivencia del paciente, por lo cual no debe producirse este tipo de error en los laboratorios de diagnóstico de rabia.13 Para evitar esto, es necesario, además de contar con equipos y reactivos adecuados para la IFD, emplear otras técnicas confirmatorias (Griffin CW. Performance evaluation critique. Fluorescet rabies antibody test 1983-1984. Centers for Diseases Control,
Al analizar los resultados de este estudio se pudo observar que del grupo de animales estudiados, los perros son los que mayores lesiones producen en el humano, coincidiendo con diferentes reportes donde se expresa que estos constituyen 82 % de los animales lesionadores.14
A pesar de los resultados falsos positivos encontrados con el empleo
Agradecimientos
Al licenciado Humberto Carol de la empresa de productos Biológicos ¨Carlos J. Finlay¨, por facilitar parte de los conjugados empleados en este estudio.
Referencias bibliográficas
1. Madhusudana S, Shamsundar N, Saraswati R. Comparative evaluation of a simple indirect immunofluorescence test and mouse neutralization test for assaying rabies antibodies. Indian J Pathol Microbiol 2001;44(3):309-12.
2. Expert Committee on Rabies. World Health Organ Tech Rep Ser 1992;824:1-84.
3. Koprowski H. The mouse inculation test. En: Meslin FX, Kaplan MM, Koprowski H, ed. Laboratory techniques in rabies. 4a. ed.
4. Wright A, Rampersad J, Ryan J, Ammons D. Molecular characterization of rabies virus isolates from
5. Nadin-Davis SA. Polymerase chain reaction protocols for rabies virus discrimination. J Virol Methods 1998;75:1-8.
6. Haynes RB. Clinical Epidemilogical Rounds. How to read clinical journal: II to learn about a diagnostic test. CMA Journal 1981;124:703.
7. Kissling RE. The fluorescent antibody test in rabies. En: Baer GM. The natural history of rabies.
8. Dean DJ, Abelseth MK, Atanasi P. The fluorescent antibody test. En: Meslin FX, Kaplan MM, Koprowski H, eds. Laboratory techniques in rabies 4a. ed. Geneva: WHO; 1996. p. 88-95.
9. Fajardo EM. Producción de un reactivo conjugado fluorescente para el diagnóstico de la rabia por el método de inmunofluorescencia directa. Tesisde Maestría, 1999.
10. Bourhy H, Rollin PE, Vincent J, Sureau P. Comparative field isolation of the fluorescent-antibody test, virus isolation from tissue culture, and enzyme immunodiagnosis for rapid laboratory diagnosis of rabies. J Clin Microbiol 1989;27: 519-23.
11. David D, Yakobson B, Rotenberg D, Dveres N, Davidson I. Rabies virus detection by RT-PCR in decomposed naturally infected brains. Vet Microbiol 2002;87(2):111-8.
12. Black EM, McElhinney LM, Lowings JP, Smith J, Johnstone P, Heaton PR. Molecular methods to distinguish between classical rabies and the rabies related European bat Lyssavirus. J Virol Methods 2000;87:123-31.
13. Sitti-Amorn C, Jiratanavattana V, KeoyoJ, Sunpunyan S. The diagnostic properties of Laboratory test for rabies. Int J Epidemiol 1987;16:602-5.
14. Ducastel P, Veyssier P. Epidémiologie, prévention. La Revue du Practicien 1996; 46:1427-32.
Recibido: 13 de diciembre de 2004. Aprobado: 15 de marzo de 2005.
Dra. María de los Ángeles Ribas. Instituto de Medicina Tropical Pedro Kourí, AP 601, CP 11300, Ciudad de La Habana, Cuba. Correo electrónico: maribas@ipk.sld.cu
1 Especialista de I Grado en Virología. Investigadora Auxiliar.
2 Licenciada en Microbiología.
3 Técnico en Procesos Biológicos.