My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Medicina Tropical
On-line version ISSN 1561-3054
Rev Cubana Med Trop vol.58 no.1 Ciudad de la Habana Jan.-Apr. 2006
Hospital General Universitario Dr. Gustavo Aldereguía Lima, Cienfuegos, Cuba
Evaluación de la respuesta clínica e inmunológica a la TARGA en enfermos SIDA de dos provincias cubanas
Dra. Yanelka Bouza Jiménez,1 Dr. Andrés Reyes Corcho,2 Dr. Luis Pentón,3 Dra. Celia León Sánchez4 y Dra. Yadira Bouza Jiménez5
Resumen
Se realizó un estudio descriptivo correlacional y longitudinal a partir de 43 enfermos de SIDA de las provincias Cienfuegos y Sancti Spíritus tratados con terapia antirretroviral altamente activa (TARGA). Se evaluó la respuesta al tratamiento con fármacos de producción nacional, acorde a variables clínicas e inmunológicas. El seguimiento se realizó desde mayo de 2001 hasta junio de 2003. Los casos estudiados fueron pacientes jóvenes predominantemente del sexo masculino, que habían adquirido la infección por la vía sexual. Ellos desarrollaron la evolución natural de la infección por el VIH, pues el tiempo promedio entre el diagnóstico y la definición de SIDA superó los 6 años y paralelamente, la mayoría tenía grados extremos de inmunodepresión al iniciar la TARGA. El desarrollo del síndrome retroviral agudo y su forma severa, así como de infecciones oportunistas menores y mayores, se evidenció en un considerable número de enfermos; estas variables no se correlacionaron con la respuesta inmunológica de los enfermos. La TARGA impactó sobre los índices de hospitalizaciones y de infecciones oportunistas mayores al reducirlos a cero, de manera proporcional no hubo fallecidos al término del estudio. Se observó una sostenida recuperación inmunológica de los pacientes desde el primer año de terapia, la adherencia al tratamiento se correlacionó con la recuperación de la función inmune en los enfermos, y de forma significativa, en los casos sin adherencia no se documentó ascenso del recuento de linfocitos T CD4+. Existió toxicidad a los fármacos en más de 90, con predominio de las manifestaciones digestivas; los hallazgos clínicos sugestivos de síndrome metabólico se encontraron en 18,6 %, frecuencia inferior a la reportada en las series internacionales.
Palabras clave: VIH, síndrome de inmunodeficiencia adquirida, terapéutica.
Han pasado más de 20 años del reporte publicado en el Morbidity Mortality Weekly Report el 5 de junio de 1981; la evidencia de 5 casos de neumonía por Pneumocystis carinii en hombres previamente sanos, que marcó el inicio de la más devastadora pandemia en la historia de la humanidad.1,2 La infección/enfermedad por el VIH/SIDA afecta actualmente a más de 42 000 000 de personas y es responsable de alrededor de 3 000 000 de muertes anuales en el mundo (Reyes Corcho A. Estudio de algunos factores relacionados con el desarrollo de la tuberculosis en pacientes infectados por el virus de la inmunodeficiencia humana. Cuba. 1997-2001 [tesis de maestría en Infectología y Enfermedades Tropicales]. La Habana: Instituto de Medicina Tropical Pedro Kourí; 2001).3,4 En este tiempo las características y los patrones de comportamiento de esta epidemia en el mundo han sufrido cambios importantes; las sucesivas revisiones del número de personas infectadas por el virus que ha publicado la Organización Mundial de la Salud reflejan la rápida progresión de la epidemia de VIH. Paralelamente, una marcada tendencia a una mayor afectación de los países en desarrollo y de los grupos menos privilegiados dentro del mundo desarrollado.5
La realidad es que más de 80 % de los enfermos de SIDA en la mayoría de las naciones fallecen severamente inmunodeprimidos, padeciendo múltiples infecciones oportunistas y neoplasias en extremo agresivas.6 La tuberculosis y otras micobacteriosis, la neumonía por Pneumocystis carinii, la citomegalovirosis diseminada, formas graves de infecciones bacterianas y micóticas, linfomas linfocíticos de alto grado de malignidad y sarcomas de Kaposi viscerales, matizan la abigarrada morbilidad de estos enfermos.7-13 Luego del padecimiento de estas dolencias la progresión del derrumbe immunológico y el advenimiento de la muerte se aceleran. Varios estudios señalan medias de tiempo de alrededor de 9 meses desde la expresión clínica del SIDA hasta la muerte, y recuentos de linfocitos T CD4+ menores que 10 células por milímetro cúbico.11,14 El desarrollo de la terapia para la infección por el VIH es sin duda uno de los sucesos más destacables de la medicina moderna.15 Desde los inicios, con la introducción de la zidovudina, prototipo de un grupo terapéutico general conocido como análogos de los nucleósidos y de hecho primer fármaco aprobado para el tratamiento de la infección por el VIH, la actitud de pacientes y médicos pasó de ser una ciega incomprensión a un derrame de optimismo, teniendo como común denominador la mejoría en la calidad de la vida de los enfermos SIDA (Guidelines for the use of antiretroviral agents in HIV- infected adults and adolescents. Panel on clinical practices for the treatment of HIV infections. DHHS and HJ Kaiser Fundations. 2000).15
A pesar de lo controvertido que aún resulta este tema, existen sólidas evidencias de que la terapia antirretroviral altamente activa (TARGA) ha revolucionado los horizontes de estos enfermos.16 Sistemáticamente se conoce de mejoras notables en el pronóstico y la calidad de la vida, también de importantes reducciones en la morbilidad y mortalidad relacionada con el SIDA, sobretodo en Norteamérica y Europa.17-19 Estudios basados en necropsias documentan que las muertes secundarias a infecciones oportunistas, neoplasias y a estadios finales del SIDA han decrecido, mostrando los enfermos cierta preservación de la función inmune.20 De manera semejante, otras investigaciones han estimado significativos incrementos en la expectativa de vida ajustada por la calidad, y certifican que este beneficio clínico sustancial supera a los obtenidos por otros tratamientos de amplio uso como: el bypass coronario y el tratamiento de la hipertensión arterial moderada y la hipercolesterolemia.21
En Cuba se inició la terapia antirretroviral de manera sistemática para los enfermos SIDA a mediados de 2001. Con anterioridad múltiples estudios han analizado el comportamiento clínico y el perfil inmunológico de las enfermedades oportunistas más frecuentemente asociadas al VIH/SIDA, así como la supervivencia posterior al diagnóstico (Brauburger S. Clinical response to tuberculosis therapy in human immunodeficiency virus disease [tesis de maestría en Infectología y Enfermedades Tropicales]. La Habana: Instituto de Medicina Tropical Pedro Kourí; 1998) (Alfonso Hernández B. Comportamiento de la tuberculosis en los pacientes infectados por el virus de la inmunodeficiencia humana [tesis de maestría en Infectología y Enfermedades Tropicales]. La Habana: Instituto de Medicina Tropical Pedro Kourí; 1996) (Rojas Gómez LJ. Asociación entre la tuberculosis y el virus de la inmunodeficiencia humana en Cuba. Estudio clínico epidemiológico [tesis de maestría en Infectología y Enfermedades Tropicales]. La Habana: Instituto de Medicina Tropical Pedro Kourí; 1997).22,23 Sin embargo, no se ha escrito en el país acerca de los resultados de lo que al modo de ver de los autores de este trabajo, constituye la primera gran intervención en el control de estos pacientes. Por lo tanto, se parte de una inquietud científica basada en el desconocimiento acerca de la respuesta de los enfermos cubanos a la terapia antirretroviral con fármacos genéricos de producción nacional.
Métodos
Se estudió una cohorte de 43 enfermos SIDA tratados con terapia antirretroviral altamente activa (TARGA), que incluyó 2 análogos nucleósidos de la retrotranscriptasa y un inhibidor de la proteasa viral. Los 43 pacientes se derivan de 2 provincias de Cuba: Sancti Spíritus (20 pacientes) y Cienfuegos (23 pacientes). Ellos constituyeron 24,3 % del total de seropositivos para el VIH-I de ambas provincias, y fueron sistemáticamente evaluados en los sanatorios respectivos desde el inicio del tratamiento en el mes de mayo de 2001. Se utilizó un diseño descriptivo y correlacional, que incluyó el análisis retrospectivo del ambiente clínico del enfermo previo a la terapia y una evaluación prospectiva y longitudinal durante 2 años luego de iniciado el tratamiento. El dato primario se obtuvo de la revisión exhaustiva de los expedientes clínicos archivados en las respectivas instituciones sanatoriales, además de las historias clínicas hospitalarias inherentes al ingreso en los hospitales provinciales y el Instituto de Medicina Tropical Pedro Kourí de Ciudad de La Habana. El dato primario se recogió en una base de datos configurada en el paquete estadístico EPIINFO versión 6.04 de junio de 2001(CDC/OMS).
Variables incluidas en el estudio y las definiciones operacionales
Edad, sexo, vía de infección, forma por la que se define el SIDA acorde a los criterios de los CDC de 1993.16
Hospitalizaciones antes y después de la TARGA.
Tiempo entre el diagnóstico de la infección por el VIH y el desarrollo del síndrome de inmunodeficiencia adquirida.
Antecedente de síndrome retroviral agudo y síndrome retroviral agudo severo según la descripción clínica de Cooper y MacLean.24
Antecedente de enfermedad sintomática precoz (complejo relacionado con el SIDA).16
Infecciones oportunistas menores ocurridas antes y después de la TARGA.
Infecciones oportunistas mayores ocurridas antes y después de la TARGA: se consideraron las infecciones que definen SIDA según los criterios de los CDC de 1993.16
Recuento de linfocitos T CD4+ realizado por citometría de flujo al inicio de la TARGA, al año y a los 2 años.
Adherencia a la terapia antirretroviral: se consideraron 2 condiciones; la existencia de adherencia, cuando no se presentaron inestabilidades en el uso de los fármacos incluso en presencia de toxicidad farmacológica. De no cumplirse lo anterior se definió como ausencia de adherencia a la terapia antirretroviral.
Definiciones de resultado (Guidelines for the use of antiretroviral agents in HIV- infected adults and adolescents. Panel on clinical practices for the treatment of HIV infections. DHHS and HJ Kaiser Fundations. 2000).
Fracaso clínico a la terapia: deterioro clínico que indique progresión de la enfermedad por el VIH, nueva enfermedad definitoria de SIDA tras el inicio del tratamiento.
Fracaso inmunológico: disminución acelerada y persistente del recuento de linfocitos T CD4+, determinados al menos en 2 ocasiones independientes.
Éxito terapéutico: cuando no se cumplan las situaciones anteriores.
Estado clínico: se definió como vivo o fallecido.
Efectos adversos de la terapia: serán compatibles con los efectos adversos de clase, inherentes a 2 grupos esenciales de fármacos:23 inhibidores nucleósidos de la retrotranscriptasa e inhibidores de la proteasa viral, en estos últimos se incluyen las evidencias clínicas de lipodistrofia y de síndrome metabólico (Guidelines for the use of antiretroviral agents in HIV- infected adults and adolescents. Panel on clinical practices for the treatment of HIV infections. DHHS and HJ Kaiser Fundations. 2000).
Esquemas y dosis de los fármacos antirretrovirales utilizados en los pacientes estudiados
A los efectos de este trabajo y como parte de los protocolos cubanos para el tratamiento de la infección por el VIH, los enfermos fueron tratados con: AZT (zidovudina: tabletas de 100 mg) 600 mg/d o d4T (estavudina: tabletas de 40 mg) 80 mg/d, más 3TC (lamivudina: tabletas de 150 mg) 300 mg/d e indinavir (tabletas de 200 mg) 1 800 mg/d.
Análisis estadístico
Los datos se registraron y procesaron utilizando el paquete estadístico Epi-Info (CDC, Atlanta, GA, versión 6.04 de enero de 2001). Se calculó la frecuencia de las variables categóricas y la prueba no paramétrica de chi cuadrado se utilizó para comparar las proporciones. Se determinó la media aritmética de las mediciones numéricas y se compararon usando el test de Kruskal -Wallis de análisis de la varianza. Se asumió un nivel de significación a= 0,05.
Resultados
En la tabla 1 se aprecia que predominó el sexo masculino sobre el femenino de manera global, 60,5 %, y significativamente en la provincia de Cienfuegos, 65,2 %; llamó la atención que en Sancti Spíritus hubo un porcentaje mayor de mujeres que en el resto, 45 %. Los enfermos fueron individuos jóvenes pues la media de edad osciló alrededor de 34 años, excepto en Sancti Spíritus, donde el promedio de edad resultó superior: 38,85 años respecto a Cienfuegos con 30,91 años; siendo este hallazgo significativo desde el punto de vista estadístico. La vía sexual de infección se encontró en más de 90 % de los enfermos para ambas provincias. El tiempo promedio entre el diagnóstico de la infección por el VIH y la definición clínica de SIDA fue de 6,7 años para todos los pacientes y de 8,6 y 5 años para Sancti Spíritus y Cienfuegos respectivamente, con diferencia estadística significativa.
Tabla 1. Características generales de los pacientes
| Variable | Cienfuegos | Sancti Spíritus | Global | |||
| Sexo | # | % | # | % | # | % |
| Masculino | 15 | 65,2** | 11 | 55,0*** | 26 | 60,5*** |
| Femenino | 8 | 34,8 | 9 | 45,0 | 17 | 39,5 |
| Vía de infección | ||||||
| Sexual | 21 | 91,3 | 19 | 95,0 | 40 | 93,0 |
| Autoinoculado | 2 | 8,7 | 1 | 5,0 | 3 | 7,0 |
| Edad media | 30,91* DE=5,86 | 38,85* DE=10,29 | 34,61 DE= 9,06 | |||
| Media de tiempo entre el diagnóstico y la definición de SIDA | 5,08* DE= 4,36 | 8,65* DE= 4,35 | 6,74 DE= 4,66 | |||
*p< 0,05 para la diferencia entre medias, ** p< 0,05 para la diferencia entre proporciones, *** p 0,05 para la diferencia entre proporciones.
En la tabla 2 se muestran las características clínicas e inmunológicas de los pacientes antes del inicio de la terapia antirretroviral; 74,4 % definió SIDA por un recuento de linfocitos T CD4+ inferior a 200 células por mm3; 16,3 % alcanzó esta condición por haber padecido alguna de las enfermedades oportunistas mayores que se incluyen en la categoría clínica de SIDA y 9,3 % tenía ambas condiciones en el momento de iniciar la terapia antirretroviral. La observación anterior fue bastante uniforme para ambas provincias con discreta superioridad porcentual en Cienfuegos: 78,3, 17,4 y 4,3 % para las categorías definitorias de SIDA. El recuento medio de linfocitos T CD4+ no tuvo diferencia significativa entre las provincias, siendo 168,61 células por mm3 en Cienfuegos y 152,45 en Sancti Spíritus (p> 0,05).
Tabla 2. Características clínicas e inmunológicas de los pacientes antes del inicio de la terapia
| Variable | Cienfuegos | Sancti Spíritus | Global | |||
| Definición de SIDA | # | % | # | % | # | % |
| Recuento de LT CD4+ | 18 | 78,3* | 14 | 70,0* | 32 | 74,4* |
| Enfermedades oportunistas | 4 | 17,4 | 3 | 15,0 | 7 | 16,3 |
| Ambas | 1 | 4,3 | 3 | 15,0 | 4 | 9,3 |
| Síndrome retroviral agudo | 15 | 65,2* | 11 | 55,0 | 26 | 60,5** |
| Síndrome retroviral agudo severo | 12 | 80,0* n=15 | 7 | 63,6 n=11 | 19 | 73,1* n=26 |
| Enfermedad sintomática precoz | 20 | 86,9* | 14 | 70,0* | 34 | 79,1* |
| Hospitalizaciones | 22 | 95,6* | 17 | 85,0* | 39 | 90,7* |
| Infecciones oportunistas menores | 20 | 86,9* | 14 | 70,0* | 34 | 79,1* |
| Infecciones oportunistas mayores | 9 | 39,1* | 8 | 40,0* | 17 | 39,5 |
| Recuento medio de linfocitos T CD4+ | 168,61** | DE= 111,3 | 152,45** | DE= 72,21 | 161,1 | DE=94,46 |
De los casos, 60,5 % desarrolló el síndrome retroviral agudo durante la primo infección por el VIH-1, y de estos 73,1 % padeció un síndrome retroviral agudo severo acorde a los criterios utilizados; particularmente en Cienfuegos tal condición alcanzó 80,0 %. La enfermedad sintomática precoz se documentó en 79,1 % de los casos, sin embargo, fue significativo que esta observación la presentaron 20 pacientes en Cienfuegos (86,9 %) respecto a 14 enfermos en Sancti Spíritus (70,0 %) (p< 0,05). De los enfermos, 90,7 % había estado hospitalizado al menos una oportunidad en el momento del estudio, siendo esta proporción mayor en Cienfuegos donde 95,6 % tenía este precedente respecto a 85 % en Sancti Spíritus (p< 0,05).
En la tabla 3 se ven los resultados de la adherencia a la terapia antirretroviral y los efectos adversos más frecuentes. La adherencia global fue significativamente de 81,4 % con superioridad entre los enfermos de Cienfuegos, 86,9 % vs. 75 % en Sancti Spíritus. Es oportuno destacar que, entre los pacientes que tuvieron adherencia al tratamiento, 57,2 % se agrupó en Cienfuegos, de manera inversa 62,5 % de los enfermos sin adherencia fueron espirituanos. En 90,7 % de los pacientes se reportó efectos adversos de la terapia, siendo los más frecuentes: vómitos 81,4 %, náuseas 72,1 %, pérdida de apetito 20,9 %, diarrea 18,6 %, redistribución grasa y manifestaciones clínicas del síndrome metabólico asociado a los antirretrovirales en 18,6 % y nefrolitiasis en 14 %. El resto de las manifestaciones como: alopecia, íctero y neuropatía periférica, tuvieron una escasa frecuencia en estos enfermos.
Tabla 3. Adherencia a la terapia antirretroviral y frecuencia de efectos adversos
| Variable | Cienfuegos | Sancti Spíritus | Global | |||
| Adherencia | # | % | # | % | # | % |
| Si | 20 | 86,9*** | 15 | 75,0*** | 35 | 81,4*,*** |
| 57,2 | 42,8 | 100,0** | ||||
| No | 3 | 13,1 | 5 | 25,0 | 8 | 18,6* |
| 37,5 | 62,5 *** | 100,0** | ||||
| Efectos adversos | ||||||
| Si | 20 | 86,9*** | 19 | 95,0*** | 39 | 90,7*** |
| No | 3 | 13,1 | 1 | 5,0 | 4 | 9,3 |
| Frecuencia de efectos adversos | ||||||
| Efecto adverso | # | % | ||||
| Vómitos | 35 | 81,4 | ||||
| Náuseas | 31 | 72,1 | ||||
| Pérdida del apetito | 9 | 20,9 | ||||
| Nefrolitiasis | 6 | 14,0 | ||||
| Redistribución anormal de la grasa corporal | 8 | 18,6 | ||||
| Síndrome metabólico asociado a la terapia | 8 | 18,6 | ||||
| Diarreas | 8 | 18,6 | ||||
| Alopecia | 4 | 9,3 | ||||
| Íctero | 2 | 4,7 | ||||
| Neuropatía periférica | 1 | 2,3 | ||||
En la tabla 4 se describe la respuesta clínica e inmunológica a la TARGA. La supervivencia a los 2 años de tratamiento fue de 100 % en ambos grupos de enfermos, y proporcionalmente a este resultado, se ve que la frecuencia de infecciones oportunistas menores solo alcanzó 16,3 %, con poca diferencia entre las provincias: Cienfuegos (17,4 %) y Sancti Spíritus (15,0 %). De manera relevante no se diagnosticaron infecciones oportunistas mayores después de 2 años de tratamiento y las hospitalizaciones se redujeron ostensiblemente, alcanzando 16,3 % de los enfermos, con un porcentaje relativamente mayor en Cienfuegos, donde 21,6 % de los pacientes fueron en algún momento hospitalizados durante el período de seguimiento.
Tabla 4. Respuesta a la terapia antirretroviral al término del seguimiento
| Mediciones de resultado | Cienfuegos | Sancti Spíritus | Global | |||
| Supervivencia 2 años | # | % | # | % | # | % |
| 23 | 100 | 20 | 100 | 43 | 100* | |
| Hospitalizaciones posteriores a la terapia | 5 | 21,7 | 2 | 10,0 | 7 | 16,3* |
| Infecciones oportunistas menores posteriores a la terapia | 4 | 17,4 | 3 | 15,0 | 7 | 16,3* |
| Infecciones oportunistas mayores posteriores a la terapia | 0 | 0 | 0 | 0 | 0 | 0 |
| Fracaso clínico | 2 | 8,7 | 0 | 0 | 2 | 4,7 |
| Fracaso inmunológico | 3 | 13,1 | 3 | 15,0 | 6 | 14,0 |
| Éxito terapéutico | 20 | 86,9* | 17 | 85,0* | 37 | 86,0* |
| Recuento de linfocitos T CD4+ al año de la terapia | Media | Mediana | Media | Mediana | Media | Mediana |
| 412,5** DE+/- 451,2 | 242 | 265,5** DE+/-134,7 | 233 | 344,1 DE+/- 346,9 | 234 | |
| Recuento de linfocitos T CD4+ a los dos años de la terapia | 457,3** DE+/- 343,5 | 420 | 342,5** DE+/- 133,1 | 322 | 401,3 DE+/- 266,0 | 331 |
*p< 0,05 para la diferencia entre proporciones, **p> 0,05 para la diferencia de las medias entre provincias.
Una medición que denotó sustancial mejoría fue el recuento de linfocitos T CD4+, la media al año de la terapia en Cienfuegos alcanzó las 412 células por mm3 y en Sancti Spíritus 265 células por mm3, para una media global de 344 células. Al término del seguimiento la media del recuento de linfocitos T CD4+ fue de 457 células en Cienfuegos y de 342 células en el resto, con un promedio global de 401 células por mm3; las diferencias entre las provincias no fueron significativas luego de aplicar la prueba de significación estadística (tabla 4).
Además, en la tabla 4 se señalan otras mediciones de resultados al término del seguimiento, y se puede ver cómo el éxito terapéutico se alcanzó en 86,4 % de los casos en Cienfuegos y en 85 % en Sancti Spíritus, para un porcentaje global de 86,0 %. Se encontró una baja frecuencia de fracaso clínico: 8,7 % en Cienfuegos y 0 % en Sancti Spíritus; discretamente superior fue la frecuencia de fracaso inmunológico, 13,1 y 15,0 %, respectivamente.
En la tabla 5 se correlacionan las variables consideradas de pronóstico adverso para la recuperación inmunológica de los pacientes, con el recuento medio de linfocitos T CD4+ al año y a los 2 años de la terapia antirretroviral; como se puede apreciar, las medias de esta medición no se modificaron de manera significativa ante la tenencia o no de la variable. Tal vez lo más contrastante dependió de haber padecido o no de la enfermedad sintomática precoz y de infecciones oportunistas menores, cuyos valores fueron 280 y 583 células para los que tuvieron o no la condición respectivamente, al año de la terapia y luego de 2 años se mantuvo la diferencia: 377 y 480 células por mm3, sin embargo, la desviación estándar tan amplia resta valor a estas diferencias.
Tabla 5. Correlación entre las variables consideradas de mal pronóstico y la respuesta inmunológica a la terapia antirretroviral
| Variables | Recuento medio de linfocitos T CD4+ 1 año de terapia | Recuento medio de linfocitos T CD4+ 2 años de terapia |
| Existencia de enfermedad sintomática precoz | 280,9* DE+/- 147,4, | 377,7 DE+/- 263,4, |
| Ausencia de enfermedad sintomática precoz | 583,2* DE+/- 678,9, | 480,2 DE+/- 275,1, |
| Hospitalizaciones previas | 345,6* DE+/- 361,2, | 414,1 DE+/- 272,2, |
| Ausencia previa de hospitalizaciones | 330,3* DE+/- 179,6, | 248,7 DE+/- 100,7, |
| Infecciones oportunistas menores previas | 280,8* DE+/- 147,4, | 377,6 DE +/- 263,4, |
| Ausencia previa de infecciones oportunistas menores | 583,2* DE+/-678,9, | 480,2 DE+/- 275,1, |
| Infecciones oportunistas mayores previas | 380,2* DE+/- 487,0 | 404,8 DE+/- 227,3, |
| Ausencia previa de infecciones oportunistas mayores | 320,6* DE+/- 221,2 | 398, 6 DE+/- 297,8, |
| Síndrome retroviral agudo severo | 379,4* DE+/- 462,5 | 436,6 DE+/-344,1, |
| Ausencia de síndrome retroviral agudo severo | 316,2* DE+/- 224,8 | 367,9 DE+/-164,1, |
La adherencia a la terapia antirretroviral fue considerada como una variable que podía influir sobre la respuesta al tratamiento. La graficación 1, señala la variabilidad del recuento medio de linfocitos T CD4+ acorde a la existencia o no de adherencia, y realmente se obtuvieron resultados estadísticamente significativos desde: valores inferiores a las 200 células y una tendencia decreciente en los pacientes sin adherencia y un ascenso progresivo de esta medición en los casos con adherencia, oscilando el recuento de linfocitos T CD4+ alrededor de 400 células por mm3 (fig.).
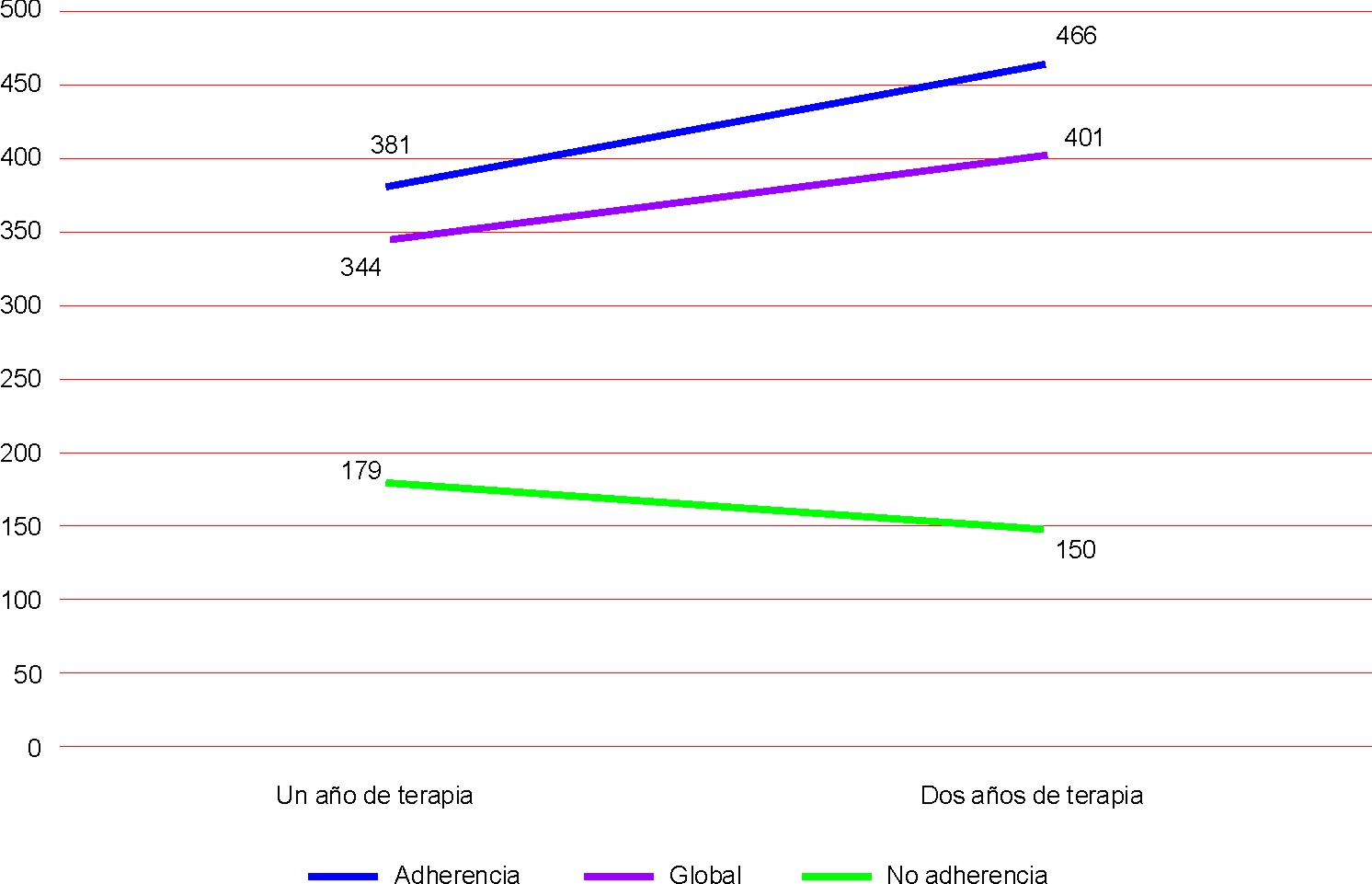
p< 0,05 para la diferencia entre las medias de linfocitos T CD4+ acorde a la categoría adherencia a la terapia.
Fig. Correlación entre la adherencia a la terapia antirretroviral y la evolución inmunológica de los pacientes.
Discusión
La investigación mostró los resultados de una cohorte de enfermos SIDA de 2 provincias cubanas que comenzaron la terapia antirretroviral altamente activa, como parte del proyecto cubano de tratamiento con genéricos de producción nacional. Se debe señalar, que a pesar de que el número de casos ascendió de manera limitada a 43, este grupo representó 100 % de los enfermos SIDA y 24,3 % del total de seropositivos al VIH-1 de la región (175 pacientes), hasta el momento de conformada la cohorte de pacientes a estudiar. Considerando de antemano, que Cuba reporta baja prevalencia de infección por el VIH (0,05 %) y que hasta diciembre de 2002 la prevalencia acumulada de seropositivos era de 4 517, y 1 029 enfermos SIDA recibían terapia antirretroviral.
La distribución de los pacientes estudiados según el sexo mostró un franco predominio del sexo masculino; este parámetro se comportó proporcionalmente a la epidemia de VIH/SIDA en Cuba y el mundo.24-28 La observación en Sancti Spíritus de un porcentaje superior al resto para el sexo femenino se aleja discretamente de lo reportado en Cuba y a nuestro juicio, pudo obedecer a los patrones epidemiológicos y socioculturales relacionados con la transmisión de la infección por el VIH en esta provincia, desde los inicios de la epidemia.
Estos pacientes fueron adultos jóvenes de manera global, relacionados precisamente con las edades de riesgo de infección por el virus, por lo que regularmente enferman por SIDA temprano en sus vidas. Varios estudios en el Instituto de Medicina Tropical "Pedro Kourí" y las series internacionales consultadas coinciden con lo encontrado aquí.10,22,26-28 Como resultado divergente, la media de edad en Sancti Spíritus fue superior al resto, probablemente dependiente de que esta provincia, fue una de las pioneras en reportar individuos infectados por el VIH en Cuba.
Un elemento que consideramos en el estudio, fue el tiempo entre el diagnóstico de la infección por el VIH, no necesariamente indicador del tiempo de infección, y el momento en que los enfermos fueron definidos como casos SIDA, siendo esta variable para muchos, indicadora de pronóstico adverso en los pacientes tratados con terapia antirretroviral. Realmente la media osciló alrededor de 6 años con superioridad para los espirituanos cuya media fue de 8,6 años; este parámetro está acorde con observaciones nacionales e internacionales,6,29,30 pudiendo obedecer la diferencia a particularidades de la evolución natural de la enfermedad en cada lugar y que no debe regularizarse a los 10 años, siempre mencionados como promedio. No obstante, en este resultado pudo haber influido lo que se aclaraba al inicio del comentario, de que lo recogido en el trabajo fue a partir del diagnóstico serológico y no del momento de la infección; esto muchas veces resulta difícil porque el reconocimiento clínico de la infección por el virus se ve limitado por las formas asintomáticas o paucisintomáticas de la primoinfección. En los pacientes estudiados la retrovirosis aguda sintomática se reportó en 60,5 % de los casos, coincidiendo con lo reportado en cohortes occidentales (50-90 %), pero divergente de una cohorte en Tailandia que solo documentó el síndrome en 11 %.1,16,31
Un aspecto evaluado en la investigación se relacionó con las condiciones clínicas de los casos antes del inicio de la terapia antirretroviral, más de 70 % tuvo un recuento de linfocitos T CD4+ menor a 200 células por mm3 y para ambas provincias la media de esta medición resultó inferior a este valor; indicando una marcada deficiencia de la inmunidad celular asociada con el deterioro clínico de los pacientes. Esta observación coincide con la situación en Cuba y en el resto del mundo en la era previa a la generalización de la TARGA.30-34
De forma semejante se comportó la frecuencia de hospitalizaciones antes de la terapia, superior a 90 %; así como la presentación en estos enfermos de la enfermedad sintomática precoz también denominado complejo relacionado con el SIDA, y no es más que el resultado del progresivo declinar de la inmunidad de los individuos infectados por el VIH, secundado por la aparición de enfermedades oportunistas menores como: la candidosis oral, el herpes zoster, herpes simple recidivante, etc. Estas características evidencian que estos enfermos prácticamente desarrollaron la historia natural de la infección por el VIH y se presentaron en el estudio como pacientes polimórbidos con grados variables de compromiso de la inmunidad celular, inherente a la destrucción millonaria de linfocitos T CD4+ y a la replicación exagerada del virus en el sistema mononuclear - fagocítico; de tal manera, varios investigadores coinciden en la existencia de más de diez billones de partículas virales en el organismo de individuos infectados, en cualquier momento en que se haga la medición.2,35,36 De otra parte, la presentación de las infecciones oportunistas mayores tuvo una frecuencia próxima a 40 %, destacándose la neurotoxoplasmosis y la neumonía por Pneumocystis carinii junto a la criptosporidiosis sintomática como las más prevalentes. La literatura clásica documenta que las infecciones oportunistas mayores marcaban el panorama clínico de los pacientes luego de 10 años de evolución de la infección por el VIH, y que su aparición, iba acompañada de una elevada letalidad y una pobre supervivencia; se describía que la neumonía por Pneumocystis carinii hoy denominado Pneumocystis jiroveci marcaba el SIDA en 20 % de los casos, que la neurotoxoplasmosis era la causa fundamental de un defecto motor agudo en estos enfermos, y que la criptococosis cerebral definía el SIDA hasta en 10 % de los individuos, expresándose como la afectación meníngea más común.2,16,34,37 Sin embargo, los resultados de este estudio coinciden con lo anterior pero con frecuencias inferiores y con escasos reportes de criptococosis y candidosis profunda, teniendo la limitante del número de enfermos que se estudió, respecto a las series internacionales.
Al término del seguimiento la adherencia a la TARGA superó 80 %, y particularmente en la provincia de Cienfuegos 86 %, lo que se puede definir como un elevado porcentaje de sostenibilidad en el tratamiento. Varias series internacionales han obtenido similares resultados, aceptando la mayoría que la información sobre la adherencia es incompleta y referida por el enfermo, lo que limita su confiabilidad.33,38 De manera significativa el mayor número de pacientes sin adherencia correspondió a Sancti Spíritus con 62,5 %, sin embargo, esta observación no motivó adversidades de importancia en los resultados al término de los 2 años de seguimiento. Sin duda, la mayor relevancia en relación con la adherencia al tratamiento obedeció a la significativa diferencia de la restauración inmunológica entre los enfermos con adherencia y sin esta; en estos últimos el recuento medio de linfocitos T CD4+ no superó las 200 células por mm3 (179 y 150 al año y 2 años, respectivamente), lo que equivale a la ausencia de recuperación inmune de los casos. La literatura consultada atribuye a la adherencia terapéutica un papel decisivo en la respuesta al tratamiento y ha encontrado asociación entre esta variable y la posibilidad de enfermar y morir por entidades clínicas dependientes de la severa inmunodepresión.33,38-42
También en el estudio se valoró la respuesta al tratamiento en términos de infecciones oportunistas posteriores a la terapia, siendo sorprendente la disminución en su ocurrencia luego de 2 años, 16,3 % de los casos desarrolló alguna infección menor y no hubo enfermos con infecciones oportunistas mayores durante el seguimiento. De manera proporcional se redujo el número de pacientes que necesitaron hospitalización en este período, con un porcentaje superior en Cienfuegos (21,7 %). En relación con lo anterior, 100 % de los casos sobrevivió 2 años de tratamiento, a pesar de la precaria situación clínica e inmunológica en que se encontraban al iniciarlo, esto ocasionó los elevados índices de éxito terapéutico y la escasa frecuencia de fracaso clínico e inmunológico. Se debe argumentar, que aunque el recuento de linfocitos T CD4+ es un excelente predictor de pronóstico e incluso de supervivencia en estos pacientes, en ocasiones no existe correspondencia entre su valor y el estado clínico del enfermo y no resulta infrecuente encontrar casos con un pobre ascenso de los valores de la medición y sin embargo no padecen enfermedades oportunistas; tal observación forma parte de los enigmas aún sin aclarar en la infección por el VIH/SIDA. La información consultada coincide en lo absoluto con estos análisis y básicamente, describe la mejoría clínica de los casos bajo tratamiento antirretroviral, no solo en lo concerniente al desarrollo de dolencias oportunistas y neoplasias, sino a la calidad de vida y la función física y mental de los enfermos.43-48
De los pacientes de este estudio, 90,7 % presentó toxicidad por antirretrovirales y fueron básicamente reacciones gastrointestinales transitorias inherentes a los inhibidores de la proteasa viral, particularmente el indinavir; este comportamiento muestra similitud con los estudios consultados.49-51 Se debe aceptar la escasa frecuencia del resto de las manifestaciones de toxicidad, con excepción de la redistribución de la grasa corporal y las manifestaciones clínicas del síndrome metabólico, que se registraron en 18,6 % de los casos. Es prudente detenerse en este aspecto de vital importancia en el control de los pacientes con TARGA, que como se conoce, incluye un fármaco inhibidor de la proteasa viral, piedra angular de los resultados que se obtienen en la supervivencia de los pacientes. A estos se le atribuye esta complicación, que evoluciona con: dislipidemia, obesidad centrípeta, hiperglicemia y resistencia a la insulina; así como un riesgo cardiovascular elevado, aunque sin una clara repercusión en la incidencia de eventos cardiovasculares y cerebrovasculares en los enfermos SIDA.18,49,52-54 En series internacionales la prevalencia de esta entidad alcanza 50 %; en Australia, uno de los pioneros en la identificación clínica del síndrome, de 1 348 pacientes encuestados en 14 centros hospitalarios, se identificó maladistribución de la grasa corporal en 54 %; la cohorte HOPS en los EE. UU. identificó la alteración en 49 %; y el estudio LIPOCO en Francia tuvo esta observación en 53,3 %, de los que, 25,3 % mostró una mezcla de lipoatrofia con acumulación grasa anormal (Miller JE, Emery S, French M, Baker D, Cooper DA. The Australian Prevalence Survey of Lipodystrophy. Seventh Conference on Retroviruses and Opportunistic Infections. San Francisco, January 2000).55,56 Para muchos, esta alteración clínica y metabólica de repercusión aún no muy aclarada, tiene gran similitud con el denominado síndrome X plurimetabólico y creen que la génesis subyace en factores genéticos, ambientales y dependientes de los fármacos, para los cuales postulan un posible daño del DNA mitocondrial, comparado con el que se produce en la lipomatosis múltiple simétrica.18,28
En la cohorte estudiada la aparición de este trastorno tuvo una frecuencia inferior a los reportes, y no se avizoraron complicaciones orgánicas secundarias al desorden metabólico; no obstante, se aceptaron como limitantes: el número de enfermos estudiados y la imposibilidad de hacer las mediciones bioquímicas que pudieran sustentar este resultado. De cualquier forma, se observó una excelente respuesta clínica e inmunológica de los pacientes a la terapia antirretroviral con fármacos de producción nacional y no se restó importancia a los hallazgos encontrados y al seguimiento que se debe implementar sobre las complicaciones de la terapia antirretroviral, que en los inicios del siglo, forman parte cada vez más importante de las causas de abandono terapéutico y de enfermedades sistémicas en los pacientes con SIDA.
Evaluation of the clinical and immunological response to highly active antiretroviral therapy of AIDS patients from two Cuban provinces
Summary
A longitudinal, corelational and descriptive study of 43 AIDS patients from
Key words: HIV, acquired immunodeficiency syndrome, therapeutics.
Referencias bibliográficas
1. First report of AIDS. MMWR 2001;50(21):429.
2. Fauci AS, Lane HC. Enfermedades por el virus de la inmunodeficiencia humana: SIDA y procesos relacionados. En: Fauci AS, Braunwald E, Isselbacher KJ, Wilson JD, Martin JB, Kasper DL, et al, eds. Harrison. Principios de Medicina Interna. 14ª.ed. Madrid: Mc GrawHill-Interamericana; 1998. p.2034-107.














