My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Medicina Tropical
Print version ISSN 0375-0760
Rev Cubana Med Trop vol.66 no.1 Ciudad de la Habana Jan.-Mar. 2014
COMUNICACIÓN BREVE
Posible relación entre mastocitos y plaquetas en la infección por dengue
Possible relationship between mast cells and platelets in dengue infection
Dra. Gissel García Menéndez,I Dra. Alienys Izquierdo Oliva,I Dra. Eva María Salinas Miralles,II Dra. Ana B. Pérez Díaz,I Dra. Beatriz Sierra Vázquez,I Dra. Darién López Ramón,I Dra. Marcia Vázquez Zamora,I Dr. Luis Fonte GalindoI, Dra. María G. Guzmán TiradoI
I Instituto de Medicina Tropical "Pedro Kourí". La Habana, Cuba.
II Universidad Autónoma de Aguascalientes. México.
RESUMEN
Introducción: durante años se ha especulado sobre el posible papel de los mastocitos en la patogenia de la infección por dengue, debido a su extensa ubicación en los tejidos. Sin embargo, su papel en relación con esta infección no ha sido bien explorado.
Objetivo: evaluar el comportamiento de las plaquetas en el ratón Balb/c, deficiente de mastocitos peritoneales, en el cual se reproduce la infección secundaria.
Métodos: se evaluó el comportamiento de las plaquetas en un modelo animal en ratón Balb/c en presencia o ausencia de mastocitos peritoneales.
Resultados: se constató una disminución significativa de las plaquetas asociada a la presencia de los mastocitos (p= 0,0155).
Conclusiones: los resultados sugieren que los mastocitos pudieran tener un papel patogénico en la infección por dengue.
Palabras clave: dengue, mastocitos, plaquetas, patogénesis.
ABSTRACT
Introduction: the possible role of mast cells in the pathogenesis of dengue infection has been speculated upon for years, due to its broad distribution in tissues. However, the role of mast cells in relation to dengue infection has not been explored properly.
Objective: evaluate the behavior of platelets in Balb/c mice, deficient in peritoneal masts cells, in which secondary infection is reproduced.
Methods: the behavior of platelets was evaluated in an animal model based on Balb/c mice in the presence or absence of peritoneal mast cells.
Results: results show a significant decrease in platelets, associated to the presence of mast cells (p= 0.0155).
Conclusions: results suggest a possible pathogenic role of mast cells in dengue infection.
Key words: dengue, mast cells, platelets, pathogenesis.
Los mastocitos, células implicadas en reacciones alérgicas e infecciones parasitarias, han sido objeto de atención de aquellos que estudian la infección por dengue.1 Durante años se ha especulado sobre el posible papel de esas células en la patogenia de esta virosis. A favor de ello se han observado niveles elevados de histamina, un mediador soluble de estas células, en la orina de pacientes de cuadros severos de dengue.2 Sin embargo, el papel preciso de los mastocitos en relación con la patogenia del dengue no ha sido bien explorado aún.
Estas células, que se encuentran prácticamente en todos los tejidos, excepto en circulación, maduran bajo la influencia del microambiente en que se encuentren, lo que posibilita un contacto directo con el agente infeccioso, por ejemplo el virus dengue y, en consecuencia, una mayor posibilidad de infección.3 Los mastocitos están involucrados tanto en la inmunidad innata como en las fases de iniciación y efectora de la inmunidad adaptativa.4,5 Recientemente, se ha constatado que pueden inducir la secreción de IFNa (http://www.frontiersin.org/Inflammation/10.3389/fimmu.2012.00016/abstract), así como otras quimoquinas, entre las que se destacan CXCL10, CCL4 y CCL5, RANTES, MIP-1a, y MIP-1ß.6 Su participación en la fase efectora de la inmunidad adaptativa se asocia principalmente a las señales inducidas por los receptores Fc que están en su superficie, porque a través de estos se activan respuestas celulares como endocitosis, fagocitosis de complejos particulados, exocitosis de aminas vasoactivas, enzimas proteolíticas y moléculas citotóxicas, así como mediadores proinflamatorios de derivados lipídicos, citoquinas, quimoquinas y factores de crecimiento.7,8
Teniendo en cuenta la importancia del mastocito en la inflamación, sus lugares de residencia en tejidos asociados a los vasos sanguíneos, su activación unida al incremento de la permeabilidad vascular, el hecho de que no exista un modelo animal que reproduzca la enfermedad por dengue y que la infección secundaria es considerada como un factor esencial en el desencadenamiento de las formas severas de la enfermedad, resulta de interés evaluar en el ratón Balb/c deficiente de mastocitos peritoneales, en el cual se reproduce la infección secundaria, el comportamiento de las plaquetas, uno de los parámetros clínicos que se asocia con mayor significación a la enfermedad grave por dengue.
Esquema de inmunización
Para evaluar la posible participación de las células cebadas o mastocitos en la infección secundaria por dengue, se empleó el compuesto 48/80,9,10 el cual produce la degranulación de esas células y su inactivación total a los 4 días posteriores a su inoculación intraperitoneal en ratones balb/c. Los grupos de ratones inoculados con el compuesto 48/80 no poseen al cuarto día posinoculación, mastocitos funcionales en peritoneo.
Se diseñó un esquema de infección secuencial VD1 VD2 (tabla), en el que se emplearon ratones balb/c machos en un peso corporal de 23 a 25 g, los cuales fueron inoculados por vía intraperitoneal (IP) y sangrados a 15 días tras la última inoculación, para realizar el conteo de plaquetas (tabla).
Paralelamente, se realizó el conteo de plaquetas en un grupo de 10 ratones de la misma cepa, edad y sexo, no infectados por dengue (grupo C), para determinar los valores normales de este parámetro. El conteo de plaquetas fue evaluado, además, en otro grupo similar de 10 ratones, pero que incluyó la inoculación del compuesto 48/80 (grupo C 48/80).
Conteo de plaquetas
La sangre obtenida por sangrado retro orbital, se mezcló con oxalato de amonio 1 % durante 5 min, para lisar los eritrocitos y diluir leucocitos y trombocitos. Posteriormente, se depositó la muestra en la cámara de Neubauer y se dejó reposar de 5 a 10 min en cámara húmeda. Finalmente, se procedió al conteo de plaquetas en el cuadrante central completo (1 mm2) a 40x.
Análisis estadístico
Las posibles asociaciones establecidas no siguen una distribución normal, por lo que se utilizó la prueba no paramétrica de Mann-Whitney empleando el paquete estadístico GraphPad PRISM versión 2.00.
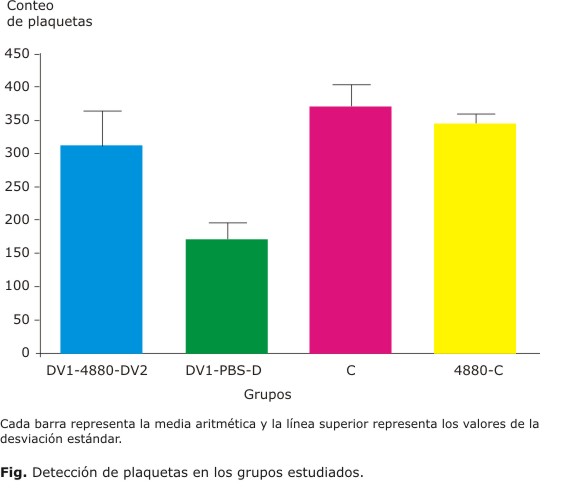
Como se puede apreciar en la figura, en los grupos DV1-48/80-DV2 y DV1-PBS-DV2 hay una disminución del conteo de plaquetas en relación con los grupos controles. El grupo D1-48/80-D2 no presenta significación respecto al grupo control. Esto pudiera indicar que en este grupo no hubo afectación de las plaquetas, sin embargo, al comparar los conteos de plaquetas entre este grupo con su grupo homólogo de infección secundaria D1-PBS-D2, así como con el grupo control, las diferencias observadas resultaron significativas (p= 0,0155 y p= 0,0002, respectivamente). Los conteos de plaquetas de los grupos controles C y C-48/80 mostraron valores semejantes, por lo que el compuesto inoculado no incidió en el parámetro.
Son escasos los trabajos que exploren la afectación del conteo de plaquetas en dengue en modelos animales. Un estudio realizado en ratones balb/c modificados genéticamente (SCID) e infectados con VD2, en el que se evaluó la trombocitopenia, mostró una disminución en el conteo de plaquetas en la infección secundaria 13 días después del evento infectivo.11
Desde el pasado siglo se habla acerca del importante papel que desempeñan las células cebadas o mastocitos en la aterogénesis y la ruptura plaquetaria, sin embargo, no son muchos los trabajos enfocados sobre su participación en la activación plaquetaria y la formación de trombos. Se conoce que sustancias liberadas por los mastocitos activados influyen potencialmente sobre la activación plaquetaria y los mecanismos de la hemostasis. Entre estas, los leucotrienos,12 tromboxanos A2,13 factor activador de plaquetas (PAF),14 prostaglandina E2,15 y moléculas de proteoglicanos de heparina de alto peso molecular.16
Es conocido que, además del receptor para IgE FceRI, el mastocito expresa en superficie constitutivamente los receptores de baja afinidad FcgRIIB and FcgRIIIA y de alta afinidad FcgRI.7 Tanto el FcgRIIIA como el FceRI son expresados en asociación con la misma subunidad de transducción de señales en los mastocitos de ratón, de manera que a través de la IgG, se pueden desencadenar las mismas respuestas biológicas.7
Gardiner y otros demostraron que la activación de los receptores FceRI induce una agregación parcial de las plaquetas.17 Teniendo en cuenta lo anterior, se pudiera establecer la hipótesis que los IC formados entre las partículas virales y las IgG en el grupo VD1-PBS-VD2 activarían la agregación plaquetaria a través de la unión a los receptores Fc eRI. Por el contrario, una menor afectación en el conteo de plaquetas en el grupo VD1-48/80-VD2 en relación con el grupo homólogo de infección secuencial, se explicaría por la ausencia de una población mayoritaria funcional de mastocitos peritoneales, que pudiera incidir tanto en poseer una progenie viral menor como en la no activación de las señales antes explicadas a través de los receptores de superficie.
No se ha demostrado severidad asociada al ADE en modelos animales in vivo. Sin embargo, un estudio in vivo realizado por Balsitis y otros,18 demuestra que al modificar genéticamente receptores Fc (AG 29), tiene lugar un incremento de la infección por dengue, quizá debido al fenómeno de inmunoamplificación.18
Teniendo en cuenta los antecedentes antes mencionados y los resultados de nuestro trabajo, se apuntan a que el mastocito pudiera estar involucrado en la disminución en el conteo de plaquetas. Sin embargo, para definir hasta qué punto su papel pudiera ser patogénico o protector, se necesitan más evidencias que contribuyan a aclarar su función en la patogénesis.
REFERENCIAS BIBLIOGRÁFICAS
1. King CA, Anderson R, Marshall JS. Dengue virus selectively induces human mast cell chemokine production. J Virol. 2002;76(16):8408-19.
2. Tuchinda M, Dhorranintra B, Tuchinda P. Histamine content in 24-hour urine in patients with dengue haemorrhagic fever. Southeast Asian J Trop Med Public Health. 1977;8(1):80-3.
3. Valeska H, Marc B, Christian T, Michael S. Advances in the understanding of mast cell function. J Haematol. 2008;10:1365-2141.
4. Amaral MM, Davio C, Ceballos A, Salamone G, Canones C, Geffner J, et al. Histamine improves antigen uptake and cross-presentation by dendritic cells. J Immunol. 2007;179:3425-33.
5. Mazzoni A, Siraganian RP, Leifer CA, Segal DM. Dendritic cell modulation by mast cells controls the Th1/Th2 balance in responding T cells. J Immunol. 2006;177:3577-81.
6. King C, Anderson R, Marshall J. Dengue virus selectively induces human mast cell chemokine production. J Virol. 2002;76:8408-19.
7. Benhamou M, Bonnerot C, Fridman WH, Daëron M. Molecular heterogeneity of murine mast cell Fc gamma receptors. J Immunol. 1990;44:3071-7.
8. Ilkka T, Harvim, Gunnar N. Mast cells as regulators of skin inflammation and immunity. Acta Derm Venereol. 2011;91:Epub ahead of print.
9. Mousli M, Bueb JL, Rouot B, Landry Y, Bronner C. G-proteins as targets for non-immunological histamine releasers. Agents Actions. 1991;33:81-3.
10. Nakayama Y, Mio M, Sugimoto Y, Fujii Y, Kamei C. Changes in membrane potential induced by compound 48/80 in the peritoneal mast cells of rats. Methods Find Exp Clin. Pharmacol. 2002;24(5):267-73.
11. Huang KJ, Li SY, Chen SC, Liu HS, Lin YS, Yeh TM, et al. Manifestation of thrombocytopenia in dengue-2-virus-infected mice. J Gen Virol. 2000;81(9):2177-82.
12. Freeland HS, Schleimer RP, Schulman ES, Lichtenstein LM, Peters SP. Generation of leukotriene B4 by human lung fragments and purified human lung mast cells. Am Rev Resp Dis. 1988;138:389-94
13. Peters SP, MacGlashan DWJ, Schulman ES, Schleimer RP, Hayes EC, Rokach J, et al. Arachidonic acid metabolism in purified human lung mast cells. J Immunol. 1984;132:1972-9.
14. Triggiani M, Fonteh AN, Chilton FH. Factors that influence the proportions of platelet-activating factor and 1-acyl-2-acetyl-sn-glycero-3-phosphocholine synthesized by the mast cell. Biochem J. 1992;286:497-503.
15. Schleimer RP, MacGlashan DWJ, Peters SP, Pinckard RN, Adkinson NFJ, Lichtenstein LM. Characterization of inflammatory mediator release from purified human lung mast cells. Am Rev Resp Dis. 1986;133:614-7.
16. Lassila R, Lindstedt K, Kovanen PT. Native macromolecular heparin proteoglycans exocytosed from stimulated rat serosal mast cells strongly inhibit platelet-collagen interactions. Arter Thromb Vasc Biol. 1997;17:3578-87.
17. Gardiner C, Harrison P, Chavda N, MacKie I. Platelet activation responses in vitro to human mast cell activation. Br J Haematol. 1999;1:208-15.
18. Balsitis SJ, Williams KL, Lachica R, Flores D, Kyle JL, Mehlhop E, et al. Lethal antibody enhancement of dengue disease in mice is prevented by Fc modification. PLoS Pathogens. 2010;6(2):1-13.
Recibido: 4 de abril de 2013.
Aprobado: 14 de octubre de 2013.
Gissel García Menéndez. Instituto de Medicina Tropical "Pedro Kourí". Autopista Novia del Mediodía. Km 6 ½. CP 17100. Marianao 13. AP 601. La Habana, Cuba. Correo electrónico: gmd@ipk.sld.cu