INTRODUCCIÓN
El síndrome febril es el incremento de la temperatura corporal sin conocimiento de causa, unido con síntomas de malestar general, escalofríos, falta de apetito y dolor de cabeza.1
Muchas afecciones presentan el síntoma de la fiebre como una de sus características clínicas principales y más frecuentes, por lo que es una manifestación que se le atribuye a muchas enfermedades. La causa más habitual del síndrome febril agudo son las enfermedades infecciosas seguidas por neoplasias, enfermedades del colágeno y enfermedades granulo matosas.1,2
Entre las principales patologías de tipo infeccioso que cursan como síndromes febriles agudos en las Américas se encuentran; dengue, malaria, chikungunya, zika, bartonelosis, fiebre de oropuche, fiebre de mayaro, fiebre amarilla, hantavirosis, arbovirosis del grupo C, encefalitis equina venezolana, influenza, Hantavirus, enfermedad por rickettsias , leptospirosis, brucelosis, salmonelosis, hepatitis A, B y C, peste bubónica, ehrlichiosis, sarampión, rubéola y enfermedad de Lyme, entre otras.1,2,3,4,5,6,7,8,9
No obstante, en el contexto epidemiológico de Colombia se le ha prestado especial atención solo algunas afecciones consideradas como urgentes, por lo que existe una mayor vigilancia y énfasis a dengue, fiebre amarilla, malaria y a las emergentes epidemias causadas por los virus zika y chikungunya. Por tal motivo la malaria y dengue que son endémicos en Colombia resultan a menudo sobre diagnosticados, mientras que otras son sub diagnosticadas como la leptospirosis, las infecciones por hantavirus y arenavirus, las rickettsiosis, la encefalitis equina venezolana, la infección por el virus chikungunya y zika o son mal diagnosticadas, y finalmente consideradas como dengue o malaria.2,3,9
La leptospirosis es una antropozoonosis causada por espiroquetas del género Leptospira; para el año 2019 se han confirmado 38 especies (13 patógenas, 12 intermedias y 13 saprofitas.1
La leptospirosis es un síndrome febril y los síntomas de la enfermedad en seres humanos tienen un amplio espectro. Todos los casos pueden ir desde infecciones subclínicas o asintomáticas, anictéricas, ictéricas, enfermedad febril leve a síndromes severos de padecimiento pulmonar y multiorgánica (fiebre hemorrágica pulmonar y el síndrome de Weil, respectivamente). El síndrome de Weil, es un síndrome con manifestaciones severas que se caracteriza por producir insuficiencia renal y hepática, cada una de estas manifestaciones puede cursar con complicaciones con alta probabilidad de muerte con altas tasas de mortalidad que llegan hasta el 70 %.1,3
Es una enfermedad reemergente debido a que se encuentra resurgiendo en brotes epidémicos y se pensaba que había disminuido su incidencia, pero aparece frecuentemente cobrando proporciones epidémicas. Es una enfermedad de distribución mundial por presentarse tanto en países desarrollados como en vía de desarrollo que presenten características climatológicas y geográficas, que favorecen la propagación y el mantenimiento de la enfermedad.1-3 La leptospirosis tiene una amplia distribución geográfica por el gran espectro de hospederos y reservorios mamíferos que mantienen la bacteria en sus riñones debido a que esta infecta y coloniza los túbulos proximales renales. Estos animales excretan en su orina de manera continua y muchas veces de forma crónica la espiroqueta al medio ambiente aumentando las probabilidades de infección de otros hospederos susceptibles.
A nivel mundial, 1,03 millones de personas se infectan anualmente y el número de muertes se estima en 58 900 por año. La Organización Mundial de la Salud (OMS) la clasifica como enfermedad tropical desatendida, y estimando una incidencia de 5,1 casos/100 000 personas en áreas endémicas y 14 casos/100 000 personas en brotes epidémicos; estas estimaciones ubican a la enfermedad entre primeras causas zoonóticas de morbilidad y mortalidad en el mundo.3
En el 2016, la incidencia de leptospirosis para Colombia fue de 0,59 casos/100 000 personas. Desde el año 2013 se ha tenido un descenso significativo en la notificación, ello estaría relacionado con el subregistro que existe en el país.4 El SIVIGILA, en la semana epidemiológica 25 del año 2018 notificó 1 217 casos de leptospirosis. Las entidades territoriales con mayor número de casos según procedencia fueron Antioquia, Tolima, Valle del Cauca y Bolívar con el 55,9 % de los casos. Estas notificaciones demuestran la circulación de Leptospira spp. en Colombia, sin embargo, en la actualidad la situación real de la enfermedad es desconocida y existe unao alto subregistro en la gran mayoría de las regiones del país.4
Habitualmente la infección se produce por contacto directo de piel lacerada o mucosas con orina, líquido uterino, placenta de animales infectados; pero primordialmente por el contacto con agua contaminada por la orina de los animales infectados que por lo general son roedores.5
El diagnóstico de la leptospirosis consta de una alta presunción clínica, dada por cuadro agudo de fiebre, escalofríos, malestar general, osteomialgias generalizadas, cefalea, náuseas y vómitos. Sin embrago, hay múltiples pruebas de laboratorio útiles para confirmar el diagnóstico: la serología es el método diagnóstico más común utilizado en el mundo. Aunque tradicionalmente, los métodos de diagnóstico en el laboratorio pueden dividirse en: directos (aislamiento, cultivo y técnicas moleculares) e indirectos o serológicos.10,11
El objetivo es describir por primera vez una serie de nueve casos que fueron sospechados inicialmente como síndrome febril agudo de origen desconocido en zona selvática del departamento del Amazonas colombiano.
PRESENTACIÓN DE SERIE DE CASOS
Se presentan 9 casos de pacientes que cursaron con síndrome febril agudo de origen desconocido. Se analizaron variables que incluían: edad, género, tiempo de aparición de síntomas, desplazamiento reciente, noción de contagio, procedencia, características clínicas y diagnósticos diferenciales.
El rango de edad de los pacientes estuvo entre 18 y 56 años con una media de edad de 38 años. Seis pacientes correspondieron al sexo masculino y tres al femenino. Todos los pacientes provenían de la misma zona geográfica, área urbana del municipio Puerto Nariño del departamento Amazonas, Colombia. Igualmente, tenían como ocupación ser pescadores, agricultores y/o aserradores. Todos tenían vacuna contra fiebre amarilla y niegan desplazamiento a otras zonas.
Al examen físico se encontraban conscientes y orientados. El tiempo promedio entre el inicio del cuadro clínico y la consulta fue de 7 a 30 días; siete pacientes presentaban síntomas de 1 semana de evolución y dos de 1 mes de evolución. Los síntomas fueron fiebre (66,7 %), cefalea (66,7 %), conjuntivitis (55,6 %), escalofríos (22,2 %), malestar general (11,1%), mareo (11,1 %), congestión nasal (11,1 %), dolor general (11,1 %), náuseas (11,1 %), artralgias (11,1 %) y astenia (11,1 %).
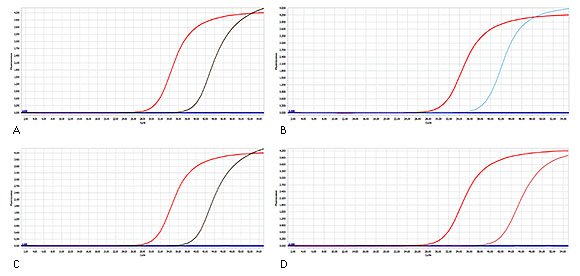
Aunque no se contó con exámenes paraclínicos, se sospechó que el síndrome febril podría estar asociado con malaria, arbovirus principalmente dengue, leptospirosis y/o rickettsiosis teniendo en cuenta el tiempo de evolución y datos obtenidos al momento de la atención. Inicialmente, se realizó gota gruesa y extendido de sangre periférica para detectar hemoparásitos y prueba serológica rápida SD BIOLINE dengue duo para el diagnóstico de dengue, ambas pruebas resultaron negativas para todos los pacientes. Finalmente, se encontró 9 pacientes positivos para rickettsias del grupo de las fiebres manchadas mediante inmunofluorescencia indirecta (IFI) y Leptospira por el método de reacción en cadena de la polimerasa (PCR) en tiempo real (tabla, Fig.).
Tabla Caracterización y diagnóstico de pacientes con síndrome febril
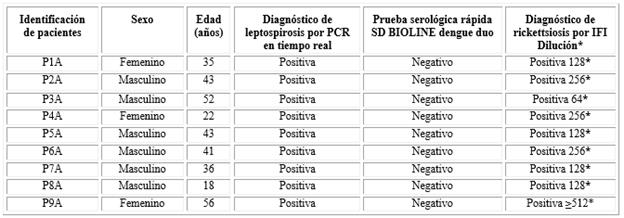
* Se considera positivo a partir de detección de títulos de anticuerpo en la dilución 64.
A: resultado positivo para el paciente P1A 35 años. B: resultado positivo para paciente P4A 22 años. C: resultado positivo para paciente P5A 43 años. D: resultado positivo para paciente P6A 41 años.
En todas las gráficas se muestra en rojo la curva de amplificación del ADN de cultivo de L. interrogans utilizado como control positivo y en azul se muestra el control negativo. En gris, azul, morado y rosado se muestra las amplificaciones de algunos pacientes.
Todos los pacientes refirieron contacto directo con roedores o convivir en lugares donde existían roedores. Los casos sucedieron en época de inundaciones, ninguno de los pacientes informó bañarse en fuentes de agua corriente, pero sí tener contacto con aguas estancadas. Finalmente, todos los pacientes tuvieron resolución de los síntomas sin medicación y no se presentaron casos fatales.
DISCUSIÓN
A pesar de que en 1998 la OMS propuso modificar el sistema de vigilancia internacional de enfermedades de notificación obligatoria, bajo el concepto de vigilancia sindrómica, incluyendo al síndrome febril, en Colombia se ha venido realizando la vigilancia y diagnóstico de los diferentes eventos que conforman el síndrome febril de manera independiente. Lo anterior, no fortalece el sistema, por el contrario, dificulta esclarecer el origen de los síndromes febriles.12
La literatura informa extensamente, la similitud sintomática que presentan el dengue y la leptospirosis en su fase inicial, lo cual propicia dificultades para un diagnóstico oportuno y la atención adecuada de los enfermos, así como para su notificación y clasificación. La leptospirosis es típicamente una enfermedad bifásica, una primera fase de leptospiremia que tiene un periodo de duración de 4 a 7 días, la cual se caracteriza por la presencia de Leptospira en sangre. La segunda fase llamada fase convaleciente, fase inmune o leptospiruria tiene un periodo de duración de 8 a 30 días, en la que ya no se detectan bacterias en sangre pero sí en orina; en esta fase se puede evidenciar la circulación de anticuerpos específicos.1,5,6,7
En el abordaje inicial de los casos, todos los pacientes presentaron fiebre, cefalea, conjuntivitis, escalofríos, malestar general, mareo, congestión nasal, dolor general, náuseas, artralgias y astenia sin evolución fatal. Estos síntomas son compatibles con alguna enfermedad febril tropical indiferenciada causada como malaria, dengue, rickettsiosis y/o leptospirosis.
Aunque no se sospechaba que los casos fueran leptospirosis debido a la epidemiología de la zona o por el desconocimiento de la circulación del patógeno, en esta serie de casos se demuestra por primera vez la circulación de la bacteria en el municipio Puerto Nariño-Amazonas. Adicionalmente, se informa circulación de rickettsias mediante evidencia serológica. El anterior, dato es similar a lo encontrado por Nuñez en el amazonas peruano.12,13
En el diagnóstico de la leptospirosis las muestras a utilizar depende de la fase de infección en la que se encuentre el paciente. La literatura reporta que durante los primeros siete días se puede detectar y aislar la bacteria en sangre, posteriormente el sistema inmune es activado y el número de bacterias en sangre disminuye completamente. También se puede emplear la orina a partir del séptimo día donde puede continuar la bacteria excretándose continuamente de manera crónica por semanas, meses o hasta años.7,8,9
Tradicionalmente, el diagnóstico de leptospirosis se efectúa empleando una mezcla de evidencias clínicas, prueba serológica de MAT, cultivo y características epidemiológicas. Además, se debe hacer diagnóstico diferencial con otras enfermedades que puedan presentar síndromes febriles como malaria, dengue, fiebre amarilla, hepatitis, meningoencefalitis, hantavirus y diferentes enfermedades que pueden manifestarse de manera similar dentro de un síndrome icterohemorrágico.7,8,9
Esta enfermedad es comúnmente diagnosticada por detección de anticuerpos (serodiagnóstico por microaglutinación); también se emplean otras técnicas, aunque no de rutina como el cultivo bacteriológico empleando muestras biológicas como sangre, tejidos u orina. Los medios de aislamiento empleados en Colombia son Fletcher y EMJH, los cuales se vigilan cada 7 días por periodo de tiempo mínimo de 3 meses. Esta técnica es costosa, lenta, de baja sensibilidad y a menudo puede sufrir contaminaciones, lo que obliga a no ser considerada de manera rutinaria.14,15 La prueba de campo oscuro en muestras de sangre y/o orina es otro método complementario, pero el diagnóstico negativo no es definitivo, debido a que esta metodología es de baja sensibilidad, técnicamente exigente y difícil visualización, porque reconocer las estructuras bacterianas es complejo por lo que requiere personal especializado, además se presentan con frecuencia falsos positivos por lecturas erróneas.14
Adicionalmente, se han empleado diferentes técnicas moleculares que detectan el ADN de la bacteria, como la PCR en tiempo real que es un método simple, rápido y de relativo bajo costo, específico y más sensible en la detección de Leptospira en sangre.16,17 En este sentido, todos los pacientes se les realizaron inicialmente diagnósticos diferenciales de síndrome febril como dengue y malaria el cual fue descartado por el resultado negativo para todos los pacientes, además se realizó diagnóstico de rickettsiosis mediante la prueba serológica IFI. Estos pacientes presentaban títulos de anticuerpo superiores de 64, lo cual indica resultado positivo que demuestra contacto previo o infección actual con Rickettsia del grupo de las fiebres manchadas. Esta última condición no se pudo establecer como infección por que no se realizó el análisis de muestras pareadas. Se debe verificar resultado serológico con una muestra pareada en aproximadamente 15 días después de la recolección de la primera muestra para evidenciar aumentos en títulos de anticuerpos y así definir infección actual; por estos motivos no es una prueba que muestre un resultado concluyente.
El diagnóstico para leptospirosis se realizó en muestras de sangre, previa extracción de ADN y posterior empleo de técnicas moleculares como PCR en tiempo real detectando el gen Lipl32 y 16s ribosomal (dato no mostrado) de Leptospira. Como resultado de dichas pruebas todos los pacientes fueron positivos para leptospirosis. El diagnóstico por PCR para muestras de sangre de pacientes febriles ya ha sido documentado18 y demuestra que los pacientes notificados, estaban en una fase de leptospiremia.
Epidemiológicamente, la leptospirosis es un problema de salud pública muy importante porque afecta el ámbito económico, pues se relaciona directamente con el aumento de gastos y costos generados por los pacientes que tienen que ser atendidos. Esto trasciende en gastos como tratamiento, algunas veces necesidad de hospitalización y muy frecuentemente diálisis renal.19,20
Entre 2012 y 2013, un estudio realizado en una zona tropical endémica del departamento Córdoba-Colombia, se encontró que las principales enfermedades asociadas a la aparición de síndrome febril indiferenciado en zonas tropicales fueron en su orden: leptospirosis, infección por virus dengue, hantavirus, malaria e infección rickettsial, etc.;8 aunque son datos que no se puede extrapolar a nivel nacional, puesto que son resultados de una determinada región en un momento específico. Sumado a lo anterior, existen estudios en los que se ha demostrado la presencia de coinfecciones de estos los microorganismos mencionados con otros agentes etiológicos.8,21 Pero estos hallazgos abren la posibilidad para pensar en otros agentes causales diferentes a virus dengue y malaria, que esporádicamente estén causando brotes en determinada región para que se tengan en cuenta en la batería de pruebas diagnósticas a utilizar por los centros de salud.
Al contrario de la leptospirosis, el dengue y la malaria son enfermedades que prende las alarmas en nuestro país, debido al gran número de casos que se presentan.12 En el 2016, los casos de enfermedades infecciosas notificados en el departamento Amazonas por el SIVIGILA reflejaron: 3 412 casos de malaria, 121 casos de dengue en zona urbana del municipio Leticia de los cuales 1 evolucionó a dengue grave y 12 casos de leptospirosis. Sin embargo, para el 2017 hasta la semana epidemiológica 26, el acumulado de casos para leptospirosis en el departamento Amazonas fue de solo dos casos, lo que contrasta con lo encontrado en este estudio. Lo anterior, demuestra el subregistro que se tiene para esta etiología y las dificultades que presentan las autoridades sanitarias para hacerles seguimiento.
En el municipio Puerto Nariño-Amazonas, como en gran parte del país no se cuenta con adecuadas condiciones para la prestación de servicios de diagnóstico de rutina. Incluso, muchos de los casos que quedan sin diagnóstico y tratamiento oportuno, se deben a que las instituciones prestadoras de servicios de salud, por dificultades económicas, no realizan la prueba diagnóstica de ELISA IgM a pesar de estar en el plan obligatorio de salud.12 Bajo esta perspectiva las pruebas de diagnóstico molecular de alta sensibilidad tampoco estarían al alcance del servicio diagnóstico local; por este motivo se hace necesario revisar algunas pruebas de diagnóstico rápido como las pruebas serológicas para IgM, las cuales podrían ser útiles y de fácil acceso para los servicios de salud local.
En conclusión, se evidenció en sintomáticos febriles la exposición por Rickettsias del grupo de las fiebres manchadas y se describió por primera vez, de manera emergente la circulación de leptospiras en el municipio Puerto Nariño en la Amazonia colombiana; este diagnóstico se realizó utilizando la detección directa de la bacteria por medio de la metodología de PCR en tiempo real empleando como blanco molecular el gen LipL32, presente únicamente en leptospiras patógenas y de patogenicidad intermedia.