Introducción
La malaria o paludismo es una enfermedad endémica en más de 90 países y afecta aproximadamente al 40 % de la población mundial con alto impacto en la salud pública.1 Sus agentes etiológicos son parásitos unicelulares pertenecientes al género Plasmodium, de los cuales, P. falciparum, P vivax, P. ovale, P. malariae y P. knowlesi afectan al ser humano, al ser transmitidos después de la picadura de mosquitos hembras del género Anopheles.1,2,3) Los pacientes afectados por esta enfermedad en África y Américas representan el 95 % de la carga mundial de la enfermedad, aunque se reporta en los últimos años un descenso del 44 % y 39 % en la tasa de mortalidad en estas dos regiones, respectivamente.4 El paludismo causado por P. falciparum representa más del 90 % de los casos mortales por malaria en el mundo; sin embargo, se han descrito manifestaciones graves por P. vivax y P. knowlesi con alto potencial de letalidad.1,2,3,4
A pesar de que la mortalidad por malaria ha disminuido en los últimos años, según la Organización Mundial de la Salud, se conoce que un gran número de personas permanece en riesgo de adquirir la infección y desarrollar complicaciones.3,4 Factores como la especie de Plasmodium, el sexo, la edad, el estado nutricional e inmunológico, lugar de residencia, acceso a servicios de salud, diagnóstico temprano, tratamiento adecuado y oportuno, así como la adherencia a este, influyen de manera permanente en el desarrollo de la malaria complicada (MC).4,5
En Colombia, según cifras oficiales del Instituto Nacional de Salud, en la semana epidemiológica número 24 de 2021, se notificaron 302 casos nuevos de malaria, alcanzando un acumulado total de 29 754 casos en lo corrido de este año; la especie predominante continúa siendo P. falciparum con el 51,0 % de casos, seguida de P. vivax con el 48,2 % y finalmente la infección mixta por P. falciparum y P. vivax con el 0,8 %.6 Del total de casos acumulados, el 1,8 % corresponde a MC provenientes principalmente de los departamentos de Nariño, Antioquia, Chocó, Córdoba, Cauca, Meta y Vichada. En estos departamentos las complicaciones más frecuentes fueron hematológicas (74,2 %), hepáticas (15,6 %), renales (5,5 %), pulmonares (2,3 %) y malaria cerebral (2,1 %).6,7 De estos casos, los hombres representaron el 59,3 % de la población afectada, las personas con edades entre 15 a 29 años, el 42,3 %, los afrocolombianos, el 26,5 %, el 42,5 % de casos provenían del área rural dispersa y el 65,6 % correspondió al régimen subsidiado de salud.7
El reconocimiento temprano de los sujetos que pueden desarrollar complicaciones por malaria es fundamental para orientar el tratamiento, establecer el lugar de atención y así reducir el riesgo de muerte.8 Se ha encontrado que la infección por P. falciparum, con niveles altos de parasitemia y niveles de hemoglobina (Hb) < 8,5 g/dL se relaciona con puntajes elevados de la escala de evaluación de fallo orgánico secuencial (SOFA, por sus siglas en inglés) y el desarrollo del síndrome de disfunción multiorgánica; lo anterior en relación con niveles séricos elevados del factor de necrosis tumoral alfa, citoquina proinflamatoria relacionada de manera directamente proporcional con el compromiso sintomático, evolución clínica y riesgo de complicaciones, lo que sugiere que una evaluación clínica conjunta entre signos, síntomas y exámenes paraclínicos básicos podría ser una herramienta útil para evaluar el compromiso sistémico y establecer el pronóstico de pacientes con malaria.
No obstante, actualmente no hay instrumentos de predicción basados en características clínicas para predecir el desarrollo de complicaciones por esta enfermedad.1,3,8,9 El objetivo de este estudio fue desarrollar y validar una herramienta de predicción clínica y paraclínica de complicaciones en pacientes con diagnóstico confirmado de malaria.
Métodos
Se realizó un estudio de cohorte retrospectivo en sujetos de diferentes regiones del territorio colombiano con diagnóstico de malaria, atendidos en hospitales de segundo y tercer nivel de complejidad entre los años 2010 a 2020.
Fueron seleccionados los pacientes, independientemente del sexo y la edad, con el diagnóstico de malaria confirmada mediante gota gruesa. Se excluyeron sujetos con antecedentes de síndrome convulsivo, secuelas neurológicas por cualquier causa, enfermedad renal, hepática, hematológica o pulmonar en estadio avanzado o en periodo de agudización. Los datos fueron recolectados por el grupo de investigación revisándose de manera secuencial y no probabilística un total de 2396 sujetos, de los cuales ingresaron al análisis final 584 sujetos para la cohorte de derivación y 898 sujetos para una cohorte de validación; esta última utilizada para aplicar el modelo probabilístico obtenido fuera del ambiente donde fue creado y disminuir así la probabilidad de proporcionar conclusiones erróneas.10
La información fue obtenida de los registros de historias clínicas de hospitales de referencia de las regiones Pacífica, Orinoquia y Andina, tanto al ingreso como durante la evolución clínica diaria de la estancia hospitalaria para construir una base inicial de derivación y posteriormente una base de validación. Para disminuir los sesgos de transcripción, las historias clínicas fueron sometidas a revisión y los datos fueron verificados al momento del registro electrónico por personal del grupo de investigación.
Se consideraron como variables de estudio características demográficas, del cuadro clínico, hallazgos al examen físico, paraclínicos, tratamiento, el requerimiento de ventilación mecánica invasiva (VMI), soporte vasopresor y compromiso pulmonar, hematológico y multiorgánico.
La información se consolidó en una base de datos en el programa Microsoft Office Excel 2016, para posteriormente ser analizada en el programa SPSS-25. Se realizó un análisis inicial descriptivo donde las variables continuas se resumieron como medias y desviaciones estándar si la distribución era normal y como medianas y rangos intercuartil si la distribución no era normal. Las variables categóricas se resumieron en frecuencias y proporciones. Se realizó un análisis bivariado comparando las variables cuantitativas con T de student o U de Mann Whitney dependiendo de su distribución y las variables cualitativas se compararon con la prueba de chi cuadrado. Para la construcción de puntaje pronóstico se tomaron en cuenta las variables que se relacionaran con el desarrollo de MC y cumplieran los criterios de plausibilidad biológica y significación estadística. Las variables que cumplían con estos criterios fueron ingresadas a un modelo de regresión logística, las variables que mantenían significación estadística en el análisis multivariado con el desenlace de MC fueron las que se utilizaron para construir el puntaje de predicción; con la razón de momios (OR, por sus siglas en inglés) se estimó el valor numérico que adoptaría cada una de las variables en el puntaje pronóstico final para la predicción de complicaciones, el puntaje pronóstico obtenido de la cohorte de derivación fue evaluado en la cohorte de validación.
Finalmente, para cada sujeto que ingresó al estudio se realizó el cálculo individual del puntaje y de esta manera calcular en la cohorte de derivación y validación la sensibilidad, especificidad, valor predictivo positivo, valor predictivo negativo, razón de verosimilitud positiva y razón de verosimilitud negativa, de acuerdo con las diferentes puntuaciones posibles que se podrían obtener con el puntaje pronóstico. Se calculó el área bajo la curva de las características operativas del receptor (ROC, por sus siglas en inglés) del puntaje pronóstico con el desarrollo o no de MC, y se consideró excelente de 0,97 a 1, muy buena de 0,9 a 0,96, buena de 0,75 a 0,89, regular de 0,6 a 0,74 y mala si fue menor de 0,6. Se utilizó el índice de Youden (sensibilidad + especificidad/1) para escoger el mejor punto de discriminación y se consideró una p estadísticamente significativa < 0,05.
El protocolo fue revisado y aprobado por el Comité de Ética e Investigación de la Universidad de la Sabana. Al ser un estudio retrospectivo no se consideró necesario el consentimiento informado de los sujetos de investigación. Se siguieron todas las recomendaciones de la resolución 8430 de 1993 para investigación con seres humanos y de la Ley Habeas Data para la protección de datos personales.
Resultados
La incidencia de MC fue del 21,2 % en la cohorte de derivación y del 11,2 % en la de validación; los sujetos provenían de las regiones de la Orinoquia, Amazonas, Casanare, Meta y Pacífico; la duración en días de los síntomas fue de 9,22 (DE:10,52) en la cohorte de derivación y 10,35 (DE:20,67) en la cohorte de validación. Las variables que mostraron diferencia estadísticamente significativa con el desarrollo de MC tanto en la cohorte de derivación como de validación fueron sexo, disnea, tos, fiebre persistente, hemoglobina, hematocrito, bilirrubina total, bilirrubina directa y nitrógeno ureico, excepto el tiempo promedio de los síntomas, vómitos, tabaquismo y bilirrubina indirecta. En la tabla 1 se muestran las características de los pacientes incluidos de la cohorte de derivación y validación del estudio.
Tabla 1 Características generales de los sujetos con diagnóstico de malaria. Colombia, 2010-2020
| Variables | Cohorte de derivación | Cohorte validación | ||||
|---|---|---|---|---|---|---|
|
|
|
Valor P |
|
|
Valor P | |
| Edad años x (DE) | 24,73 (7,67) | 25,36 (6,16) | 0,399 | 23,84 (19,67) | 26,06 (16,38) | 0,278 |
| Peso kg x (DE) | 65,42 (10,47) | 64,55 (11,23) | 0,438 | 24,23 (9,64) | 25,76 (13,73) | 0,054 |
| Sexo hombres n (%) | 119 (95,9) | 454 (98,7) | 0,047 | 47 (46,5) | 274 (34,3) | 0,016 |
| Tiempo de síntomas días x (DE) | 9,22 (10,52) | 7,85 (6,34) | 0,168 | 10,35 (20,67) | 6,62 (7,53) | 0,073 |
| Disnea n (%) | 36 (29,0) | 30 (6,5) | <0,001 | 7 (6,9) | 18 (2,2) | 0,007 |
| Tos n (%) | 10 (8,0) | 24 (5,2) | 0,024 | 12 (11,8) | 35 (4,3) | 0,001 |
| Vómito n (%) | 66 (53,2) | 171 (37,1) | 0,054 | 18 (17,8) | 207 (25,9) | 0,075 |
| Tabaquismo n (%) | 37 (29,8) | 138 (30,0) | 0,148 | 47 (46,5) | 15 (10,5) | 0,009 |
| Fiebre persistente n (%) | 31 (25,0) | 34 (7,3) | <0,001 | 8 (7,9) | 25 (3,1) | 0,016 |
| Hemoglobina g/dL x (DE) | 12,23 (2,95) | 13,40 (2,32) | <0,001 | 8,43 (3,48) | 12,35 (2,53) | <0,001 |
| Hematocrito % x (DE) | 36,04 (8,20) | 39,67 (6,44) | <0,001 | 24,93 (9,83) | 36,77 (6,86) | <0,001 |
| Bilirrubina total x (DE) | 4,77 (6,81) | 2,64 (2,39) | 0,001 | 4,35 (4,53) | 2,47 (4,03) | <0,001 |
| Bilirrubina indirecta x (DE) | 2,19 (2,88) | 1,67 (1,75) | 0,056 | 1,51 (1,48) | 1,38 (3,21) | 0,482 |
| Bilirrubina directa x (DE) | 3,12 (4,80) | 0,98 (1,44) | <0,001 | 2,37 (3,78) | 1,28 (2,48) | <0,001 |
| Nitrógeno ureico x (DE) | 18,32 (19,78) | 13,06 (9,14) | 0,004 | 19,09 (14,50) | 15,19 (8,97) | 0,008 |
| Glucemia x (DE) | 96,87 (20,87) | 104,34 (22,56) | 0,001 | 123,12 (83,55) | 106,75 (40,95) | 0,053 |
Leyenda: x: promedio; DE: desviación estándar.
En la cohorte de derivación, el 52,4 % de los sujetos presentaba MC con Plasmodium vivax frente al 68,5 % sin complicaciones durante la enfermedad (p < 0,001), mientras que Plasmodium falciparum se encontró en el 55,7 % de los sujetos con MC frente al 43,5 % de los que no se complicaron. En la cohorte de validación, la gota gruesa fue positiva a las 24 h en el 9,90 % de los sujetos con MC, situación que se elevó al 12,87 % a las 48 h de seguimiento. La administración de antimaláricos como la quinina en la cohorte de derivación fue del 33 % en sujetos con MC frente al 8,2 % de pacientes sin complicaciones (p < 0,001). Por el contrario, en la cohorte de validación al 49 % de los pacientes con malaria no complicada se le administró primaquina frente el 32 % con MC (p = 0,003).
En la cohorte de derivación el 16,94 % y 1,71 % de los pacientes con MC requirieron VMI y soporte vasopresor frente al 2,97 % y 25,7 % de la cohorte de validación. Entre los sistemas de mayor compromiso en paciente con MC se evidenció el pulmonar (22,58 % de la cohorte de derivación y 93,07 % de sujetos con complicaciones hematológicas de la cohorte de validación). El 50,81 % de los sujetos en la cohorte de derivación presentó síndrome de disfunción multiorgánica frente al 2,61 % de la cohorte de validación.
Las variables que mostraron diferencias estadísticamente significativas y plausibilidad biológica para el desarrollo de MC fueron edad, sexo, antecedente de malaria, uso de antimaláricos previos, disnea, temperatura al ingreso, fiebre persistente, hemoglobina, hematocrito, bilirrubina total, nitrógeno ureico, glucemia, presencia de Plasmodium vivax y Plasmodium falciparum. De estas, las variables que mostraron relación estadísticamente significativa en el análisis multivariado fueron disnea (p < 0,001), fiebre persistente (p = 0,040), hemoglobina < 13 g/dL (p = 0,046), bilirrubina total (p = 0,038), nitrógeno ureico > 20 mg/dL (p = 0,046) y Plasmodium vivax (p = 0,008). En la tabla 2 se muestran los OR crudos y los resultados del análisis multivariado, además de los valores asignados para cada variable que compone el puntaje pronóstico final. La variable de Plasmodium falciparum mostró un valor p = 0,71 al final del modelo logístico.
Tabla 2 Análisis multivariado de variables con resultados significativos y valores asignados al puntaje. Colombia, 2010-2020
| Variables | Cohorte de derivación | Valor asignado en el puntaje | |||
|---|---|---|---|---|---|
| OR (IC 95 %) | OR ajustado (IC 95 %) | Valor p | Variable presente | Variable ausente | |
| Disnea | 5,9 (3,4-10,0) | 3,5 (1,8-6,9) | < 0,001 | 6,0 | 0 |
| Fiebre persistente | 3,5 (2,0-6,0) | 2,0 (1,0-4,0) | 0,040 | 3,5 | 0 |
| Hemoglobina < 13 g/dL | 2,6 (1,7-3,8) | 1,1 (1,1-1,2) | < 0,001 | 2,5 | 0 |
| Bilirrubina total > 6 mg/dL | 3,2 (1,8-5,5) | 1,1 (1,0-1,2) | 0,038 | 3,0 | 0 |
| Nitrógeno ureico > 20 mg/dL | 1,7 (1,0-2,7) | 1,0 (1,0-1,1) | 0,021 | 2,0 | 0 |
| Plasmodium vivax | 0,5 (0,3-0,8) | 0,5 (0,3-0,8) | 0,008 | -0,5 | 0 |
Leyenda: OR: razón de momios.
El área bajo la curva de características operativas del receptor del puntaje pronóstico para la predicción de MC en la cohorte de derivación fue de 0,70 (IC 95 %; 0,65-0,76) (p < 0,001) y en la cohorte de validación de 0,69 (IC 95 %; 0,64-0,74) (p < 0,001), lo que se consideró como un rendimiento regular. El índice de Youden más alto se obtuvo con un punto de corte de 3,5 del puntaje, donde se obtuvo una sensibilidad del 55,2 % y especificidad del 82,0 % en la cohorte de derivación y sensibilidad del 13,3 % y especificidad del 83,6 % en la cohorte de validación. En la figura 1 se muestran las áreas bajo la curva de características operativas del receptor del puntaje y en la tabla 3 se observan los diferentes valores obtenidos del puntaje pronóstico en las cohortes de derivación y validación con sus respectivos valores de sensibilidad, especificidad, valor predictivo positivo (VPP) y valor predictivo negativo (VPN) en relación con el desarrollo de MC.
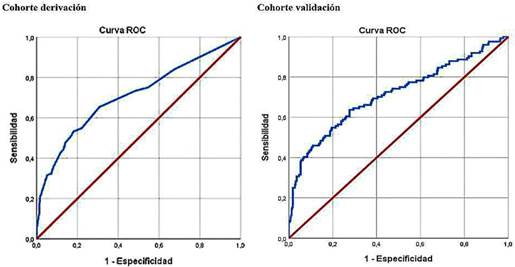
Fig. 1 Áreas bajo la curva de características operativas del receptor del puntaje, en relación con el desarrollo de malaria complicada. Colombia, 2010-2020.
Tabla 3 Puntaje total, sensibilidad, especificidad y valores predictivos. Colombia, 2010-2020
| Puntaje total | Cohorte de derivación | Cohorte validación | ||||||
|---|---|---|---|---|---|---|---|---|
| Sensibilidad % | Especificidad % | VPP | VPN | Sensibilidad % | Especificidad % | VPP | VPN | |
| -0,5 | 100 | 0 | 21,2 | 89,3 | 100 | 0 | 20,4 | 87,4 |
| 1 | 84,4 | 33,3 | 25,3 | 87,8 | 83,8 | 7,6 | 24,7 | 86,4 |
| 1,5 | 75,8 | 45,4 | 27,3 | 87,2 | 64,2 | 2,0 | 26,8 | 86,1 |
| 2 | 73,4 | 51,5 | 28,4 | 88,3 | 62,4 | 7,9 | 27,8 | 87,3 |
| 2,5 | 65,7 | 69,3 | 36,4 | 86,3 | 44,4 | 8,9 | 28,6 | 85,2 |
| 3 | 55,2 | 77,9 | 40,3 | 86,1 | 15,7 | 31,7 | 34,5 | 85,8 |
| 3,5 | 53,1 | 82,0 | 44,6 | 85,2 | 13,3 | 65,3 | 40,6 | 83,6 |
| 4 | 51,9 | 83,2 | 44,7 | 85,0 | 13,0 | 67,3 | 41,8 | 84,9 |
| 4,5 | 48,3 | 86,0 | 47,4 | 84,3 | 11,3 | 67,3 | 43,2 | 83,1 |
| 5 | 44,6 | 86,8 | 48,2 | 84,1 | 8,3 | 72,3 | 45,9 | 85,6 |
| 5,5 | 43,5 | 88,3 | 49,7 | 83,7 | 7,2 | 79,2 | 46,4 | 82,7 |
| 6 | 35,4 | 91,9 | 50,3 | 83,1 | 4,8 | 80,2 | 48,2 | 81,7 |
| 6,5 | 33,8 | 92,9 | 55,6 | 82,3 | 4,0 | 82,2 | 45,4 | 80,9 |
| 7,5 | 32,7 | 93,4 | 57,4 | 82,1 | 4,0 | 84,2 | 53,5 | 80,4 |
| 8 | 31,1 | 94,9 | 58,3 | 81,9 | 3,4 | 85,1 | 57,4 | 80,1 |
| 8,5 | 26,3 | 96,7 | 60,3 | 81,5 | 1,9 | 88,1 | 58,3 | 79,4 |
| 9 | 22,6 | 98,1 | 62,5 | 81,3 | 1,1 | 91,1 | 60,4 | 75,3 |
| 9,5 | 20,1 | 98,5 | 74,5 | 80,4 | 5,5 | 95,0 | 62,4 | 73,4 |
| 10 | 18,6 | 98,5 | 78,4 | 80,1 | 0,6 | 95,1 | 66,5 | 72,1 |
| 10,5 | 18,2 | 98,7 | 78,9 | 79,6 | 0,5 | 65,5 | 67,4 | 70,9 |
| 11 | 15,3 | 98,7 | 74,7 | 79,3 | 0,5 | 76,4 | 73,5 | 70,2 |
| 11,5 | 12,9 | 98,7 | 81,3 | 79,0 | 0,1 | 92,1 | 75,4 | 69,7 |
| 12 | 8,9 | 99,5 | 87,4 | 78,5 | 7,6 | 92,4 | 84,3 | 69,1 |
| 12,5 | 5,5 | 99,6 | 92,5 | 78,2 | 3,5 | 96,5 | 89,4 | 68,7 |
| 13 | 6,5 | 99,7 | 100 | 77,7 | 5,4 | 94,6 | 94,2 | 67,1 |
Leyenda: VPP: valor predictivo positivo; VPN: valor predictivo negativo.
Discusión
La MC representa una alteración multisistémica que incluye compromiso neurológico, anemia grave, sangrado significativo, edema pulmonar, síndrome de distrés respiratorio agudo, falla renal, ictericia, hipoglucemia, choque, acidosis metabólica e hiperparasitemia.3,9 De ahí que puntajes como el SOFA han sido evaluados para determinar la gravedad en pacientes con malaria. Helbok y otros en dos cohortes distintas, una 22 de pacientes con malaria no complicada y otra con 29 pacientes con MC, encontraron una correlación positiva entre el puntaje de SOFA y la gravedad de los síntomas, duración de la hospitalización y tasa de complicaciones mayores;11,12 en cambio, nuestro puntaje, a pesar de tener algunas variables diferentes al SOFA, mostró un buen rendimiento tanto en la cohorte de derivación como de validación. Otros puntajes que evalúan el compromiso multisistémico, como el sistema II de clasificación fisiológica de enfermedades agudas y crónicas (APACHE-II, por sus siglas en inglés), son ampliamente utilizados para estimar la posibilidad de un curso grave de la malaria y mortalidad. Sin embargo, el número de variables que utiliza el APACHE-II puede limitar su utilización en áreas geográficas apartadas y hospitales con recursos limitados donde generalmente se presenta esta enfermedad.13 Las variables en nuestro puntaje pueden ser obtenidas en centros de atención con laboratorio básico y a un costo más bajo.
En el presente estudio, se desarrolló y validó un sistema de puntuación pronóstico para MC. Las variables estadísticamente significativas para la predicción de MC y que conforman el puntaje pronóstico fueron la disnea, fiebre por más de 72 h (fiebre persistente), hemoglobina < 13 g/dL, bilirrubina total > 6 mg/dL, nitrógeno ureico > 20 mg/dL e infección por Plasmodium vivax, esta última asociada como factor protector de MC. La tasa de complicaciones se presentó predominante en los sistemas hematológico, pulmonar, renal y cardiovascular condiciones que se relacionan con el requerimiento de VMI y soporte vasopresor, situación que se presenta con relativa frecuencia en los sujetos que se complican por paludismo.14,15
El puntaje pronóstico desarrollado mostró un rendimiento similar en el área bajo la curva de características operativas del receptor en la cohorte de derivación y validación, situación favorable en el desarrollo de reglas de predicción clínica y procesos de extrapolación.10 A un puntaje de 3,5 obtenido con el mayor índice de Youden, se encuentra una baja sensibilidad y un alto valor predictivo negativo que indicaría una baja probabilidad de desarrollar MC. No obstante, la utilización de puntajes pronósticos puede alertar sobre la presencia de variables o condiciones que ameriten mayor seguimiento y estudios complementarios; de ahí que obtener un puntaje de 1,5 o 2 donde la sensibilidad aumenta, hace necesario la observación o realización de pruebas de laboratorio específicas para una evaluación completa del paciente. Las variaciones en los VPN y VPP obtenidos en el estudio pueden explicarse por las diferencias en la frecuencia de MC en la cohorte de derivación y validación.
Mishra y otros16 evaluaron un modelo predictivo de progresión a MC, nombrado puntuación de malaria para adultos (MSA, por sus siglas en inglés) en 248 sujetos, el puntaje varió de 0 a 10 e incluyó variables como requerimiento de VMI, choque circulatorio, pH < 7,25, entre otras, y reportaron una tasa de complicaciones y mortalidad del 40 % para un puntaje MSA 5 a 6, sensibilidad del 89,9 % y un VPP del 94,1 %. A diferencia de nuestro estudio, el MSA incluye el requerimiento de soporte avanzado como VMI y choque circulatorio como variables independientes para fallecimiento. Nuestro objetivo fue principalmente detectar los pacientes que se pueden llegar a complicar y requerir este tipo de soporte avanzado como variables de desenlace, y de esta manera poder influir en estadios más tempranos de la enfermedad.
Los puntajes que estiman la gravedad de la malaria, complicaciones y mortalidad requieren ser simples y reproducibles para permitir una priorización terapéutica rápida y adecuada en pacientes que se encuentren en estadios tempranos. Hanson y otros17 describieron un modelo de predicción simple para la identificación de pacientes con mayor riesgo de complicaciones: Coma Acidosis Malaria (CAM) en pacientes adultos con MC por Plasmodium falciparum. El modelo contiene las variables choque, oligoanuria, disglucemia, frecuencia respiratoria, escala de Glasgow y fiebre. Con una puntuación de CAM < 2 se identificó al 96,4 % (IC 95 %, 93,1 - 98,5) de los pacientes supervivientes que pueden llegar a ser tratados de forma segura en el servicio de urgencias u hospitalización, en caso de no tener disponibilidad de una unidad de cuidados intensivos. Datos similares informaron Newton y otros,18 en un análisis retrospectivo de 988 con MC con una ROC de 0,97. No obstante, estos estudios evaluaron la población en hospitalización o unidad de cuidados intensivos con estadios clínicos más tardíos de la enfermedad y una mayor probabilidad de desenlaces fatales.
La prevalencia de infección por los géneros Plasmodium spp. ha variado entre los estudios existentes debido a los diferentes patrones geográficos o áreas endémicas de distribución del parásito.19,20,21 Nuestro estudio mostró una mayor prevalencia del P. falciparum en ambas cohortes, seguida de P. vivax e infección mixta entre los pacientes con MC. Sin embargo, solo se asoció significativamente como factor protector para MC el estar infectado por Plasmodium vivax. Grigg y otros22 emplearon un modelo de regresión logística con el fin de predecir la gravedad de la infección por Plasmodium knowlesi en una cohorte de 481 pacientes, y encontraron predictores independientes de la gravedad como la edad avanzada, dolor abdominal y disnea. Esta última variable también encontrada en nuestro resultado como un predictor útil para el desarrollo de complicaciones.
Entre las debilidades de nuestro estudio se encuentran la obtención de datos a través de registros clínicos, los cuales pueden estar sujetos a errores en el momento de su realización, aunque las personas del equipo de investigación tienen experiencia para la toma e interpretación adecuada de este tipo de datos. Entre las fortalezas se encuentra un buen número de pacientes de diferentes regiones del país que ingresaron a las cohortes de derivación y validación. En este estudio, no se realizó un análisis con desenlaces de mortalidad dada la baja frecuencia de este evento en la población que se atendía en los diferentes centros hospitalarios, por lo que puede ser objetivo de futuras investigaciones la validación de este cuestionario propuesto con desenlaces de mortalidad.
Conclusión
Un puntaje pronóstico en pacientes con malaria que evalúe la presencia de disnea, fiebre persistente, nivel de hemoglobina, bilirrubina total, nitrógeno ureico e infección por P. vivax, puede ser útil para clasificar de manera oportuna y objetiva los sujetos con esta infección que pueden desarrollar complicaciones. La información obtenida con este puntaje puede ser útil para el médico en la toma de decisiones en relación con el tratamiento y sitio de cuidado que pueden necesitar estos pacientes.















