Introducción
La tripanosomiasis africana humana (TPH), también llamada enfermedad del sueño, es una parasitosis producida por protozoos del género Trypanosoma, transmitida fundamentalmente por la picadura de la mosca hematófaga tse-tsé (género Glossina), infectada por otras personas o animales que albergan sus formas infectantes.1,2,3,4,5,6,7 Fue David Bruce quien en 1903 reconoce su papel trasmisor.6
La infección es producida por Trypanosoma brucei gambiense en las regiones occidental y central de África y por T. brucei rhodesiense en la región oriental; ambas especies son endémicas en Uganda2,4,5 (Fig. 1).
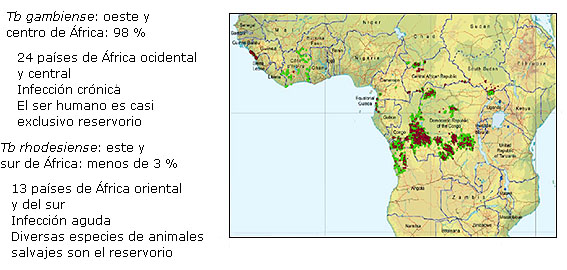 Tomado de: Franco JR, Cecchi G, Priotto G, Paone M, Diarra A, Grout L, et al. Monitoring the elimination of human African trypanosomiasis at continental and country level: Update to 2018. PLoS Negl Trop Dis. 2020;14(5):e0008261. DOI: https://doi.org/10.1371/journal.pntd.0008261
Tomado de: Franco JR, Cecchi G, Priotto G, Paone M, Diarra A, Grout L, et al. Monitoring the elimination of human African trypanosomiasis at continental and country level: Update to 2018. PLoS Negl Trop Dis. 2020;14(5):e0008261. DOI: https://doi.org/10.1371/journal.pntd.0008261
Fig. 1 Distribución geográfica de la tripanosomiasis africana en 2018. En rojo se marca la forma causada por Trypanosoma brucei gambiense y en azul la causada por T. brucei rhodesiense. Las zonas de vigilancia activa donde no se ha detectado ningún caso están indicadas en verde.
La enfermedad se encuentra localizada en África tropical donde se distribuye precisamente la mosca tsé-tsé entre los paralelos 15° norte y 20° sur, donde existen las condiciones climáticas apropiadas para la proliferación de aproximadamente 31 subespecies de esta mosca: sabanas secas, áreas boscosas y llanuras de África oriental; grandes bosques en África central/occidental, vegetación ribereña de ríos y arroyos.8
Por razones hasta la fecha inexplicables, no todas las especies de moscas transmiten la enfermedad; pues este insecto vive en muchas regiones donde no se presenta. La incidencia varía de un país a otro y dentro de un mismo país, de una región y aldea a otra. La enfermedad del sueño es la primera o segunda causa de mortalidad en esas comunidades, incluso más frecuente que el VIH/sida.1,3
Las personas que están más expuestas al contacto con la mosca tse-tsé y, por consiguiente, de contraer la enfermedad, son los habitantes de las zonas rurales que se dedican a la agricultura, la pesca, la ganadería o la caza. Por añadidura, el desplazamiento de grupos humanos, las guerras y la pobreza son factores que propician el aumento de la transmisión y esto altera la distribución de la enfermedad como consecuencia de la debilidad o inexistencia de los sistemas de salud.1,3
En el último siglo ha habido varias epidemias en África:1,3
Entre 1896 y 1906, principalmente en Uganda y la Cuenca del Congo.
Varios países fueron afectados en 1920, lo cual fue controlado gracias a la labor de equipos móviles que organizaron el tamizaje de millones de personas en riesgo. Para mediados del decenio de 1960 la enfermedad estaba controlada, y en todo el continente se notificaron menos de 5000 casos.
Tras el éxito obtenido, la vigilancia se relajó y la enfermedad reapareció en 1970, prolongándose hasta finales del decenio de 1990, cuando la cooperación bilateral y las organizaciones no gubernamentales lograron invertir la tendencia. En 1988, se notificaron unos 40 000 casos, pero se calcula que 300 000 casos no fueron diagnosticados y, por lo tanto, no recibieron tratamiento.
Gracias a las iniciativas sostenidas de control de la enfermedad, en 2009, el número de casos notificados se redujo a 9878 por primera vez en 50 años; en 2015 y 2017 se produjeron 2804 y 1446 casos, respectivamente.
Dado que el número de nuevos casos de tripanosomiasis notificados entre 2000 y 2012 había disminuido un 73 %, con menos de 1000 casos nuevos reportados en 2018. Por ello, la hoja de ruta de la Organización Mundial de la Salud (OMS) para las enfermedades tropicales desatendidas fijó el objetivo de su eliminación como problema de salud pública para el 2020.
Durante los periodos de epidemia más reciente, en algunas aldeas de Angola, la República Democrática del Congo y Sudán del Sur la prevalencia ascendió al 50 %.
La progresiva reducción de los casos de TPH en la última década ha propiciado que la OMS haya fijado el objetivo de la eliminación de la enfermedad para el 2030. Sin embargo, descubrimientos recientes en reservorios animales y localizaciones extravasculares de los parásitos en los hospederos pueden suponer un obstáculo para este objetivo.9
El propósito de este trabajo es realizar una actualización clínica y epidemiológica de la entidad para alertar sobre la posibilidad de la aparición en áreas endémicas y la presencia de casos importados en Cuba.
Métodos
Se realizó una revisión bibliográfica en la base de datos Medline/PubMed y en artículos relevantes relacionados con el tema, publicados, sobre todo en los últimos 10 años; también se tomó como referencia las notas descriptivas de tripanosomiasis africana de la OMS del 2020. Se emplearon los libros de textos clásicos de Medicina Interna (Harrison’s Infectious Diseases, 2010, 17th ed. y Mandell: Enfermedades Infecciosas. Principios y práctica, 2012, 7.a ed.). Además, se usó el motor de búsqueda Clinical Key para médicos.
Desarrollo
Distribución actual de la enfermedad
La TPH amenaza a millones de personas en 36 países del África subsahariana, con una población de aproximada de 65 millones de personas expuestas al riesgo.1,3,4,5
En los últimos 10 años, más del 70 % de los casos notificados ocurrieron en la República Democrática del Congo, único país que informa actualmente más de 1000 casos nuevos al año y, en 2015, concentró el 84 % de los casos notificados.
La República Centroafricana informó entre 100 y 200 nuevos casos en 2015. Angola, Burkina Faso, Camerún, Chad, Congo, Côte d'Ivoire, Gabón, Ghana, Guinea, Guinea Ecuatorial, Kenya, Malawi, Nigeria, República Unida de Tanzania, Sudán del Sur, Uganda, Zambia y Zimbabwe reportan menos de 100 casos nuevos anualmente.
A lo largo de más de 10 años no se han notificado casos en Benín, Botswana, Burundi, Etiopía, Gambia, Guinea Bissau, Liberia, Malí, Mozambique, Namibia, el Níger, Rwanda, Senegal, Sierra Leona, Swazilandia y Togo.
Transmisión y patogenia
Aunque la enfermedad se transmite principalmente por la picadura de la mosca tsé-tsé infectada, existen otras vías de infección:1,3,10
Transmisión vertical de madre a hijo: el tripomastigote atraviesa la placenta.
La transmisión mecánica por intermedio de otros insectos hematófagos es posible; no obstante, es difícil determinar las consecuencias epidemiológicas de esta vía.
También está documentada la transmisión del parásito por contacto sexual.
Los pinchazos accidentales con agujas contaminadas en el laboratorio han causado algunas infecciones. Es rara la infección transmitida a través de transfusiones de sangre; teóricamente, podría contagiarse a través del trasplante de órganos sólidos.2,11
En la primera etapa, los tripomastigotes metacíclicos inoculados por las moscas se transforman en tripomastigotes en el torrente sanguíneo, para luego multiplicarse por fisión binaria y diseminarse a través de los vasos linfáticos y la sangre (fase hemolinfática). Evaden la destrucción inmunitaria durante periodos prolongados al sufrir variaciones antigénicas y transformación genética que ocasiona cambios periódicos de la estructura antigénica de la capa superficial de glucoproteínas del microorganismo.5 El huésped produce anticuerpos específicos que disminuyen significativamente la cantidad de parásitos. No obstante, un grupo de ellos escapa a la destrucción inmunitaria y comienza un nuevo ciclo de multiplicación.
La linfadenopatía y la esplenomegalia reflejan proliferación linfocítica e histiocítica con invasión de las células nodulares, que son plasmocitos que participan en la producción de IgM. Esta etapa se caracteriza por episodios de fiebre, cefaleas, dolores articulares y prurito, sin lesiones del sistema nervioso central.1,2,34,5
En la segunda etapa, los tripanosomas aparecen en los fluidos de varios órganos como el miocardio y, por último, en el sistema nervioso central (fase neurológica o meningoencefálica). Por lo general, es entonces cuando se presentan los signos y síntomas más evidentes de la enfermedad.1,2,3
El ciclo continúa cuando una mosca tse-tsé pica a un ser humano o un animal infectados12 (Fig. 2).
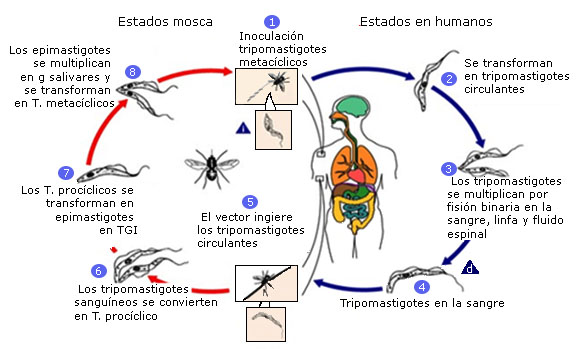 Tomado de: Centers for Disease and Prevention. Disponible en: http://www.dpd.cdc.gov/dpdx
Tomado de: Centers for Disease and Prevention. Disponible en: http://www.dpd.cdc.gov/dpdx
Fig. 2 Ciclo de vida de la tripanosomiasis africana humana.
Los seres humanos son el principal reservorio de T. b. gambiense, pero esta especie también puede residir en animales salvajes, principalmente antílopes, y en diferentes animales domésticos (especialmente vacuno), en algunos de los cuales no ocasiona alteraciones. Los animales salvajes son el principal reservorio de T. b. rhodesiense.4
Infección y cuadro clínico
La enfermedad presenta tres estadios o etapas evolutivas:1,2,10,13
Cutánea: pápula en el sitio de la picada, entre pocos días y dos semanas después de la inoculación. Nódulo indurado doloroso de color rojo oscuro (chancro tripanosómico). Este es poco y raramente frecuente en africanos infectados.
Hemolinfática: Durante varios meses o semanas según se trate de infección por T. b. gambiense, o por T. b. rhodesiense. Aparece fiebre intermitente, cefaleas, rigidez, dolor muscular y articular, hepatoesplenomegalia, edema facial transitorio y exantema eritematoso circinado evanescente. A menudo, también se encuentran adenopatías generalizadas y puede apreciarse el signo de Winterbottom (adenomegalias en el triángulo cervical posterior) característico de la enfermedad por T. b. gambiense.
Sistema nervioso central (SNC): el compromiso se produce entre semanas, varios meses o varios años después de la aparición de la enfermedad aguda, según el tipo de tripanosoma. Aparece cefalea persistente, incapacidad de concentrarse, cambios de personalidad (debilidad progresiva e indiferencia), somnolencia diurna, temblores, ataxia, problemas sensitivos (hiperestesia profunda); problemas psíquicos (apatía, excitación) y coma terminal. Sin tratamiento, sobreviene la muerte según la forma clínica durante el segundo o el tercer año o a los pocos meses.
Sin embargo, la enfermedad adopta dos formas, en función del parásito causante (Tabla 1):1,2,3,4,5,11,14
Tabla 1 Características de la tripanosomiasis gambiense y rhodesiense
| Características | ||
|---|---|---|
| Distribución geográfica | África del oeste y central | África del este (Desde Etiopía hasta el este de Uganda y hacia el sur hasta Botswana) |
| Organismo | ||
| Vectores | Mosca tse-tsé. (grupo palpalis o tachinoides) | Mosca tse-tsé. (grupo morsitans) |
| Reservorio primario | Humano-animales domésticos | Antílope y gatos |
| Enfermedad humana | Crónica (afección tardía del SNC) | Crónica (afección precoz del SNC) |
| Duración de la enfermedad | Meses a años | Menos de 9 meses |
| Rasgos clínicos | ||
| Miocarditis, fallo cardiaco | - | ++ |
| Síntomas neurológicos | ++ | + |
| Coagulación intravascular diseminada | + | |
| Linfoadenopatías (Winterborttom) | Prominentes ++ | Mínimas +/- |
| Parasitemia | Baja | Elevada |
| Diagnóstico por inoculación a roedores | No | Sí |
| Epidemiología | Población rural (aparición de focos periurbanos en los últimos años) | Turistas, trabajadores de parques naturales o áreas salvajes o población rural |
Fuente: Kirchhoff LV. En: Mandell GL et al. (eds.). Principios y práctica en enfermedades infecciosas. 7.a ed. Barcelona: Elsevier; 2012.
T. b. gambiense se encuentra en 24 países de África occidental y central. Esta forma representa en la actualidad más del 97 % de los casos notificados y causa una infección crónica. Una persona puede estar infectada por meses o incluso años sin presentar manifestaciones clínicas importantes. El exantema eritematoso circinado evanescente es más evidente en individuos de piel clara. A menudo, también se encuentran adenopatías generalizadas. El compromiso neurológico se produce entre varios meses y años después de la aparición de la enfermedad aguda y es señal frecuente de que la enfermedad está en etapa muy avanzada.
T. b. rhodesiense se encuentra en 13 países de África oriental y del sur. Representa menos del 3 % de los casos notificados y causa una infección aguda. Los primeros signos y síntomas se observan a las pocas semanas o meses después de la infección. La enfermedad evoluciona rápidamente y afecta al sistema nervioso central.
La tripanosomiasis animal. Otras especies y subespecies del género Trypanosoma son patógenos para los animales (T. vivax, subgénero duttonella; T. congolense; T. simiae, subgénero nannomonas; y T. brucei subgénero trypanozoon), y causan la tripanosomiasis animal en especies silvestres y domesticadas. La enfermedad en el ganado se llama nagana y su presencia en los animales domésticos, particularmente en el ganado, es un obstáculo importante para el desarrollo económico de las zonas rurales afectadas.1,3,15
Diagnóstico
La atención de la enfermedad se hace en tres pasos:
Pesquisa de una posible infección: supone el empleo de pruebas serológicas (solo las hay para T. b. gambiense) y la exploración física en busca de signos clínicos, por lo común, agrandamiento de los ganglios linfáticos del cuello. Las pruebas para la detección de anticuerpos no son muy útiles en la práctica clínica, porque la seroconversión se produce después del establecimiento de los síntomas. No obstante, una prueba de aglutinación en tarjeta para identificar T. b. gambiense (Card Agglutination Test for Tripanosomiasis / CATT) resulta útil en programas de pesquisa masiva para señalar los candidatos para el examen microscópico.2,4,5,8,13,16,17
Diagnóstico de la presencia del parásito en los fluidos corporales: consiste en la identificación de los tripanosomas en el líquido de un chancro, sangre, el material aspirado/biopsia de un ganglio linfático o de la médula ósea y en el líquido cefalorraquídeo (LCR) durante la infección avanzada. Los materiales de elección son la sangre para detectar T. b. rhodesiense y el líquido aspirado de un ganglio linfático aumentado de tamaño para identificar T. b. gambiense. Los preparados frescos deben evaluarse para identificar tripanosomas móviles y los frotis deben fijarse, colorearse con Giemsa (o tinción de Field) y examinarse. Las técnicas de concentración (p. ej., centrifugación de la sangre o el LCR aumentan la sensibilidad. La infección por T. b. rhodesiense se puede identificar al inocular estas muestras en ratones o ratas. Existen pruebas de reacción en cadena de la polimerasa para detectar tripanosomiasis africana en seres humanos.
Determinación de la etapa en que se encuentra la afección.1,3-5,11 Uno de los mayores conflictos en el manejo de estos pacientes es la distinción entre los estadios de la enfermedad. No existe consenso universal sobre los hallazgos que definan el estadio tardío, que implica el tratamiento con medicamentos más tóxicos.14 Cuando se ve comprometido el SNC, está indicada la punción lumbar. La presión del LCR aumenta y se encuentran concentraciones elevadas de linfocitos (≥ 5 células/μL), proteínas totales e IgM. Además de los tripanosomas, pueden observarse las características células de Mott (células plasmáticas con vacuolas citoplasmáticas que contienen inmunoglobulinas [cuerpos de Russell])1,3 y más recientemente se ha descrito la detección de las rosetas de linfocitos CD19 positivos en el LCR tras la exposición a un medio con anticuerpos específicos que representa una estrategia para categorizar de modo preciso a los pacientes con un estadio intermedio de tripanosomiasis africana. De esta manera, es posible reconocer la presencia o la ausencia de compromiso del sistema nervioso central en los sujetos afectados por esta grave enfermedad.18
Otros hallazgos inespecíficos en las pruebas de laboratorio son anemia, monocitosis, un aumento significativo de las concentraciones séricas de IgM policlonal, de anticuerpos heterófilos, anticuerpos anti-ADN y factor reumatoide. En los ganglios linfáticos y el bazo se observa endarteritis con infiltración perivascular tanto de parásitos como de linfocitos. Los pacientes con tripanosomiasis en fase I a menudo tienen miocarditis, principalmente en el caso de la infección por T. b. rhodesiense.5
Tratamiento
El tipo de tratamiento que se administra depende de la etapa de la enfermedad.1,3-5,11 Los medicamentos que se usan en la primera etapa tienen poca toxicidad y se administran más fácilmente que los que se usan en la segunda etapa. Cuanto antes se identifica la enfermedad, mejores son las probabilidades de curación. La evaluación de los resultados del tratamiento requiere un seguimiento del paciente durante 24 meses e implica el análisis en laboratorio de líquidos corporales, incluido el líquido cefalorraquídeo obtenido mediante punción lumbar, dado que los parásitos pueden permanecer viables durante largos periodos y provocar la enfermedad meses después del tratamiento.
El éxito del tratamiento en la segunda etapa depende de medicamentos que atraviesen la barrera hematoencefálica para llegar al parásito. Los medicamentos que se usan son tóxicos y complicados de administrar (Tablas 2 y3).
Tabla 2 Tratamiento de la tripanosomiasis africana humana en la primera etapa: Fármacos que no atraviesan la barrera hematoencefálica
| Fármaco | Etapa de la enfermedad | Características del medicamento |
|---|---|---|
| Suramina 1920 (Bayer 2005®, Germanine®, Nafuride®, Moranil®, Antripol®) | Primer estadio de |
Vía intramuscular (IM) o intravenosa (IV) (escalonada) Eliminación lenta Reacciones: proteinuria y fiebre Actualmente se usa solo para disminuir el número de tripanosomas y, de esta manera, reducir los efectos tóxicos con la administración de Arsobal Dosis: 1 g IV cada 5 días por 5 dosis |
| Pentamidina 1940 (Pentacarinat®, Lomidine®). | Primer estadio de |
IM o IV Menos activo que la suramina No es activo contra Reacciones: hipoglicemia e hipotensión Dosis: 4 mg/kg/día IV de 14-21 días |
| Combinación de Nifurtimox y Eflornitina Incluidos en la Lista de medicamentos esenciales de la OMS (ensayos clínicos produjeron datos de inocuidad y eficacia) | Actualmente se recomienda como tratamiento de primera línea contra la forma |
No se han realizado estudios para su administración contra El Nifurtimox tiene registro para el tratamiento de la tripanosomiasis americana, pero no para la tripanosomiasis africana humana Dosis: 100 mg/kg por vía intravenosa 4 veces al día durante 14 días |
Tabla 3 Tratamiento de la tripanosomiasis africana humana en la segunda etapa: Fármacos que atraviesan la barrera hematoencefálica
| Fármaco | Etapa de la enfermedad | Características del medicamento | |
|---|---|---|---|
| Melarsoprol (Arsobal®) 1949 (Deriv Arsenical) | Primera etapa contra la forma rhodesiense Segunda etapa contra forma gambiense |
IV: Administrar esteroides y suramina antes de administrar el Arsobal Reacciones: irritante para los tejidos, encefalitis y polineuropatía Dosis IV: 2,2 mg/kg diario por 10 días consecutivos |
|
| Melarsoprol + Nifurtimox o Eflornitina (DFMO 1990) o difluorometil ornitina, Ornidil | Alternativa: en áreas de resistencia o con recaídas | Melarsoprol IV: 0,6 mg/kg el 1er día, 1,2 mg/kg IV el día 2, y 1,2 mg/kg/día IV combinado con 7,5 mg/kg Nifurtimox oral dos veces al día de 3 a 10 días, o Effornitina: 50 mg/kg IV cada 6 horas por 14 días | |
| Nifurtimox + Eflornitina | 2009: Reducir la duración del tratamiento y el número de perfusiones intravenosas; pero, desafortunadamente, no se realizaron estudios para su administración contra |
||
Los corticoides se emplean para disminuir el riesgo de reacciones encefalopáticas. La prednisolona vía oral (1 mg/kg una vez al día) con frecuencia se asocia al tratamiento habitual durante toda su duración.
En 2018 la Agencia Europea de Medicina recibió el informe favorable del Comité de Productos Médicos para el Uso Humano (CMHP, por sus siglas en inglés), del fármaco fexinidazol en el tratamiento de la tripanosomiasis africana. Se trata de un derivado imidazólico por vía oral, con una dosis única diaria de 600 mg durante 10 días. Constituye un prometedor y espectacular avance con vistas a la erradicación de esta terrible enfermedad,19,20,22,23 que ha demostrado su eficacia y seguridad tanto para la fase inicial como para la segunda fase, tanto en adultos como en niños. Se estudian medicamentos menos tóxicos en modelos animales basados en anticuerpos monoclonales recombinantes.21
La prevención consiste en evitar las áreas endémicas y protegerse de las picaduras de las moscas tse-tsé. Los individuos que visitan reservas de animales deben vestir prendas gruesas que cubran completamente los brazos y las piernas hasta las muñecas y los tobillos (las moscas pueden picar a través de telas delgadas), de colores neutros que se confundan con el entorno, y deben usar repelentes para los insectos, aunque la eficacia de estos puede ser limitada. Es importante recordar que la picadura es diurna, por lo que debemos extremar las medidas de protección durante el día. Destruir las zonas donde habita el agente transmisor. Prohibir la donación de sangre a personas residentes o que hayan visitado países endémicos. Proteger al enfermo del contacto con los insectos para evitar la infección de estos.
Control de la enfermedad: pesquisa masiva y tratamiento de los enfermos (T. b. gambiense), tratamiento tripanocida del ganado (T. b. rhodesiense), lucha antivectorial atrapando las moscas con trampas o esparciendo insecticidas.
La pentamidina puede contribuir a la prevención de la infección por T. b. gambiense, pero puede dañar a las células β del páncreas, lo que afecta la secreción de insulina y produce hiperglucemia, con desarrollo posterior de diabetes; por ende, rara vez se indica este fármaco como profilaxis.
La OMS ha establecido alianzas público-privadas que han permitido diseñar un programa de control y vigilancia destinado a eliminar la enfermedad como problema de salud pública con objetivos bien precisos. Asimismo, ha prestado apoyo y asistencia técnica a los programas nacionales de control.1,3
Comentario
Durante estos años, Cuba ha prestado colaboración internacionalista en más de 59 países con la presencia de aproximadamente 29 000 colaboradores. Casi la totalidad de los países endémicos tienen colaboradores cubanos que están expuestos a padecer y enfrentar esta enfermedad.
La literatura ha reflejado los estudios realizados por médicos cubanos en áreas endémicas, así como los casos importados tratados en el Instituto de Medicina Tropical Pedro Kourí (IPK), durante las décadas de mayor e intenso trabajo de colaboración de Cuba.
En el año 1990, el profesor Díaz Jidy† publicó los dos primeros casos importados de la región de Lucala en Angola que se encontraban en la fase temprana de la enfermedad.24
Durante los años 1993 y 1994, ingresaron los últimos tres casos confirmados en el IPK (pendientes de publicar por el autor). Estos fueron detectados mediante una pesquisa nacional realizada en este centro durante el periodo de enero 1993 a noviembre 1994 a 61 colaboradores con antecedentes de haber permanecido en la misma región de Angola entre los años 1986 y 1991.
Como observamos, la totalidad de los casos importados ha sido provenientes de Lucala, Angola, ciudad y municipalidad en la provincia Kwanza Norte ubicada al noreste del país, atravesada por el río del mismo nombre, mayor afluente del río Kwanzas, que recorre también las provincias de Uíge y Malange.
El primer caso reportado en Angola fue en la municipalidad de Kissama en 1871, y los estudios del año 1900 confirmaron que la TPH era un importante problema de salud en el área de río Kwanza incluyendo Kissama, con una prevalencia de un 12 %.
Durante la guerra civil ocurrida en el país entre los años 1976-1996, la ausencia de actividades de control junto al deterioro de la seguridad influyó en que la situación epidemiológica fuera desconocida. El país tenía un registro de 8275 personas con la dolencia en 1997,25 debido a las limitaciones en el número de equipos móviles funcionales para el control de la actividad.
En ese año, se realizó un estudio en 31/36 aldeas en la municipalidad de Kissama, con el objetivo de actualizar la información epidemiológica sobre la TPH, en el foco de Kissama, provincia de Bengo y establecer un programa de control; con el cribado serológico para TPH gambiense de 8796 personas. Se informó una prevalencia del 1,97 %, la cual disminuyó en los años 1998 y 1999 al 0,55 y 0,33 %, respectivamente. En 2013, el número de casos disminuyó a 69 y a 34 casos en 2014,25 estando entre los países con menos de 100 casos anuales.1
Angola era el segundo país a nivel mundial en la notificación de casos nuevos de TPH debido a las dificultades en el sistema de vigilancia contra la enfermedad.25 Por esta razón, llegó a ser considerado país endémico por la ONU, pero la reducción significativa en los últimos años permite estar en condiciones de controlar la enfermedad, teniendo en cuenta la meta trazada por las Naciones Unidas para su erradicación.
Sin embargo, el riesgo en todos los países endémicos sigue siendo una amenaza para contraer la enfermedad, pues las características climáticas presentes en la mayoría de los países africanos crean las condiciones para la permanencia del vector, junto al deterioro de las actividades de control; todo lo cual contribuye a la reaparición de la infección, junto a la exposición permanente a la que están sometidos los colaboradores cubanos en la región.9,26,27
Conclusiones
La TPH es una entidad potencialmente mortal, endémica en muchos países donde existe colaboración cubana. Es necesario tener presente el diagnóstico de esta enfermedad para un abordaje terapéutico adecuado, así como tener presentes las medidas higiénico-sanitarias preventivas para evitar el contacto con el agente trasmisor.














