Introducción
El Coronavirus del Síndrome Respiratorio Agudo Severo tipo 2 (SARS-CoV-2) sigue causando alto interés científico, por la incertidumbre acerca de sus características clínicas agudas, crónicas y latentes, secuelas y complicaciones. Se han reportado algunas revisiones acerca de las manifestaciones cutáneas asociadas a este virus; entre ellas la reactivación clínica del virus de la varicela-zoster (VVZ), como el herpes zoster (HZ). No obstante, esta asociación se ha observado no solo en pacientes infectados, durante la fase aguda y en estadios posteriores,1 sino en individuos, después de recibida la inmunización contra SARS-CoV-2 con vacunas de naturaleza ARN-m.12
La infección por SARS-CoV-2 está asociada a una disminución, más marcada en pacientes que no sobreviven, de linfocitos CD4+, CD8+, NK y células B; así como de monocitos y eosinófilos. En este mismo contexto, se ha evidenciado franca reducción de marcadores funcionales de células T, tales como CD107a+ CD8+, IFN-γ+CD8+ e IL-2+CD8+, así como de granzyme B+CD8+(3).
No solo se han reportado reactivaciones de HZ pos-SARS-CoV-2 con manifestaciones cutáneas,4,5 sino además, afectaciones neurológicas importantes como síndrome de Ramsay-Hunt-parálisis facial,6 así como afectaciones mucosas, sobre todo en la cavidad oral y oftálmicas.7
Se describe el caso de un paciente adulto con desarrollo de HZ, durante la convalecencia de la infección por SARS-CoV-2.
Aspectos éticos
El anonimato y la confidencialidad del paciente se encuentran protegidas. Asimismo, el paciente autorizó la revisión de su información de salud, con el fin de publicarla de manera anónima como un reporte de caso clínico en una revista científica; esta decisión se evidenció a través de la firma de un documento producto del proceso de consentimiento informado.
Presentación del caso
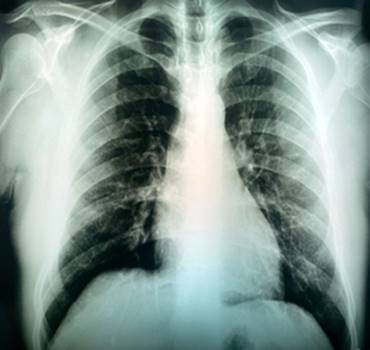
Paciente de 43 años de sexo masculino, que acude por dolor precordial de gran intensidad, sensación de escozor en el tórax posterior y dificultad respiratoria. En el examen físico no se observan alteraciones y los signos vitales se encontraban estables (fig. 1).
Como antecedente, el paciente presentó una prueba positiva de antígeno SARS-CoV-2, a partir de hisopado nasofaríngeo 10 días antes. Se sospecha síndrome coronario agudo. Se le practicó una radiografía estándar de tórax (fig. 2), exámenes de laboratorio (tabla 1) y electrocardiograma con trazado normal.
Tabla 1 - Resultados de laboratorio del caso de estudio
| Hemograma | |||||
|---|---|---|---|---|---|
| Parámetro | Resultados | Unidades | Referenciales | ||
| Hematócrito | 43,00 | % | 38,80 | - | 46,40 |
| Hemoglobina | 13,30 | g/dL | 13,30 | - | 16,20 |
| Eritrocitos | 4 750 000,00 | /mm3 | 4 300 000,0 | - | 5 600 000,0 |
| V.C.M | 91,0 | fL | 80,0 | - | 100,0 |
| H.C.M | 28,0 | pg | 26,7 | - | 31,9 |
| C.H.C.M | 30,9 | g/dL | 32,3 | - | 35,9 |
| Leucocitos | 9 150,0 | /mm3 | 3 540,0 | - | 9 060,0 |
| Neutrófilos | 60,0 | % | 40,0 | - | 70,0 |
| Eosinófilos | 2,0 | % | 0,0 | - | 6,0 |
| Basófilos | 0,0 | % | 0,0 | - | 2,0 |
| Monocitos | 1,0 | % | 4,0 | - | 8,0 |
| Linfocitos | 37,0 | % | 20,0 | - | 50,0 |
| Plaquetas | 116 000,0 | /mm3 | 150 000,0 | - | 415 000,0 |
| Parámetros bioquímicos | |||||
| Parámetro | Resultados | Unidades | Referenciales | ||
| Glucosa | 97,99 | mg/dL | 70,0 | - | 110,0 |
| Colesterol | 271,07 | mg/dL | 150,0 | - | 220,0 |
| Triglicéridos | 186,62 | mg/dL | 60,0 | - | 165,0 |
| Ácido Úrico | 6,4 | mg/dL | 3,0 | - | 5,3 |
| Creatinina | 1,4 | mg/dL | 0,6 | - | 1,3 |
| Urea | 46,66 | mg/dL | 20,0 | - | 40,0 |
| TGO-AST | 46,3 | U/L | < 34 | ||
| TGP-ALT | 55,8 | U/L | < 40 | ||
| Fosfatasa Alcalina | 227 | U/L | 80,0 | - | 220,0 |
| Proteínas totales | 7,3 | g/dL | 6,2 | - | 8,0 |
| Albúmina | 3,54 | g/dL | 3,8 | - | 5,4 |
| Globulina | 3,36 | g/dL | 2,4 | - | 2,8 |
| Indice A/G | 1,05 | 1,8 | |||
| Parámetros inmunológicos | |||||
| PSA-XS | 1,08 | ng/mL | Hasta 4 | ||
| Troponina I | Negativo | Prueba rápida inmunocromatográfica | |||
Fuente: Elaboración propia.
Se le prescribe AINES, ciprofibrato y complejo B. No obstante, la sintomatología persiste con exacerbación nocturna.
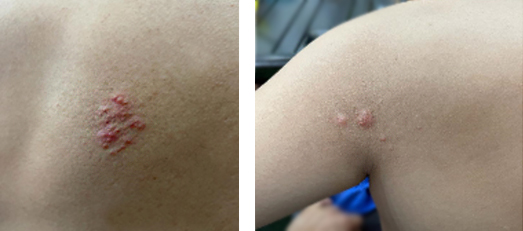
El paciente retorna siete días después con la presencia de lesiones vesiculosas de base eritematosa en tórax posterior (fig. 3), con persistencia e incremento de dolor a nivel de zona precordial-tórax anterior. Con base en los nuevos hallazgos, se sospecha del VVZ con presentación de Zoster sine herpete (ZSH), una manifestación clínica atípica del HZ, en el que se presenta la neuralgia con dolor neuropático, sin la presencia del zoster (o lesiones vesiculosas) en la zona del dolor; lo que puede llevar a fallas en el diagnóstico, retrasos en el tratamiento y complicaciones fatales.8
En este caso, esto explica el dolor en zona anterior. Se prescribe valaciclovir y pregabalina por 10 días.
Discusión
Existen varios reportes acerca de pacientes infectados con SARS-CoV-2 y la presencia de lesiones vesiculares cutáneas por VVZ, así como afectaciones mucosas y neurológicas. Sin embargo, ninguna sobre Zoster sine herpete, como el caso que se ha expuesto. Su presentación atípica retrasó el diagnóstico apropiado, así como la instauración de tratamiento, lo que puede ocasionar complicaciones fatales en el adulto mayor o secuelas en el adulto joven.
Las afectaciones clásicas (cutáneas, mucosas y neurológicas) en estos pacientes pueden deberse a la disminución que provoca el SARS-CoV-2 en los linfocitos T CD4+, CD8+, NK y B, así como el impacto que genera en sus marcadores biológicos funcionales. En este sentido, se ha expuesto acerca de la afectación inmunológica que sufren, además, por el estrés físico y mental que genera esta infección, pero también la causada por sus tratamientos, con énfasis en aquellos basados en inmunomodulares9 y fármacos corticosteroides.10
Un aspecto especial a considerar son las medidas preventivas instauradas en el mundo, a través de las inmunizaciones, donde se ha reportado en innumerables ocasiones los casos de HZ en individuos receptores de vacunas anti-SARS-CoV-2 de naturaleza ARN-m.2,3,11,12
En algunos países se ha evidenciado el incremento de la asociación HZ-SARS-CoV-2;13) no obstante, existen reportes acerca de lo contrario, es decir, que no se han observado incrementos de los casos de HZ durante la pandemia. Sin embargo, uno de los limitantes de estos últimos estudios radica en el hecho de que muchos de los pacientes con la asociación son de manejo ambulatorio, por lo que escapa a la estadística de los resultados presentados.14
En otro sentido, se ha evidenciado el efecto beneficioso protector que confieren las vacunas contra otros agentes infecciosos (BCG, MMR, influenza) en el sistema inmune innato, especialmente en pacientes añosos. Se ha demostrado una asociación entre individuos que han recibido la vacuna de VZ, de virus vivo atenuado y una disminución en la probabilidad de resultar positivo a SARS-CoV-2 en un test.15
Conclusiones
El SARS-CoV-2 es un virus de afectación sistémica que impacta con gran intensidad en el sistema inmunológico; esto permite que virus de naturaleza latente, como el VVZ, tengan oportunidad de reactivarse y agravar el cuadro respiratorio con afectaciones cutáneas, mucosas y neurológicas. Es importante no olvidar la probabilidad de presentaciones atípicas de estos últimos, con el fin de realizar un diagnóstico y tratamiento oportuno a los pacientes.