Introducción
La rabia es una enfermedad viral que afecta el sistema nervioso central de los mamíferos, entre ellos el del ser humano. El virus está presente sobre todo en la saliva y el cerebro de los animales infectados. La transmisión ocurre principalmente a través de la saliva de un animal enfermo, en la mayoría de los casos, la de un perro.1 El período de incubación es variable y fluctúa de varios días a algunos meses. Cuando aparecen los síntomas la enfermedad es mortal, tanto en los animales como en el hombre.2
Cada año se reporta alrededor de 40 000 - 70 000 muertes a causa de la rabia y más del 95 % de estas ocurren en los continentes asiático y africano.3 El principal grupo etario que sufre defunciones a causa de esta enfermedad es el de los niños (4/10 muertes) que habitan países en vías de desarrollo. Se sabe que el 99 % de los casos de rabia en el mundo se producen a causa de mordeduras de perros. Además, más del 80 % de las muertes se deben a un acceso limitado o inexistente a campañas de educación sanitaria y al tratamiento de las mordeduras.4
La rabia es reconocida desde el año 4000 a.C. en Babilonia. Ya en el año 322 a.C. Aristóteles documentó casos de rabia y en diversas culturas del mundo antiguo esta enfermedad era considerada “castigo divino”.5 En América la introducción se da por parte de los ingleses, que traían consigo animales afectados durante la época de colonización. Se reportan infecciones de rabia en México en el año 1709, en EE.UU. en 1753, en Perú en 1803 y en Argentina en 1810. Existe reportes de muertes humanas a causa de esta enfermedad en las Antillas en 1719 y en 1741 en Isla Barbados.6 En países como Costa Rica el primer reporte que existe de muerte por rabia data del año 1967.7
En 1885 Louis Pasteur demostró la posibilidad de vacunar perros para prevenir la infección por rabia y la transmisión a los seres humanos. En ese mismo año se aplicó la primera vacuna contra la rabia al niño de nueve años Joseph Meister, quien, gracias a la vacuna, sobrevivió a la mordedura de un perro rabioso. Fue hasta 20 años posterior a la intervención de Pasteur que se inició el desarrollo y utilización de la vacunación animal.8
En los últimos años se ha logrado alcanzar un mayor entendimiento del virus de la rabia y los mecanismos por los cuales produce enfermedad. El presente trabajo tuvo como objetivo desarrollar a profundidad los principios moleculares de la infección por rabia, así como su patogenia, diagnóstico y tratamiento.
Métodos
Se realizó una búsqueda de bibliografía sobre el tema, a lo largo de un mes, en fuentes de datos digitales, como PubMed, SciELO, Scopus, Researchgate. Se utilizaron las palabras de búsqueda en inglés y español: “virus de la rabia”, “virología molecular de rabia”, “caracterización del virus de rabia”, “epidemiología de rabia”, “tratamiento de rabia”, “vacunas antirrábicas”. De 957 resultados, se descartó todo artículo que no tuviesen relación directa con el objetivo a desarrollar. De 163 referencias consultadas se seleccionó las 51 más completas y con información adecuada para dar respuesta al tema tratado.
Taxonomía y estructura del virus
La especie rabies virus (RABV) o mejor conocido como rabia es un virus neurotrópico del género Lyssavirus, perteneciente a la familia Rhabdoviridae y del orden Mononegavirales.9,10 Los Lyssavirus se dividen en tres filogrupos, según su grado de relación. Los del filogrupo 1 contienen al virus RABV, el virus Duvenhage (DUVV) Lyssavirus del murciélago europeo tipo 1 (EBLV1), Lyssavirus del murciélago europeo tipo 2 (EBLV2), el Lyssavirus del murciélago australiano (ABLV), el virus Aravan (ARAV), el virus del murciélago Bokeloh, el virus del murciélago Gannoruwa (GBLV), el virus Irkut (IRKV) y el virus Khujand (KHUV). El filogrupo 2 contiene al virus del murciélago de Lagos (LBV), al virus Mokola (MOKV) y al virus del murciélago de Shinoni (SHIBV); mientras que el filogrupo 3 contiene a los Lyssavirus Ikoma (IKOV), Lyssavirus del murciélago Llleida (LLEBV) y el virus del murciélago caucásico del oeste (WCBV).11,12
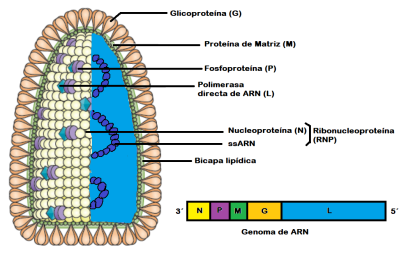
El virus de RABV tiene aproximadamente un diámetro de 70 nm y una longitud de 170 nm. Según la clasificación de Baltimore se cataloga como un virus del grupo V ((-) ssARN). Su estructura es semejante a la de todos los rhabdovirus, ya que su genoma codifica para cinco proteínas estructurales. La nucleoproteína (N), la fosfoproteína (P), la proteína matriz (M), la glicoproteína (G) y la polimerasa directa de ARN (L). La N encapsida el genoma de ARN y forma un complejo de N-ARN conocido como ribonucleoproteína (RNP). El RNP está condensado junto con L y P, dentro de una nucleocápside helicoidal (NC). La envoltura contiene la membrana derivada del hospedero junto a G y M (fig.).3,13
Epidemiología
El virus de la rabia se encuentra en todo el mundo. A pesar de ello, muchos países han estado libres de la rabia clásica desde hace varios años. Se estima que un asiático muere cada 15 minutos a causa de rabia y el 15 % de los casos es más probable que sea un niño menor de 15 años.14. En África se estiman 24 000 muertes al año a causa del virus, mientras en Europa no se reportan casos de rabia en humanos, debido a las fuertes políticas de vacunación en animales.15 En Estados Unidos los casos de rabia y muertes humanas han disminuido en la última década, pero existen reportes de animales silvestres que son portadores; esto ocurre de manera similar en Canadá. En América Latina y el Caribe los casos de rabia han disminuido, pues la rabia transmitida por perros se encuentra casi eliminada, pero se ha dado una reemergencia en algunas zonas declaradas libres, a causa de especies silvestres.15 Por solo citar un ejemplo, en el año 2016 en Perú se llegaron a reportar 14 casos de rabia humana y 304 de rabia animal de transmisión silvestre; mientras que en 2017 ocurrieron hasta 227 casos de rabia animal de transmisión silvestre.17
Al realizar un mapeo de la epidemiología molecular de la rabia, se puede observar que el virus RABV se considera global y capaz de afectar a todos los mamíferos. En la tabla 1 se puede observar la distribución de los Lyssavirus según países en que se han aislado.12
Tabla 1 Distribución de Lyssavirus según los reportes de aislamiento en diferentes países
| Filogrupo | Virus | País donde se aisló | Principal reservorio reportado |
|---|---|---|---|
| I | RABV | Global | Mamíferos |
| ARAV | Kirguistán | Murciélagos | |
| ABLV | Australia | Murciélagos | |
| BBLV | Francia y Alemania | Murciélagos | |
| DUVV | Kenia y Sudáfrica | Murciélagos | |
| EBLV-1 | Bélgica, Dinamarca, Francia, Alemania, Países Bajos, Polonia, Rusia, Eslovaquia, España y Ucrania | Murciélagos | |
| EBLV-2 | Dinamarca, Finlandia, Francia, Alemania, Países Bajos, Noruega, Suiza y Reino Unido | Murciélagos | |
| GBLV | Sri Lanka | Murciélagos | |
| IRKV | China y Rusia | Murciélagos | |
| KHUV | Tayikistán | Murciélagos | |
| II | LBV | República Centroafricana, Etiopia, Francia, Ghana, Nigeria, Senegal, Sudáfrica y Zimbabue | Murciélagos |
| MOKV | Camerún, República Centroafricana, Etiopia, Nigeria, Sudáfrica y Zimbabue | Roedores y animales domésticos | |
| SHIBV | Kenia | Murciélagos | |
| III | IKOV | Tanzania | Civeta africana |
| LLEBV | España | Murciélagos | |
| WCBV | Rusia | Murciélagos |
Fuente: Elaboración propia.
Reservorio, transmisión e infección
Dentro de los principales reservorios se encuentran los miembros de los cánidos (perros, chacales, coyotes, lobos, zorros y perros mapaches), los mustélidos (zorrillos, martas, zarigüeyas y armiños), vivérridos (mangostas y suricatos), prociónidos (mapaches) y quirópteros (murciélagos). Los gatos también pueden infectarse por el virus, a partir de otros hospederos y, posteriormente, podrían transmitirlo.11
La transmisión del virus es la consecuencia de estar en contacto con saliva de un animal infectado, ya sea por mordedura o por contacto directo entre una mucosa o herida expuesta y la saliva infectada. Existen reportes de casos raros, donde el virus ha sido transmitido por trasplante de órganos, por aerosol en cuevas de murciélagos con una alta densidad del virus y hasta un reporte por transmisión en leche.5,11
El proceso infeccioso inicia desde que se da la mordedura (poniendo al virus en contacto con el músculo y neuronas); cursa por un período de incubación que varía de uno a tres meses (pueden existir casos de cuatro días y hasta seis años); el virus migra de manera retrógrada por las neuronas que inervan la zona donde este penetró a una velocidad de 12 mm/día, hasta llegar al cerebro y generar las primeras manifestaciones de la fase prodrómica, que evoluciona a manifestaciones neurológicas y, finalmente, al coma y la muerte del sujeto.14
La invasión de la rabia a los sistemas neuronales se suele dividir en dos vías (la vía centrípeta y la vía centrífuga) en función del proceso de migración hacia el cerebro y su posterior distribución en órganos periféricos (tabla 2).17
Ciclo de replicación del virus
1. Entrada del virus
Esta es la etapa donde el virus interacciona con los receptores asociados a su ingreso a las células blanco y se ha tratado de explicar mediante la participación de tres receptores: el nicotínico, la molécula de adhesión a células neurales (NCAM) y el factor de necrosis tumoral miembro 16 de la superfamilia (TNFRSF16, también conocido como p75NTR).13
En la primera etapa el virus sufre un proceso de adsorción a la célula blanco, siendo la proteína G la que se ve involucrada en esta interacción.3 El virus puede ingresar de forma directa por las fibras nerviosas (sensitivas, motoras o autonómicas) o presentar un período de replicación en células del musculo esquelético.13 El receptor nicotínico permite la entrada del virus a las células del músculo para que inicie su replicación en ese sitio y aumente la cantidad de viriones que, posteriormente, vuelven a ser expulsados a la sinapsis, cerca de las neuronas que conectan con el músculo estriado, donde iniciará su viaje retrógrado por el axón. Una vez que el virus se encuentra en la sinapsis, a través de sus glicoproteínas, puede interaccionar con la NCAM para adherirse a la membrana de la neurona y con p75NTR para iniciar el proceso de endocitosis, mediado por clatrinas. Aquí existe un mecanismo que es dependiente de un pH bajo en la hendidura, ya que esto favorecerá el proceso de fusión entre la membrana del virus y la membrana del endosoma, para su posterior liberación en citoplasma.3,12,18
2. Transporte retrógrado
Una vez formado el endosoma dentro de la célula neuronal, este se traslada a una zona cercana a los microtúbulos donde es adherido a una proteína conocida como dineína de cadena ligera 8 (LC8 o DYNLL1), la cual, apoyándose en la estructura del microtúbulo, puede transportar carga a través del citoplasma y es justamente este mecanismo el que permite el transporte retrógrado hacia el soma neuronal, donde ocurre el desnudamiento del genoma viral (liberación del virus al citoplasma).18,19,20
3. Replicación, transcripción y expresión proteíca
La transcripción inicia en la región corta de ARN líder sin capucha (leARN), luego es seguida por cap 5` de cada transcrito hasta la región poliadenilada. Se cree que la región leARN es una región reguladora de la transcripción que contiene señales de encapsidación para la nucleoproteína. Al ser el virus un (-) ssARN, debe codificar un antigenoma (+) que es el que permite la traducción hacia las proteínas. A su vez, el antigenoma (+) debe codificar nuevamente a la forma del genoma (-), lo que permite que esta última sea utilizada en el proceso de reensamblaje del virus, cuando todas las proteínas ya estuviesen traducidas.12,21
4. Reensamblaje y gemación
El reensamblaje es mediado por la proteína M, que es el mayor componente estructural del virus, pero el cómo esta llega al sitio de gemación resulta desconocido. La liberación del virus al espacio extracelular se da por un proceso de gemación que toma lugar en el lado citoplasmático de la membrana.12,22,23 También existe evidencia que explica la necesidad de la proteína G para que exista un proceso eficiente de gemación, ya que tanto G como M trabajan de forma concertada.23,24 Es gracias a estos procesos que el virus puede iniciar un nuevo ciclo de infección.
Mecanismo de evasión del sistema inmunológico del huésped
Existe una serie de mecanismos propuestos dentro de los que se incluye: las proteínas de matriz (M) que inhiben los mecanismos para la producción de citoquinas antivirales, las nucleoproteínas (N) y fosfoproteínas (P) que inhiben la producción de interferones (IFN), las fosfoproteínas (N) que reducen la transcripción de los genes estimulados por interferón tipo I.12,13
Respuesta del hospedero
Se ha demostrado que, a diferencia de otros virus neutrófilos, la rabia no induce apoptosis como mecanismo neuropatogénico. Los modelos en ratón muestran que la óxido nítrico sintasa inducible (iNOS) es necesaria para los procesos patogénicos del virus. La iNOS es necesaria para aumentar la permeabilidad de la barrera hematoencefálica (BHE) y el ingreso del virus al SNC. La inhibición de la iNOS retrasa los procesos patogénicos de la rabia.25
Los Cuerpos de Negri son reconocidos por ser sitios de inclusión citoplasmática donde ocurren los procesos de: replicación y traducción y contienen al menos una proteína celular HSP70, que interviene en la producción vírica.26
Presentación clínica
Con respecto a la forma en que se llega a manifestar el virus, existe una fase de incubación que resulta ser variable entre uno y tres meses, pero se han llegado a reportar casos tan extremos como de cuatro días y seis años. Luego de esta etapa se presenta la fase prodrómica, entre uno y diez días, que cursa por una sintomatología pseudogripal y evoluciona a las manifestaciones agudas de origen neurológico (dos a siete días). Estas podrían ser de tipo rabia furiosa (80 % de los casos) o una rabia paralítica (20 % de los casos); en situaciones poco comunes aparecen signos “no clásico”.14,27,28 Finalmente, ocurre el coma (0-14 días) que termina en la muerte del paciente y es extremadamente rara una recuperación (tabla 3).29,30
Diagnóstico
El diagnóstico clínico se maneja en función de la presencia y evolución de los síntomas, así como la búsqueda de antecedentes de exposición al virus. Ante un diagnóstico presuntivo se debe realizar pruebas de laboratorio. Las pruebas de laboratorio pueden ser pre mortem (en humanos) y post mortem (animales, posterior a su sacrificio).31,32
Para las pruebas pre mortem, la detección del virus se realiza en piel y nuca, utilizando el método de reacción en cadena de la polimerasa (PCR); un resultado positivo es confirmatorio, mientras que un resultado negativo no descarta el diagnóstico positivo. La detección del anticuerpo antirrábico, que se realiza solo en individuos no vacunados y es la prueba “gold standard”, al ser positiva fortalece el diagnóstico positivo, mientras que una prueba negativa no descarta el diagnóstico.27,31
En las pruebas post mortem se busca identificar el virus en el sistema nerviosos central (SNC), tomando muestras del encéfalo en la ruta del agujero occipital o retro-orbital. Estas muestras, una vez tomadas, se deben mantener en refrigeración o en una mezcla de glicerol y solución salina tampona con fosfatos 50:50. El resultado positivo es confirmatorio de la presencia del virus y uno negativo descarta el diagnóstico.27,31,32
Tratamiento
Los tratamientos se dividen en métodos profilácticos (vacunas e inmunoglobulina antirrábica) que se usan previo a una exposición y que debe recibir el personal con alto riesgo de exposición (veterinarios, biólogos que trabajen en ambientes de exposición como cavernas, personal expuesto a animales que pudiesen ser posibles huéspedes del virus y viajeros que visiten zonas donde exista la presencia del virus en animales con los que podrían estar en contacto) y los tratamientos posexposición, establecidos para personas que ya fueron expuestos al virus y que en muchos casos no están vacunados (tabla 4).32
Tabla 4 Tratamientos profilácticos preexposición y posexposición al virus de la rabia
| Preexposición al virus de la rabia | Posexposición al virus de la rabia |
|
|
|
La rabia es una enfermedad que se circunscribe a ciertas regiones del mundo; sin embargo, la invasión por parte del ser humano a hábitats, donde el virus circula de forma natural (ciclo selvático), ha provocado que en los últimos años se haya reportado un aumento en la incidencia de casos en animales domésticos y en humanos (ciclo urbano), a partir de la transmisión desde animales silvestres.36,37 En la actualidad la rabia proveniente de animales silvestres es la principal causa de la enfermedad en las Américas.38 Hoy en día se cuenta con los avances médicos necesarios para la erradicación de este virus; por lo que constituye una meta alcanzable dentro de los objetivos de la Organización Mundial de Sanidad Animal para el 2030.4 Esto es posible lograrlo en todo el mundo, a través de la vacunación de especies transmisoras como los perros.39,40
Protocolo de Millwaukee
Willoughby y otros reportaron el uso de una terapia, en la que se incluía ketamina, midazolam, ribavirina y amantadina, que fue capaz de inducir coma en una paciente de 15 años, a quien no se le administró la vacuna y desarrollo rabia clínica, luego de un mes de haber sido mordida por un animal infectado; como consecuencia del tratamiento, la paciente sobrevivió.41 A este protocolo se le conoce como el protocolo de Milwaukee y con los años ha sufrido modificaciones, retirándose los barbitúricos y la ribavirina.42 A pesar del reporte de fallas en la replicación de los resultados con el uso de este protocolo, aún se utiliza durante la primera semana de rabia sintomática en pacientes seleccionados, según indica el Centro de Control y Prevención de Enfermedades (CDC, por sus siglas en inglés), ubicado en la ciudad de Atlanta, del estado de Georgia en Estados Unidos.42,43,44
El futuro del tratamiento antirrábico
A pesar de que la vacuna actual es muy segura y altamente reactogénica, el desarrollo de nuevas vacunas se está enfocando en la utilización de una dosis única; evitar la necesidad de cadena de frío y la mejora del costó-efectividad en niños.45 Para ello se ha trabajado en el desarrollo de vacunas basadas en regiones antigénicas del virus, como la glicoproteína viral. Para ello se ha logrado la expresión de la glicoproteína en algunos tejidos vegetales como tomates, maíz y zanahoria.46,47,48) En la India actualmente existe una vacuna que utiliza nanopartículas, desarrollada por el laboratorio CPL Biological y se encuentra cursando sus estudios de fase III.45 También las vacunas basadas en ARN, ADN y que utilizan vectores virales muestran diferentes etapas de desarrollo. Por ejemplo, la vacuna de ARN CV7201 se encuentra en fase I; se han logrado concretar algunas pruebas preclínicas en vacunas de ADN; así como también aquellas que utilizan vectores como el adenovirus, poxvirus y parainfluenza han dado resultados prometedores en sus ensayos preclínicos, pero aún se encuentran en etapas iniciales de desarrollo en función de una posible comercialización.44,49,50
Además del desarrollo de vacunas más modernas, existen investigaciones donde se ha probado la clofazimina que es un antibiótico conocido por su uso en el manejo de la tuberculosis y la lepra, pero que ha dado resultados alentadores en la inhibición del virus de la rabia, al mostrar un potencial inhibidor de la glicoproteína y evitar la función de las membranas.51
Conclusiones
En los últimos años se ha logrado entender de una mejor manera el mecanismo por el que el virus de la rabia ingresa y se difunde en el organismo humano. En la actualidad se conocen nuevos receptores involucrados en la adhesión y posterior replicación viral dentro de las células blanco. A pesar de la existencia de los avances científicos, capaces de erradicar la transmisión de la rabia a humanos, la presencia del virus en países en vías de desarrollo en los continentes africano y asiático vuelven esta meta algo compleja. La invasión de territorios selváticos, donde el virus circula de forma libre, favorece una reemergencia de la enfermedad. La vacunación se convierte en la piedra angular para el control y la posible erradicación de la rabia a mediano plazo.