My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Hematología, Inmunología y Hemoterapia
Print version ISSN 0864-0289On-line version ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter vol.18 no.2 Ciudad de la Habana May-Aug. 2002
Inmunofenotipaje celular en el diagnóstico de leucemias linfoides crónicas
Dra. Miriam Sánchez Segura, Dra. Vianed Marsán Suárez, Lic. Bertha B. Socarrás Ferrer, Lic. René Rivero Jiménez, Lic. Mercedes Martínez Machado, Dr. Porfirio Hernández Ramírez y Dra. Consuelo Macías Abraham
Resumen
Se realizó el estudio fenotípico de células procedentes de sangre periférica y de médula ósea de 61 pacientes con leucemia linfoide crónica mediante 2 métodos de inmunofenotipaje celular: el ultramicrométodo inmunocitoquímico y el de fosfatasa alcalina-antifosfatasa alcalina. Del total de pacientes estudiados, 53 (86,88 %) fueron de fenotipo B y 8 (13,11 %) de fenotipo T. En el 50 % de los pacientes con LLC-T hubo coexpresión de CD4 y CD8. Entre los pacientes con LLC-B los antígenos más frecuentemente expresados fueron CD19 (85 %), CD5 (81,13 %), HLA-DR (74,47 %) , lgS (60,3 %) y CD22 (56,6 %) . En 10 pacientes no se expresó el antígeno CD5. En relación con la frecuencia relativa de los subtipos de LLC, hubo un mayor número de pacientes con leucemia linfoide crónica T que lo comunicado para esta entidad.
DeCS: LEUCEMIA LINFOCITICA/inmunología; INMUNOFENOTIPIFICACION; ANTICUERPOS MONOCLONALES; MEDULA OSEA.
Las leucemias linfoides crónicas (LLC) comprenden un grupo de neoplasias biológicamente diferentes, caracterizadas por una proliferación y acúmulo de linfocitos pequeños de apariencia madura en sangre periférica, médula ósea y tejidos linfoides, muchos de los cuales se encuentran en la fase Go del ciclo celular y sólo un pequeño número proliferante, lo que sugiere que su vida media sea larga. Es el prototipo de leucemia que involucra anormalidades de la muerte celular programada o apoptosis.1-3
Los diferentes comportamientos fisiológicos, clínicos y fenotípicos encontrados en los pacientes con LLC pudieran ser consecuencia de anormalidades genéticas, como reordenamientos aberrantes de genes para inmunoglobulinas (lgS), así como sobreexpresión de la proteína bcl-2 en las células transformadas.4 El riesgo de desarrollar LLC aumenta progresivamente con la edad, y es por lo general más frecuente en hombres que en mujeres.5,6
Con el avance logrado en las técnicas inmunológicas para la detección de marcadores de superficie, se ha observado que más del 95 % de los pacientes con LLC tienen el fenotipo B (LLC-B) y en sólo 2-5 % de los casos se ha reportado el fenotipo T (LLC-T).7,8
La LLC-B es la forma más común de leucemia del adulto en los países occidentales y está caracterizada por una proliferación monoclonal de linfocitos B inmunológicamente incompetentes. La detección de marcadores genéticos asociados con leucemia en células progenitoras CD34+ en un subtipo de pacientes con LLC-B sugiere que la transformación maligna ocurre al nivel de las células progenitoras inmaduras.5,9
El curso de la enfermedad en los pacientes con LLC-B tiene gran variabilidad clínica, y está determinada por una profunda disregulación del sistema inmune, dada por una perturbación en la interacción entre las células T y B e hipogammaglobulinemia progresiva, sobre todo en las etapas avanzadas de la enfermedad, factores que contribuyen al mayor riesgo de padecer procesos infecciosos, principal causa de muerte. Es frecuente también la aparición de fenómenos autoinmunes.2,10,11
A lo largo de las 2 últimas décadas, se han producido notables avances en la biología, diagnóstico, pronóstico y tratamiento de la LLC.12 Si bien la evaluación morfológica de las células leucémicas está considerada como la base principal para la identificación de las neoplasias linfoides, el inmunofenotipaje celular, con el uso de anticuerpos monoclonales (AcMo) altamente específicos, ha propiciado una mejor caracterización de estas enfermedades, algunas de las cuales pueden beneficiarse por diferentes avances terapéuticos. En las técnicas inmunoenzimáticas, los anticuerpos (Acs) son marcados con una enzima como la peroxidasa, la fosfatasa alcalina o la b-galactosidasa.13,114
En este trabajo se realizó la caracterización inmunológica de los pacientes con LLC diagnosticados en nuestra institución en un período de 9 años, con el objetivo de conocer la frecuencia relativa de los subtipos de esta enfermedad, así como la expresión antigénica más frecuente, y contribuir a la obtención de información relevante en términos de diagnóstico, curso de la enfermedad, pronóstico y patogénesis, lo que indudablemente redundará en un mejor manejo de los pacientes con esta enfermedad.
Métodos
Se estudió un total de 61 pacientes con LLC, 26 del sexo masculino y 35 del femenino, con una edad promedio de 59,62 años y un rango de edad de 25 a 84 años, diagnosticados en el Instituto de Hematología e Inmunología y clasificados en el Departamento de Inmunología de dicha institución, en el período comprendido desde junio de 1992 hasta junio de 2001.
La clasificación inmunológica se realizó con el uso de métodos de inmunofenotipaje celular y la aplicación de una batería mínima de AcMo dirigidos contra Ags linfoides y mieloides (tabla).
Tabla. Batería mínima de anticuerpos monoclonales utilizados en el inmunofenotipaje de células
| AcMo | Linaje de la célula que identifica | Procedencia |
| Anti- CD2 (OKT11) | Células T | Filatov Institute Immunology |
| Anti-CD3 (OKT3) | Células T | Hospital Clinic de Barcelona |
| Anti-CD4 (OKT4) | Células T | Filatov Institute Immunology |
| Anti-CD5 (Cris 1) | Células T | Hospital Clinic de Barcelona |
| Anti-CD8 (OKT8) | Células T | Filatov Institute Immunology |
| Anti-CD19 (B4) | Células B | Institute of Cancer Research |
| Anti-CD20 (B1) | Células B | Institute of Cancer Research |
| Anti-CD21 (OKB7) | Células B | Institute of Cancer Research |
| Anti-CD22 (Leu 14) | Células B | Hospital Clinic de Barcelona |
| Anti-lgS | Células B | Hospital Clinic de Barcelona |
| Anti-cadena K | Células B | Hospital Clinic de Barcelona |
| Anti- cadena l | Células B | Hospital Clinic de Barcelona |
| Anti-HLA-DR | Otros | Hospital Clinic de Barcelona |
| Anti-CD11b (OKM1) | Células mieloides | Filatov Institute Immunology |
| Anti-CD11c | Células mieloides | Filatov Institute Immunology |
Se aplicaron 2 procedimientos técnicos para el inmunofenotipaje de las células leucémicas: el ultramicrométodo inmunocitoquímico (UMICIQ)15,16 y la técnica de fosfatasa alcalina anti-fosfatasa alcalina (APAAP);17 ésta última se aplicó en el período comprendido desde febrero de 1999 hasta febrero de 2000.
La obtención de las células mononucleares procedentes de sangre periférica o del aspirado de la médula ósea se realizó mediante el método de Böyum modificado,18 y el ajuste celular se realizó a 4 ´ 105 células/mL. Mediante el método de exclusión del tripán azul se determinó la viabilidad celular (mayor del 95 %).
En el método UMICIQ, las células no deshidratadas se unen electrostáticamente a láminas portaobjeto de cristal que contienen 21 pocillos recubiertos con poli-L-lisina, y permite la detección de Ags de membrana y citoplásmicos por la utilización del detergente Brig 56. Para el revelado de la reacción se emplea un segundo Ac conjugado con la enzima peroxidasa, la cual reacciona luego con un sustrato para, en presencia de un cromógeno, dar lugar a un producto insoluble que puede verse a través del microscopio óptico. En la tinción se emplea el cloronaftol, el cual permite distinguir las células linfoides de las mieloides, y en la contratinción se utilizan el aminoetilcarbazol (que tiñe a las células positivas de color amarillo-naranja) y el hemalón (que favorece la visualización de la morfología celular).15,16
Para la realización del método APAAP, se hacen extendidos en láminas portaobjeto de cristal de sangre procedente de punción digital o de médula ósea y se fijan con acetona pura. Después de distribuir en cada lámina el correspondiente AcMo, se añade una fracción purificada de inmunoglobulina del antisuero de conejo anti-ratón (linking) y posteriormente el complejo APAAP, el cual contiene complejos solubles de fosfatasa alcalina anti-monoclonal de ratón. En la reacción inmune intervienen el naftol-Ax-mx-fosfato como sustrato y un agente cromógeno.17
Análisis estadístico
Para conocer la frecuencia relativa de los subtipos de leucemia linfoide crónica, se realizó la distribución porcentual de esta variable. También se realizó la distribución porcentual para conocer la expresión antigénica más frecuente de los diferentes subtipos de LLC. Se calculó el promedio de edad en el grupo estudiado y se determinó la distribución de frecuencia absoluta del sexo.
Resultados
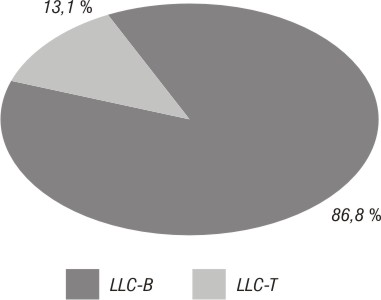
Se diagnosticó LLC en 61 pacientes. Del total de LLC estudiadas, 53 fueron de fenotipo B (LLC-B) (86,88 %) y 8 de fenotipo T (LLC-T) (13,11 %) (fig. 1).
Fig. 1. Frecuencia relativa de subtipos de leucemia linfoide crónica.
Hubo predominio del sexo femenino sobre el masculino, con una relación F:M de 1,3:1 y se encontró esta enfermedad en 11 pacientes menores de 50 años (18 %).
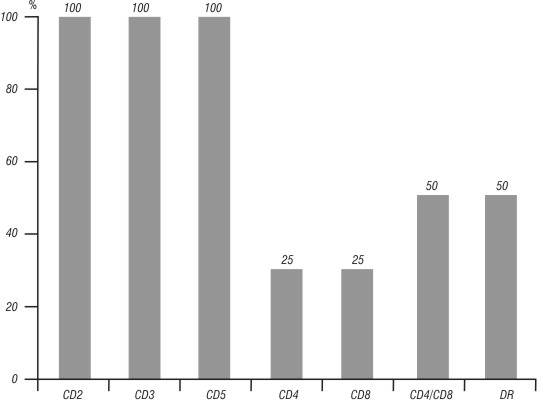
De los 8 pacientes con LLC-T, 25 % expresó el Ag CD4; 25 % tuvo expresión del Ag CD8 y en el 50 % de los enfermos hubo coexpresión de ambos Ags (CD4 + / CD8+). Los antígenos CD2, CD3 y CD5 estuvieron presentes en el 100 %, y el 50 % fueron positivos para el HLA-DR (fig. 2).
Fig. 2. Expresión antigénica más frecuente en pacientes con LLC-T.
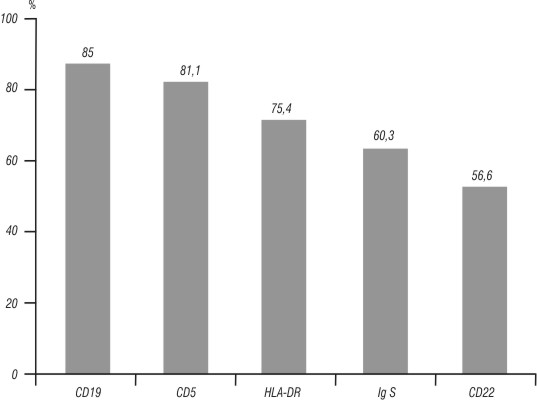
En los pacientes con LLC-B, los Ags más frecuentemente encontrados fueron: CD19 (85 %), CD5 (81,13 %), HLA-DR (75,47 %), lgS (60,3 %) y CD22 (56,6 %). En 10 pacientes (18,86 %) no se encontró expresión del Ag CD5 (fig.3). Con menor expresión antigénica se encontró el CD20, en el 32 % de los pacientes, CD21 en el 19 %, CD11c en el 9,43 % de los casos, así como los Ags CD11b y CD8 en 2 (3,77 %).
Fig. 3. Expresión antigénica más frecuente en pacientes con LLC-B.
El CD22 de membrana tuvo una expresión alta en el 22,64 % de los casos estudiados y la lgS estuvo sobreexpresada en el 16,39 %.
Las cadenas ligeras de lg estuvieron expresadas en 31 pacientes (58,5 %), y con elevada expresión sólo en 11 (22,6 %). Hubo predominio en la expresión de cadenas ligeras l (37,5 %) y una relación l : k de 1,8 : 1.
Discusión
La LLC es reconocida como una entidad diferente y está bien caracterizada clínica e inmunofenotípicamente, sin embargo, existe gran heterogeneidad tanto morfológica como inmunofenotípica.19,20 La frecuencia de LLC durante un período de 9 años en nuestra institución es similar a la reportada por otros autores. Hjalman y Carlsson encontraron, en un hospital de Suecia, un total de 59 pacientes en un período de 10 años.21
Esta enfermedad es más frecuente en hombres que en mujeres, y por lo general se presenta en etapas avanzadas de la vida. Sin embargo, el 10 % de los pacientes comunicados en una variedad de ensayos clínicos, tienen menos de 50 años de edad.22,23 Esto difiere de lo encontrado en este estudio, donde hubo prevalencia del sexo femenino y fue diagnosticada en 11 pacientes menores de 50 años de edad (18 %), lo que atribuimos a características demográficas peculiares de nuestro país.
El predominio del fenotipo B sobre el fenotipo T ya ha sido comunicado con anterioridad. La LLC-B está presente en más del 95 % de los pacientes con LLC y en sólo 2-5 % de los casos se ha reportado el fenotipo T. Chen y Lin24 en un estudio realizado en Taiwan en 47 pacientes con LLC, encontraron fenotipo B en 45 pacientes (95,74 %) y en 2 pacientes fenotipo T (4,25 %).8,9 El ligero incremento en cuanto a frecuencia hallada en la LLC-T en este trabajo, podría deberse a variaciones individuales en nuestro medio.
El comportamiento fenotípico de la LLC-T se corresponde con lo descrito por otros autores, con expresión de los Ags pan-T CD2, CD3 y CD5. Llama la atención que sólo 2 pacientes (25 %) tuvieron fenotipo auxiliador, hecho para el cual no encontramos una razón plausible. En el 50 % de los enfermos se encontró coexpresión de los Ags CD4 y CD8. Este hallazgo ha sido reportado en la literatura en muy pocos casos, a pesar de que las LLC-T son definidas como leucemias postímicas.8,25,26
La frecuencia antigénica hallada en los pacientes con LLC-B es similar a la reportada por otros autores. Dwilewicz-Trojaczek en su análisis inmunofenotípico de 54 casos con LLC-B, encontró que el 100 % expresaron el Ag CD5, 97 % el CD19, 82 % el HLA-DR, 79 % la lgS y 67 % el CD22.27 Sin embargo, aunque la expresión del Ag CD5 por las células neoplásicas se considera como un criterio diagnóstico para la LLC-B, es bien conocido que de 7-20 % de los pacientes no expresan este Ag,28,29 lo que concuerda con el resultado de este trabajo, en el que no hubo expresión de este marcador en el 18,86 % de los casos estudiados.
Se encontró pobre expresión de Ags mielomonocíticos como el CD11b y el CD11c en las células de los pacientes con LLC-B, similar a los resultados de otras investigaciones, y algunos lo consideran restringido a las LLC-B CD5-. La expresión del CD11b disminuye en las etapas avanzadas de la enfermedad. El CD11c esta expresado en los enfermos en fase temprana y su expresión es útil para realizar el diagnóstico diferencial con otros desórdenes linfoproliferativos crónicos de la célula B.30,32
El Ag CD8 se expresa normalmente sobre linfocitos T, células NK (asesinas naturales) y la mayoría de los timocitos, pero no se detecta sobre linfocitos B normales. En casos esporádicos de LLC-B se ha detectado sobre células B neoplásicas. Mulligan y otros33 encontraron expresión aberrante del CD8 en 10 casos de LLC-B, mientras que otros autores como Rolinski y Attadia34,35 lo comunican en 1 solo paciente, lo que guarda relación con los resultados de este estudio, donde este Ag sólo se expresó en 2 pacientes (3,77 %).
Las células de la LLC-B tienen un repertorio inmunológico diferente al observado en otros trastornos linfoproliferativos crónicos B. El fenotipo característico de esta enfermedad, CD5+, con débil expresión de lg de superficie y expresión débil o ausente del CD22 de membrana, se ha descrito en varias series.1,2,36 En nuestro trabajo se manifestó una expresión alta del CD22 sólo en el 22,64 % de los pacientes, y de lgS en el 16,39 %. Llama la atención que la sobreexpresión de este último Ag se diagnosticó en el 50 % de los pacientes con LLC-B CD5-. Esto concuerda con otras series. La baja expresión de la lgS va aparejada a una mayor sobrevida de los enfermos.37
La expresión de cadenas ligeras de lg no es una característica inusual de la LLC-B, y puede tener implicación en la presentación clínica o el pronóstico a corto plazo de esta enfermedad. Otros autores en estudios retrospectivos con LLC-B, encontraron que la expresión de cadenas ligeras fue débil en el 73 % de los casos, y fuerte en el 24 %, lo que se corresponde con los hallazgos de nuestro estudio.
La LLC continúa atrayendo mucho interés en cuanto a la investigación básica y clínica. A pesar de los recientes avances, no se ha establecido aún la curación de esta enfermedad. La caracterización más detallada de las células linfoides por métodos inmunofenotípicos, los avances en la comprensión de la biología celular y los defectos moleculares presentes en esta enfermedad, contribuirán significativamente a un mejor diagnóstico y tratamiento de los enfermos.
Summary
A phenotypic study of cells from peripheral and bone marrow blood of 61 patients with chronic lymphocytic leukemia was made by two methods of cellular immunophenotyping: immunocytochemical ultramicromethod and alkaline phosphatase/ anti-alkaline phosphatase. Fifty three of the patients studied (86,88%) were phenotype B whereas 8 (13,11%) were phenotype T. In 50% of patients with CLL-T there was a co-expression of CD4 and CD8; the most frequent antigens among patients with CLL-B were CD19 (85%); CD5(81,13%), HLA-DR (74.47%), IgS (60,3%) and CD22 (56,6%). There was no expression of antigen CD5 in 10 patients. Regarding the relative frequency of CLL subtypes, there was a higher number of patients with chronic lymphocytic leukemia T than the number stated for this entity.
Subject headings: LEUKEMIA, LYMPHOCYTIC/immunology; IMMUNOPHENOTYPING; ANTIBODIES, MONOCLONAL; BONE MARROW.
Referencias bibliográficas
- DiGiuseppe JA, Borowtz MI. Clinical utility of flow cytometry in the chronic lymphoid leukemias. Semin Oncol 1998; 25:6-10.
- Kipps TJ. Chronic lymphocytic leukemia and related diseases En: Beutler E, Lichtman M, Coller B, Kipps T, ed. William´s Hematology. 5 ed. Londres: Mc Graw-Hill; 1995.p. 1017.
- Matutes E, Polliack A. Morphological and immunophenotypic features of chronic lymphocytic leukemia. Rev Clin Exp Hematol 2000;4:22-47.
- Gottardi D, Alfarano A, De Leo AM, Stacchini A, Aragno A, Rigo A. In leukaemic CD5+B- cells the expression of bcl-2 gene family is shifted toward protection from apoptosis. Br J Hematol 1996;94:612-8.
- Dighiero G, Binet JL. Chronic lymphocytic leukemia. Hematol Cell Ther 1996;38:841-61.
- Diehl LF, Karnell LH, Menck HR. The American College of Surgeon Commissi on Cancer and the American Cancer Society. The National Cancer Data Base report on age, gender, treatment, and outcomes of patients with chronic lymphocytic leukemia. Cancer 1999;86:2684-92.
- Foon KA, Gale RP. Is there a T- cell form of chronic lymphocytic leukemia. Leukemia 1992;6:867-73.
- Hoyer JD, Ross CW, Li CY, Witzig TE, Gascoyne RD, Dewald GW, et al. True T- cell chronic lymphocytic leukemia. A morphologic and immunophenotypic study of 25 cases. Blood 1995;86:1163-9.
- Gahn B, Wenderburg B, Troff C, Nalf J, Grove D, Haferlach T, et al. Analysis of progenitor cell involvement in B-CCL by silmultaneous immunophernotypic analysis of the single cell level. Br J Haematol 1999;105:955-9.
- Kneitz C, Goller M, Wilhelm M, Mehringer C, Wohlleben G, Schimpl A, et al. Inhibition of T cell/B-CLL cells. Leukemia 1999;13:98-104.
- Molica S. Infections in chronic lymphocytic leukemia: rinsk factors, and impact on survival, and treatment. Leuk Lymphoma 1994;13:203-14.
- Keating MJ. Chronic lymphoytic leukemia. Semin Oncol 1999;26:107-14.
- D´ Arena G, Keating MJ, Carotenuto M. Chronic lymphoproliferative disorders: and integrated proint of view for the differential diagnosis. Leuk Lymphoma 2000;36:225-37.
- Van Dongen JJM, Adriaansen HJ. Immunobiology of leukemia. En: Henderson ES, Lister TA, Greaves MF, ed. Leukemia. 6a ed. Philadelphia: WB Saunders; 1996. p. 83-130.
- Suárez LE, Cruz C, Rivero RA. Ultramicrométodo inmunocitoquímico. Titulación de anticuerpos utilizados para el inmunofenotipaje celular. Rev Cubana Hematol Inmunol Hemoter 1995;111: 57-62.
- Rivero RA, Bello M, Suárez LE, Cruz C, Martínez M, Palma L. Introducción de un ultramicrométodo inmunocitoquímico para la cuantificación de subpoblaciones linfocitarias identificadas con anticuerpos monoclonales. Rev Cubana Hematol Inmunol Hemoter 1995;11:46-56.
- Cordell F, Fallini B, Erber WM. Immunoenzymatic labelling of monoclonal antibodies using immune complexes of alkaline phosphatase and monoclonal anti-alkaline phosphatase. J Histochem Cytochem 1984;32:219-29.
- Böyum A. Isolation of mononuclear cells and granulocytes from human blood. Scand J Clin Lab Invest 1968;21:77-89.
- Hsi ED, Hoeltge G, Tubbs RR. Biclonal chronic lymphocytic leukemia. Am Clin Pathol 2000;113:798-804.
- Finn WG, Thangavelu M, Yelavarthi KK, Goolsby CL, Tallman MS, Traynor A, et al. Karyotype correlates with peripheral blood morphology and immunophenotype in chronic lyphocytic leukemia. Am J Clin Pahol 1996;105:458-87.
- Hjalman V, Carlsson M, Kimby E. Chronic lymphocytic leukaemia at a county hospital in southern Sweden. Med Oncol 1996;13:95-101.
- De Lima M, O´ Brien S, Lerner S, Keating MJ. Chronic lymphocytic leukemia in young patient. Semin Oncol 1998;25:107-16.
- Hernández P. Leukemia linfoide crónica. Aspectos clínicos y biológicos. Rev Cubana Hematol Inmunol Hemoter 1999;15:7-20.
- Chen PM, Lin SH, Fan SH, Chiou TJ, Hsich RK, Yul T, et al. Genotypic characterization and multivariate survival analysis of chronic lymphocytic leukemia in Taiwan. Int J Acta Haematol 1997;97:196-204.
- Murakami K, Taketazu F, Ida M, Ito K, Yamazaki L, Oshimi K. Truesmoll lymphocytic leukemia lacking the CD3 molecule and TCR- alpha beta on its cell surface. Int J Hematol 1999;70:169-73.
- Mizuki M Tahawa S, Machii T, Shibano M, Tatsumi E, Tsubaki K, et al. Phenotypical heterogeneity of CD4+CD8+double- positive chronic T lymphoid leukemia. Leukemia 1998; 12: 499-504.
- Dwilewicz -Trojaczek. Chronic lymphocytic leukemia from B CD5+ cell: characteristics, clinical and laboratory features, and immunophenotyping. Pol Tyg Lek 1995;50:12-4.
- Huang JC, Finn WG, Goolsby CL, Variakoji D, Perterson LC. CD5 small B-cell leukemias are rarely classifiable as chronic lymphocytic leukemia. Am J Clin Pathol 1999;111:123-30.
- Cartron G, Linassier C, Bremond JL, Desablens B, Georget MT, Finbel B, et al. CD5 negative B- cell chronic lymphocytic leukemia: Clinical and biological features of 42 cases. Leuk Lymphoma 1998;31:209-16.
- Molica S. Prognostic value of biological variables in B- cell chronic lymphocytic leukemia. Can we improve upon clinical parameters?. Haematologica 1997; 82: 705-9.
- Eksioglu- Demiralp E, Alphogan O, Aktan M, Firatli T, Ozturk A, Budak T, et al. Variable expression of CD49d antigen in B-cell chronic lymphocytic leukemia is related to disease stages. Leukemia 1996;10:1331-9.
- Morotta G, Raspadori D, Sestigiani C, Scalia G, Bigazzi C, Lauria F. Expression of the CD11c antigen in B-cell chronic lymphoproliferative disorders. Leuk Lymphoma 2000; 37: 145-9.
- Mulligan SP, Dao LP, Francis SE, Thomas ME, Gibson J, Cole- Sinclair MF, et al. B- cell chronic lymphocytic leukaemia with CD8 expression: report of 10 cases and immunochemical analysis of the CD8 antigen. Br J Haematol 1998;103:157-62.
- Rolinski J, Rupniewska ZM, Wasik- Szozepsnek EA. A case of chronic lymphocytic leukemia with expression of CD8 antigen on leukemic cell. Pol Arch Med Wewn 1998; 99: 48-55.
- Attadia V, Alosi M, Impronta S, Baccarani M, De Paoli P. Immunophenotypic and molecular genetic characterization of a case of CD8+B cell chronic lymphocytic leukemia. Leukemia1996;10:1544-50.
- Geisler CH, Philip P, Christensen BE, Hou-Jensen K, Pedorsen N T, Jensen OM, et al. In B- cell chronic lymphocytic leukaemia chromosome 17 abnormalities and not trisommy 12 are the single most important cytogenetic abnormalities for the prognosis: a cytogenetic and immunophenotypic study of 480 unselected newly diagnosed patients. Leuk Rev 1997;21:1011-23.
- Molica S, Levato D, Dattilo A, Mannella A. Clinic-prognostic relevance of quantitative immunophenotyping in B- cell chronic lymphocytic leukemia with emphasis on the expression of CD20 antigen and surface immunoglobulins. Eur J Haematol 1998;60:47-52.
Recibido: 5 de septiembre del 2002. Aprobado: 2 de octubre del 2002.
Dra. Miriam Sánchez Segura. Instituto de Hematología e Inmunología. Apartado 8070, CP 10800, Ciudad de La Habana, Cuba. Tel. (537) 57-8268. Fax (537) 44-2334. e-mail: ihidir@hemato.sld.cu