My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Hematología, Inmunología y Hemoterapia
Print version ISSN 0864-0289On-line version ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter vol.18 no.3 Ciudad de la Habana Sept.-Dec. 2002
Producción
Instituto de Hematología e Inmunología
Obtención de un preparado del componente C1 (q,r,s) del sistema complemento
Lic.Julio C. Merlín Linares, Lic. Rinaldo Villaescusa Blanco, Lic. Ada A. Arce Hernández y Lic. Ana M. Guerreiro Hernández Resumen
Se obtuvo un preparado concentrado del componente C1 (q, r, s) del sistema completo en forma inactiva por un método de precipitación, libre de contaminación con los restantes componentes iniciales de la vía clásica, el C2 y el C4. Este preparado se mantuvo estable a 2 °C y en los ensayos funcionales fue capaz de fijarse al complejo EAC4, activar los componentes C2 y C4 para formar la convertasa del C3, y provocar la lisis de estas células. La reacción de hemólisis fue activada por el C2 e inhibida por el Cl inhibidor, lo que indica la especificidad del C1 obtenido.Este pudiera emplearse para lograr un antisuero específico, para la obtención de los subcomponentes C1q, C1r y C1s, o para la estandarización de métodos funcionales de estudiar el C1, el C2 o el C1 inhibidor.
DeCS: VIA CLASICA DEL COMPLEMENTO; COMPLEMENTO 1; COMPLEMENTO 1Q; COMPLEMENTO 1R; COMPLEMENTO 1S; COMPLEMENTO 2; COMPLEMENTO 4.
El sistema complemento constituye un mecanismo efector de la respuesta inmune que normalmente actúa en la eliminación de agentes patógenos, inmunocomplejos y células apoptóticas,1-4 y que participa además en procesos de interacción celular vinculados con el fenómeno inflamatorio, la inducción de la formación de anticuerpos y el mantenimiento de la tolerancia.5-7
Se han reportado alteraciones genéticas de los componentes iniciales de la vía clásica del sistema complemento que han estado relacionadas con alteraciones de la respuesta inmune e infecciones recurrentes,8 el desarrollo de enfermedades autoinmunes como el lupus eritematoso sistémico y otras,9-12 así como con deficiencias selectivas de algunas subclases de inmunoglobulinas.13
El estudio de las deficiencias de estos componentes resulta difícil debido a la necesidad de contar con antisueros específicos, componentes aislados altamente purificados, reactivos biológicos especiales (sueros deficientes en los componentes a estudiar) o intermediarios celulares (eritrocitos recubiertos con anticuerpos antiestromas y componentes aislados puros o sus fragmentos activados), que son difíciles de preparar.14-16
Este trabajo se realizó con el objetivo de obtener un preparado del componente C1 del sistema complemento que pudiera ser utilizado para el estudio de las deficiencias de este componente.
Métodos
Preparación de Cl. El preparado de C1 inactivo se obtuvo añadiendo 200 mL de suero normal humano sobre 4 L de H2O destilada a 2 °C ajustada a pH 7,4 con NaOH 1M,17 que contenía 5 mM CaCl2.18 Se agitó la suspensión durante 2 h, se dejó reposar en frío durante 16 h y se centrifugó a 2 500 ´ g durante 30 min. El precipitado se resuspendió en 50 mL de solución amortiguadora de acetato de sodio 40 mM, pH 5.5, 5 mM CaCl2 y se centrifugó la mezcla. Este nuevo precipitado se redisolvió en una solución amortiguadora de fosfato 50 mM que contenía NaCl al 1,8 % y 5 mM CaCl2, y se conservó a 2 °C hasta su uso.
Preparación del componente C2 y del C1 inhibidor19Se dializaron 100 mL de suero humano normal contra una solución amortiguadora de fosfatos 10 mM, 0,05 M NaCl, pH 7,0 y se aplicaron en una columna de 200 mL de DEAE Sephacel equilibrada con la misma solución. Se aplicó un gradiente de NaCl de 0,05 - 0,2 M. El C2 se detectó mediante la determinación de la actividad hemolítica de cada una de las fracciones frente al EAC14. El componente C4 y el C1 inhibidor se detectaron por inmunoelectroforesis con suero antiproteínas séricas totales humanas y por inmunodifusión con antisueros monoespecíficos comerciales. El C1 inhibidor se purificó adicionalmente en una columna de resina CM52 equilibrada a pH 5,0, eluyendo en las primeras fracciones.
Preparación de EAC420Los eritrocitos de carnero lavados con solución amortiguadora de Veronal-EDTA, se suspendieron en esa misma solución a 109 células/mL. Las células se mezclaron a temperatura ambiente con 10 mL de antisuero antiestroma inactivado con calor, incubando 10 min a temperatura ambiente para formar el complejo EA. Después se enfrió a 0 °C y se convirtieron en EAC1 añadiendo 2 mL de la solución de C1 parcialmente purificado. Para obtener el EAC4 se mezclaron 5 mL de suero con 45 mL de solución de Veronal-EDTA, se incubó durante 15 min a 37 °C, se enfrió y se añadió rápidamente a la suspensión de células. La mezcla se incubó otros 15 min a 0 °C. Se lavaron las células con la solución amortiguadora de Veronal (sin EDTA) y se ajustó la preparación a 1,5 ´ 108 células/mL.
Ensayo para la determinación de la actividad hemolítica del C1 y C2 obtenidos21
El método consistió en mezclar 0,5 mL del C1 parcialmente purificado con 0,5 mL de solución amortiguadora de Veronal (o de C1 inhibidor), e incubar durante 30 min a 30 °C. La actividad residual del C1 se determinó añadiendo 0,5 mL de solución amortiguadora de Veronal que contenía 5 ´ 107 células/mL e incubando durante 30 min a 30 °C. La actividad residual del C1 se determinó añadiendo 0,5 mL de solución amortiguadora de Veronal que contenía 5 ´ 107 células/mL e incubando durante 30 min a 30 °C. Se añadieron 0,5 mL del C2 purificado y se incubó durante 20 min a 30 °C. Este tratamiento convirtió todo el EAC14 en EAC142. La lisis se completó añadiendo 1,5 mL de C-EDTA (suero diluido 1:25 con 0,04 M EDTA en solución de Veronal). Después de 60 min a 37 °C, se añadieron 4 mL de NaCl 0,15 M, se sedimentaron las células por centrifugación y se leyó a 414 nm.
Resultados
Para la obtención del componente C1 se partió de 200 mL de suero humano normal, que se sometieron a una precipitación en un medio de baja fuerza iónica y en presencia de iones calcio. Se obtuvieron 50 mL de un preparado de C1 inactivo que se mantuvo estable durante varias semanas a 2 °C, conservando su capacidad para activarse en presencia del complejo EA. Esta preparación de C1 se utilizó en los ensayos de hemólisis para formar los intermediarios celulares EAC14 y EAC4.
En la cromatografía de intercambio iónico en gel de DEAE Sephacel el C2 eluyó en el primer pico (I), en el que se detectó la actividad hemolítica de este componente frente al EAC14. La preparación del componente C2 obtenida no contenía C4. A valores superiores de concentración salina se obtuvieron varios picos no completamente resueltos (II, III y IV). El C1 inhibidor eluyó de la columna en las fracciones correspondientes a concentraciones de NaCl entre 0,13 y 0,15 M, las cuales contenían, entre otras impurezas, el componente C4. La cromatografía de intercambio iónico en CM celulosa permitió obtener el C1 inhibidor con un mayor grado de pureza, eliminando entre otras la contaminación por el C4, el cual quedó retenido en la columna.
La actividad de la preparación del componente C1 (q, r2, s2) obtenido se detectó mediante el ensayo de hemólisis de EAC4 en presencia de C2 y los restantes componentes del sistema (C-EDTA); se observó que en ausencia de C2 la actividad hemolítica fue aproximadamente 5 veces menor (fig. 1).
Fig. 1. Hemólisis de EAC4 en presencia de C-EDTA. Influencia del C2.
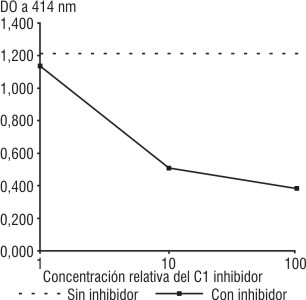
Al incorporar el C1 inhibidor a la mezcla de reacción del ensayo anterior, la actividad residual del C1 disminuyó, y se observó una disminución de la hemólisis proporcional a la cantidad de C1 inhibidor añadido (fig. 2).
Fig. 2. Hemólisis de EAC4 en presencia de C2 y C-EDTA. Influencia del C1 inhibidor.
Discusión
La aplicación de tecnologías avanzadas al estudio de las más de 30 proteínas que forman el sistema complemento, ha permitido obtener en los últimos años una gran cantidad de información acerca de la genética, estructura, propiedades y funciones de estas proteínas.22-25 Numerosos estudios han estado encaminados a profundizar el conocimiento de las proteínas que participan en la vía de las manosas,26-28 y en la participación del complemento en la apoptosis.3,4,29,30
Para el estudio del primer componente de la vía clásica de activación del complemento (C1q, r, s) se ha empleado un método funcional basado en la hidrólisis de un éster usado como sustrato artificial y la titulación del ácido liberado,17 que no resulta aplicable a muestras de suero. Otros métodos están basados en la hemólisis de EA en presencia de un suero deficiente en C1 preparado por cromatografía o por calentamiento.31
En nuestro trabajo, a partir de un suero humano normal, se obtuvo una preparación del componente C1 por precipitación en un medio de baja fuerza iónica17 y en presencia de iones calcio,18 para garantizar la estabilidad de la macromolécula nativa del complejo formado por el C1q, C1r2 y C1s2. En estas condiciones, los restantes componentes del sistema complemento se mantuvieron en solución.
El ensayo de hemólisis de EAC4 en presencia del C2 obtenido y los restantes componentes del sistema (C-EDTA), permitió comprobar la capacidad del C1 para fijarse al complejo, para activarse y actuar sobre el C4 y el C2, dando lugar a la formación de la convertasa del C3.
La actividad de la preparación disminuyó en ausencia de C2 y se observó una disminución de la hemólisis proporcional a la cantidad de C1 inhibidor añadido, lo que confirmó que la hemólisis fue debida a la actividad específica del C1.
En el presente trabajo se empleó el C1 obtenido para la preparación de los intermediarios celulares EAC14 y EAC4, y como control para los ensayos de hemólisis. Este componente puede emplearse para la purificación de 1q, C1r y C1s por disociación con EDTA, o para la obtención de un suero anti C1, previa purificación por cromatografía. Mediante la modificación adecuada del ensayo de hemólisis utilizado en este trabajo, este puede aplicarse a la determinación del componente C1, del C2 o del C1 inhibidor.
Summary
A concentrated preparation of component C1 (q,r,s) of the complement system in an inactive form was obtained by a precipitation method, free of contamination with the rest of the initial components of the classical pathway, that is, C2 and C4. This preparation remained stable at 2°C and in the functional assays, it was able to bind to complex EAC4, to activate components C2 and C4 to form convertase C3 and cause lysis of these cells. Hemolysis reaction was activated by C2 and inhibited by C1 inhibitor, which indicates the specificity of the obtained C1. This preparation can be used to attain a specific antiserum to obtain subcomponents C1q, C1r and C1s or to standardize the functional methods of study of C1, C2 and C1 inhibitor.
Subject headings: COMPLEMENT PATHWAY, CLASSICAL; COMPLEMENT 1; COMPLEMENT 1Q; COMPLEMENT 1R; COMPLEMENT 1S; COMPLEMENT 2; COMPLEMENT 4.
Referencias bibliográficas
- Walport M J. Complement-first of two parts. N Engl J Med 2001; 344 (14): 1058-66.
- ————. Complement-second of two parts. N Engl J Med 2001; 344 (15): 1140-4.
- Fishelson Z, Attali G, Mevorach D. Complement and apoptosis. Mol Immunol 2001; 38 (2-3): 207-19.
- Utz PJ, Gensler TJ, Anderson P. Death, autoantigen modifications, and tolerance. Artritis Res 2000; (2): 101-4.
- Nielsen CH, Fischer EM, Leslie RGQ. The role of complement in the acquired immune response. Immunology 2000; 100: 4-12.
- Carroll MC. The role of complement in B cell activation and tolerance. Adv Immunol 2000; 74: 61-88.
- Gommerman JL, Carroll MC. Negative selection of B lymphocytes: a novel role for innate immunity. Immunol Rev 2000; 173: 120-30.
- Whaley K, Schwaeble W. Complement and complement deficiencies. Sem Liver Dis 1997; 17 (4): 297-310.
- Walport MJ, Davies KA, Botto M. C1q and systemic lupus erythematosus. Immunobiology 1998; 199: 265-85.
- Stone NM, Williams A, Wilkinson JD, Bird G. Systemic lupus erythematosus with C1q deficiency. Br J Demartol 2000; 142 (3): 521-4.
- Lipsker DM, Schreckenberg-Gilliot C, Uring-Lambert B, Meyer A, Hartmann D, Grosshans EM, et al. Lupus erythematosus associated wiht genetically determined deficiency of the second componet of the complement. Arch Dermatol 2000; 136 (12): 1508-14.
- Chen Z, Koralov SB, Kelsoe G. Complement C4 inhibits systemic autoimmunity through a mechanism independet of complement receptos CRI and CR2. J Exp Med 2000; 192 (9): 1339-52.
- Attwood JT, Williams Y, Feighery C. Impaired IgG responses in a child with homozygous C2 deficiency and recurrent pneumococcal septicemia. Acta Paediatr 2002; 90 (1): 99-101.
- Naish PF, Barratt J, Collins C. A new haemolytic assay for the second component of complement (C2) in human serum. Clin Exp Immunol 1976; 25 (3): 487-9.
- Kerr MA, Porter RR. The purification and properties of the second component of human complement. Biochem J 1978; 171 (1): 99-107.
- Asghar SS, Out J, ven der Helm HJ. Simple method for preparing the cellular intermediate EAC14, and its use for estimation of the second component of complement. Clin Chem 1986; 32 (4): 678-9.
- Lachmann PJ, Hobart MJ. Complement Techonology. En: Weir DM, ed. Immunochemistry. 3rd. ed. Oxford: Blackwell Scientific Publications; 1978. p. 1-23.
- Gígli I, Porter RR, Sim RB. The unactivated for of the first component of human complement, C1. Bochem 1976; 157 (3): 541-8.
- Reboul A, Arlaud GJ, Sim RB, Colomb MG. A simplified procedure for the purification of plasma C1inactivator from human plasma. Interaction with complement subcomponents C1r and C1s: FEBS Let 1977; 79 (1): 45-50.
- Borsos T, Rapp H. Immune hemolisis: a simplified method for the preparation of EAC4 with guinea píg or human complement. J Immunol 1067; 99 (2): 263-8.
- Tamura N, Nelson RAJ. Three naturally-occurring inhibitors of components of complement in guinea pig and rabbit serum. J Immunol 1967; 99 (3): 582-9.
- Topaloglu R, Bakkaloglu A, Slingsby JH, Ayditug O, Besbas N, Saatcci U, et al. Survey of Turkish systemic lupus erythematosus patients for a particular mutation of C1Q deficiency. Clin Exp Rheumatol 2000; 18 (1): 75-7.
- Sanal O, Yel L, Tezcan I, Ersoy F, Berkel AI. Homozygous C2 deficiency: association with defective alternative pathway function and immunoglobulin deficiency. Int Arch Allergy Immunol 1996; 110 (2): 195-8.
- Zhu ZB, Atkinson TP, Volanakis JE. A novel type II complement C2 deficiency allele in an African-American family. J Immunol 1998; 161 (2): 578-84.
- Yu CY. Molecular genetics of human MHC complent gene cluster. Exp Clin Immunogent 1998; 15 (4): 213-30.
- Matsushita M, Fujita T. Activition of the classical complement pathway by mannose-binding protein in association with a novel C1s-like serine protease. J Exp Med 1992; 176: 1497-502.
- Sato T, Endo Y, Matsushita M, Fujita T. Molecular characterization of a novel serine protease involved in activation of the complement system by mannose-binding protein. Int Immunol 1994; 6: 665-9.
- Thiel S, Vorup-Jensen T, Stover CM, Schwaeble W, Laursen SB, Poulsen K, et al. A second serine protease associated with mannan-binding lectin that activates complement. Nature 1997; 386: 506-10.
- Taylor PR, Carugati A, Fadok VA, Cook HT, Andrews M, Carroll MC, et al. A hierrarchical role for classical pathway complement proteins in the clearance of apototic cells in vivo. J Exp Med 2000; 192 (3): 359-66.
- Botto M. Links between complement deficiency and apoptosis. Artritis Res 2001; 3 (4): 207-10.
- Siegel RC, Shumaker VN, Poon PH. Stoíchiometry and sedimentation properties of the complex formed between the C1g and C1rC1s2 subcomponents of first component of the complement. J Immunol 1981; 127 (6): 2447-52.
Recibido: 27 de marzo de 2003. Aprobado: 1 de abril de 2003.
Lic. Julio C. Merlín Linares. Instituto de Hematología e Inmunología. Apartado 8070, CP 10800, Ciudad de La Habana, Cuba. Tel (537) 578268. Fax (537) 442334. e-mail: ihidir@hemato.sld.cu