My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Hematología, Inmunología y Hemoterapia
On-line version ISSN 1561-2996
Rev Cubana Hematol Inmunol Hemoter vol.27 no.1 Ciudad de la Habana Jan.-Mar. 2011
ARTÍCULOS ORIGINALES
Experiencia cubana con el uso terapéutico de células madre adultas
Cuban experience with the therapeutic use of adult stem cells
Prof. DrC. Porfirio Hernández-Ramírez,I Dr. Amel Alfonso-Simón,II Dr. José L. Aparicio-Suárez,II Dr. Heriberto Artaza-Sanz,III Dra. Aymara Baganet-Cobas,I Dra. Ángela Blanco-Díaz,III Dra. Maritza Cabrera-Zamora,IV Dr. Fernando Cruz-Tamayo,V Dr. Antonio J. Díaz-Díaz,VI Dr. Francisco Díaz-Ramírez,VII Dra. Elvira Dorticós-Balea,I Dr. Julio Fernández-Águila,IV Dr. Rafael García-Ibarra,III Dr. Pedro Goicoechea-Díaz,III Lic. Tania González-Suárez,I Lic. Ana I. González-Iglesias,I Dr. Alberto Hernández-Cañero,VIII Dra. Rosa M. Lam-Díaz,I Lic. Lisset León-Amado,VI DraC. Consuelo Macías-Abraham,I Dr. Raúl Macías-González,IX Lic. María de los Á. Martínez-de Pinillos,I Dr. Ángel Obregón-Santos,X Dra. Amalia Peix-González,VIII Dra. Amparo Pérez-Borrego,VII Dra. Natalia Pol-Marró,III Lic. Berta B. Socarrás-Ferrer,I Dr. Carlos Suárez-Monteagudo,IX Lic. Lázaro O.del Valle-Pérez,I Dr. Mario Wilford-de LeónX
I Instituto de Hematología e Inmunología (IHI). Ciudad de La Habana, Cuba.
II Hospital Docente Provincial "Arnaldo Milián Castro". Villa Clara, Cuba.
III Hospital General Docente "Enrique Cabrera". Ciudad de La Habana, Cuba.
IV Hospital "Gustavo Aldereguía Lima". Cienfuegos, Cuba.
V Hospital "Lucía Íñiguez". Holguín, Cuba.
VI Hospital Docente Provincial "Abel Santamaría Cuadrado". Pinar del Río, Cuba.
VII Hospital Pediátrico Docente "William Soler". Ciudad de La Habana, Cuba.
VIII Instituto de Cardiología y Cirugía Cardiovascular (ICCCV). Ciudad de La Habana, Cuba.
IX Centro Internacional de Restauración Neurológica (CIREN). Ciudad de La Habana, Cuba.
X Centro de Investigaciones Médicoquirúrgicas (CIMEQ). Ciudad de La Habana, Cuba.
RESUMEN
Las investigaciones básicas y clínicas realizadas en los últimos años sobre las células madre y sus posibilidades terapéuticas, son en la actualidad uno de los temas más excitantes de la medicina contemporánea. Ya se han obtenido importantes avances en el estudio y aplicación de las células madre adultas que muestran notables ventajas sobre las embrionarias, pues su manipulación resulta más simple, económica y se pueden obtener del propio individuo que va a ser tratado. Para la introducción en Cuba de la terapia celular regenerativa, en el Instituto de Hematología e Inmunología se seleccionaron como fuentes celulares las células madre adultas derivadas de la médula ósea y las movilizadas a la sangre periférica. Para facilitar la extensión del tratamiento a otros centros hospitalarios, se estandarizó una técnica para la movilización de las células madre hematopoyéticas a la sangre periférica, mediante un factor estimulador de colonias de granulocitos (Filgrastim, de producción nacional) y se desarrolló un método simple, económico y también más tolerable para los enfermos. De esta forma, se ha extendido la terapia celular a 6 provincias cubanas y hasta abril del año 2009 se habían tratado 563 casos con trasplante de células madre adultas autólogas, de los cuales el 81,7 % corresponde a pacientes con enfermedades angiológicas, en los que se ha logrado disminuir significativamente la indicación de amputaciones mayores. También los resultados han sido muy prometedores en las lesiones óseas y procesos periodontales, entre otras enfermedades tratadas. Los resultados obtenidos hasta el momento se pueden considerar como un nuevo logro de la ciencia revolucionaria y de nuestros sistemas nacionales de salud y de ciencia y técnica. El método empleado es un proceder económico y factible para instituciones con recursos limitados.
Palabras clave: células madre adultas, Angiología, Cardiología, Ortopedia, Periodoncia, Neurología, psoriasis.
ABSTRACT
The basic and clinical researches carried out during past years on the stem cells and its therapeutic possibilities are at present times, one of the most interesting subjects of the contemporaneous medicine. There are advances in the study and application of adult stem cells showing remarkable advantages on the embryonic ones, since its handling is more simple, economic and they are obtained from the own subject to be treated. For the introduction in Cuba of the regenerative cellular therapy in the Institute of Hematology and Immunology the cellular sources selected were the adult stem cells derived from bone marrow and the mobilized ones to the peripheral blood. To make easy the expansion of treatment to other hospital centers, authors standardized a technique for the mobilization of the hematopoietic stem cells to peripheral blood using a granulocyte colony-stimulating factor (Filgrastim, of national production) developing a simple, economic and more tolerable method for patients. In this way, the cellular therapy has been expanded to 6 Cuban provinces and until April, 2009 562 cases with autologous adult stem cells transplant have been treated, from which the 81.7% to correspond to patients presenting with Angiology diseases with a significant reduction of major amputations. Also, the results have been very promising in the bone lesions and periodontal processes among other diseases treated. The results obtained until now may be considered as a new achievement of revolutionary science and of our national health systems and of science and technique. The method used is an economic and feasible procedure for the institutions with scarce resources.
Key words: Adult stem cells, Angiology, Cardiology, Orthopedics, Periodontia, Neurology, psoriasis.
INTRODUCCIÓN
Las investigaciones básicas y clínicas realizadas en los últimos años sobre las células madre y sus posibilidades terapéuticas y en particular, de las adultas, han dado lugar a lo que se ha llamado por algunos "una nueva revolución en la medicina", pues se han obtenido evidencias de que la potencialidad de algunos tipos de células madre adultas es mayor de lo que se pensaba, ya que ellas han mostrado en determinadas condiciones específicas, capacidad para diferenciarse en células de diferentes linajes. En la actualidad, este es uno de los temas más excitantes de la medicina contemporánea.1
Según su estado evolutivo, las células madre pueden clasificarse en 2 tipos principales: las embrionarias y las adultas.2 A pesar de que las células madre embrionarias de ratón se venían estudiando desde el inicio de los años 80 del siglo pasado, no fue hasta 1998 que se obtuvieron las primeras células madre embrionarias de procedencia humana, lo que abrió un nuevo campo de investigación y posibilidades de aplicación práctica, teniendo en cuenta la potencialidad de estas células para convertirse en células de diferentes tipos. Desde entonces, un gran cúmulo de investigaciones básicas han aportado destacados conocimientos relacionados con la biología celular y la potencialidad diferencial de las células madre.
Todo esto ha llevado a una intensa confrontación científica entre los que apoyan la utilización de células embrionarias y los que defienden las ventajas de las células madre adultas. En este sentido, se han obtenido importantes avances en el estudio y aplicación de las células madre adultas, ya que ellas muestran notables ventajas sobre las embrionarias, pues su manipulación resulta más simple, pueden ser autólogas y, por lo tanto, no ocasionan trastornos inmunológicos, no presentan limitantes éticas ni legales, ni tampoco se ha comprobado que produzcan neoplasias, lo que contrasta positivamente con las características de las células embrionarias, cuya obtención y expansión son más complejas, tienen potencial inmunogénico por ser alogénicas, enfrentan problemas éticos y legales, y además, producen un alto porcentaje de tumores en los animales de experimentación.2
Entre las principales células madre con potencialidad terapéutica se han señalado las embrionarias, las fetales, las amnióticas, las de la sangre del cordón umbilical, las adultas y más recientemente, las células con características embrionarias que se han obtenido mediante la reprogramación de células adultas y que se han llamado células madre pluripotentes inducidas.3,4 La experiencia acumulada con el uso de la célula madre hematopoyética (CMH) y su mayor facilidad de obtención, comparada con otras células madre adultas identificadas, han hecho que las investigaciones y aplicaciones con este tipo celular hayan avanzado rápidamente. Estos hechos han dado lugar a grandes expectativas en cuanto a la aplicación clínica de las células madre adultas para el tratamiento de diversas enfermedades crónicas que en la actualidad resultan incurables por los métodos existentes.
El tratamiento con células madre ha dado lugar a un nuevo tipo de tratamiento que se puede catalogar como terapia celular regenerativa. El empleo de las CMH con fines regenerativos, es en la actualidad un tema de gran interés para la comunidad científica, como lo fueron en su época sus antecesores representados por la transfusión sanguínea y el trasplante de médula ósea, que son ya procederes habituales y de reconocido valor.5
Se conoce que la médula ósea contiene no solo CMH, sino también otros tipos de células.2 Entre estos se encuentran las células progenitoras endoteliales, procedentes del hemangioblasto embrionario, y las células madre mesenquimales. Estas últimas han adquirido gran relevancia en los últimos años por sus potencialidades terapéuticas. Recientemente se han descrito también células CXCR4+, CD34+, CD45¯ con capacidad pluripotencial, llamadas células muy pequeñas, similares a las embrionarias (VSEL-cells, del inglés very small embryonic-like cells).6 En el orden práctico, las células mononucleares derivadas de la médula ósea pueden verse como portadoras de un "coctel" de diferentes células madre adultas.
Las células madre derivadas de la médula ósea, con reconocida plasticidad y capacidad proliferativa, pueden circular en la sangre periférica y migrar a diferentes tejidos distantes, en los que pueden asentarse y contribuir a la regeneración de sitios dañados.
Además, en estas células se ha identificado un receptor específico para quimiocina el CXCR4 (CXC-chemoquine receptor 4), que mediante un sistema de "llave/cerradura" se une con la quimiocina SDF-1, factor 1 derivado del estroma (stromal derived factor 1). La identificación de este sistema ha contribuido a conocer mejor los mecanismos relacionados con la movilización, migración, quimio-atracción y fijación de estas células a los tejidos. También se ha podido interpretar la forma en que actúan diferentes factores movilizadores de estas células, como son el factor estimulador de colonias de granulocitos y el factor estimulador de colonias de granulocitos y macrófagos, que actúan provocando la ruptura del complejo CXCR4/SDF-1 con liberación de las células madre de su "anclaje" tisular; y por otro lado, la de los nuevos agentes movilizadores cuya acción consiste en inhibir o "bloquear" al receptor CXCR4, lo que impide la unión ligando/receptor. Estos productos movilizadores se usan en la medicina regenerativa para facilitar la movilización de las células madre a la sangre periférica para su recolección y posterior implantación. También se han usado en algunas investigaciones para promover el aporte endógeno de células madre, con la finalidad de que un mayor número de células circulantes pueda dirigirse hacia tejidos dañados.7
Todos estos hechos han contribuido a extender la aplicación clínica de la terapia celular regenerativa con células madre adultas.7,8
Por otra parte, se han hecho algunos progresos en el estudio de las células madre embrionarias y en la preparación de las células madre pluripotentes inducidas (con características semejantes a las de las células madre embrionarias), que últimamente se han podido preparar sin la necesidad de usar vectores virales.7,9 Así, se han podido obtener mediante la estimulación con proteínas específicas y también con el uso de un proceder revolucionario como es la formación de células embrionarias in vivo a partir de células adultas, procederes que acercan mucho más estas células a su futura aplicación terapéutica.10 Sin embargo, se considera que deben pasar todavía varios años antes de que estas se puedan introducir en la práctica clínica. Además, todos estos métodos necesitan del apoyo de laboratorios y equipamientos muy sofisticados que los hacen costosos y poco accesibles para la población en general.
Atendiendo a toda esta información y posibilidades que ofrecen las células madre adultas, en Cuba se comenzaron los primeros ensayos clínicos con CMH a partir del año 2004.
Objetivo
Comunicar los resultados obtenidos en Cuba con la introducción terapéutica de las células madre adultas y con la estandarización de un método sencillo de preparación de las células para facilitar su extensión al mayor número posible de centros asistenciales.
MÉTODOS EMPLEADOS PARA LA OBTENCIÓN Y SEPARACIÓN DE LAS CMN
En los primeros estudios se emplearon células mononucleares (CMN) de la médula ósea (CMN-MO) y de la sangre periférica (CMN-SP).
La extracción de la médula ósea se realizó mientras los pacientes estaban bajo anestesia epidural. Se aspiraron 500600 mL de médula ósea de la cresta ilíaca posterior, que se depositaron en bolsas plásticas que contenían CPD-adenina.
Los enfermos se asignaron al azar a uno de 2 grupos. En un grupo, las CMN-MO se recolectaron con un equipo separador de células Fresenius AS 240 (Fresenius AG, Schweinfurt, Alemania) y se concentraron usando su programa BMSC (método automatizado); mientras que en el otro grupo, las células se aislaron mediante un gradiente de densidad con Ficoll-Hypaque (método manual), según el proceder estandarizado que se emplea en nuestro instituto.11 Las células fueron finalmente resuspendidas en solución salina con heparina (10 000 UI / L), con lo que quedaron disponibles para su inyección.
Para la movilización de la CMN-SP, los pacientes recibieron previamente tratamiento con 10µg / kg de factor estimulador de colonias granulocíticas (FECG) humano recombinante de producción nacional (LeukoCIM, CIMAB SA, La Habana, Cuba) administrado por vía subcutánea cada 12 horas hasta un total de 4 dosis. Tres horas después de la última inyección, se obtuvieron 800 - 1000 mL de sangre total de acuerdo con la condición clínica de cada paciente. Posteriormente, las CMN-SP se concentraron por sedimentación después de la adición de hidroxietilalmidón (HES) al 6 % a la sangre extraída, en una proporción de 1 mL de HES x 6 mL de sangre total.12
Con posterioridad se estandarizó este último método para facilitar su extensión a centros asistenciales con recursos limitados.13
Se usó una pequeña fracción de la suspensión de las células para el recuento celular, la determinación de la positividad CD34, la prueba de viabilidad mediante exclusión del azul tripán y para el estudio microbiológico. El recuento celular se hizo inicialmente en un contador automático de células sanguíneas (SEAC, Genius, Italia), y después en un contador SINNOWA HB 7021 de la República Popular China. El análisis de las células CD34+ se llevó a cabo por un procedimiento inmunocitoquímico previamente descrito,12 utilizando un anticuerpo CD34 de la Firma Serotec, Ltd, Reino Unido; o bien mediante citometría de flujo en un FaC Scan (Becton-Dickinson, EE.UU.). El recuento diferencial se comprobó mediante microscopia óptica en extensiones del concentrado celular teñidas con May-Grünwald Giemsa. Se consideraron CMN: los linfocitos, los monocitos, las células linfocitoides, monocitoides, mieloides inmaduras, los proeritroblastos y los eritroblastos.
Pacientes
En el estudio se incluyeron 563 pacientes (560 adultos y 3 niños) con diferentes afecciones: 460 (81,7 %) con enfermedades vasculares periféricas; 55 (9,9 %) con alteraciones óseas; 17 (3 %) con cardiopatías; 7 (1,2 %) con trastornos neurológicos; 7 (1,2 %) con periodontitis; y 17 (3 %) con otras enfermedades. La distribución de pacientes por provincias fue la siguiente: Ciudad de La Habana 256; Pinar del Río 208; Villa Clara 44; Cienfuegos 30; Holguín 20; y Matanzas 5.
Administración de las CMN
- Los 30 pacientes con isquemia crítica atendidos en el IHI-Hospital General Docente "Enrique Cabrera" (HGDEC) se dividieron en 2 grupos: uno que recibió células CMN-MO y otro CMN-SP. En el resto de los casos, las células se procesaron por el método estandarizado en el IHI para obtención de las células de la sangre periférica.
- En la mayoría de los casos de isquemia de miembros inferiores, la aplicación se realizó mediante implantación intramuscular en los músculos gemelos, de acuerdo con el método previamente establecido.12 En un grupo de pacientes con claudicación intermitente, la administración celular se hizo por vía intraarterial mediante punción de la arteria femoral.
- En los casos con linfedema, la inyección se practicó mediante punciones múltiples en el miembro inferior más comprometido. Las inyecciones se realizaron a una distancia de 3 cm entre ellas y con un volumen de 0,5-1 mL por punción, variando el volumen total de acuerdo con la intensidad y la extensión del linfedema.
- Los pacientes diabéticos con lesiones en miembros inferiores atendidos en el HGDEC se dividieron en 2 grupos de forma aleatoria: en uno se realizó implante de CMN-MO (grupo I) y en el otro, de CMN-SP sin movilización previa (grupo II). La inyección se hizo intralesionalmente y en dosis única.
- En los síndromes posflebíticos, la administración celular se realizó localmente en la pierna afectada y en la región ulcerada.
- En los enfermos con infarto agudo se colocó un stent liberador de droga en la lesión culpable y se estimuló la médula ósea con factor estimulante de colonias de granulocitos, y se implantaron por vía intracoronaria las células mononucleares obtenidas mediante aféresis realizadas con el separador automático de células. En los enfermos con infarto del miocardio previo e insuficiencia cardiaca, las células aspiradas de la médula ósea y separadas por gradiente de densidad con Ficoll, se inyectaron directamente en la pared miocárdica durante el acto quirúrgico realizado para una derivación vascular, o a través de un catéter balón colocado en la arteria relacionada con el infarto durante una angioplastia coronaria.
- En los pacientes con necrosis de la cabeza femoral, el concentrado celular se aplicó por vía percutánea en el sitio de la necrosis, después de la descompresión de la cabeza femoral mediante perforaciones realizadas en el hueso con un pequeño trócar. En todos los pacientes con drepanocitosis, las células mononucleares autólogas fueron obtenidas de la médula ósea y separadas mediante el método de gradiente con Ficoll. En el resto de los casos, las células se procesaron a partir de la sangre periférica mediante el método manual estandarizado en el IHI.13
- En los enfermos con trastornos neurológicos crónicos por lesiones vasculoencefálicas, las células se implantaron estereotácticamente en los sitios diana, determinados mediante combinaciones de imágenes. El proceder se hizo con una cánula específica para la implantación celular en las regiones anatómicas seleccionadas. Las células se implantaron en distintos puntos a lo largo del trayecto de la cánula en la región perilesional.14 En todos estos casos, las células mononucleares fueron obtenidas de la médula ósea y separadas mediante el método de gradiente con Ficoll.
- En los pacientes con periodontitis se realizó la infusión celular en los defectos óseos provocados por la enfermedad; y en los casos con psoriasis, la terapia celular se hizo inyectando directamente las lesiones. En estos pacientes, las células se obtuvieron de la sangre periférica de acuerdo con el método estandarizado en el IHI.13
Exámenes complementarios
Los pacientes con isquemia crítica de miembros inferiores se monitorearon con el índice de presiones tobillo-brazo (ITB) en reposo, la distancia de marcha sin claudicación (DSC) y la evaluación de la escala del dolor de reposo, por métodos previamente descritos.12 En general, los pacientes claudicantes se evaluaron de igual forma y los estudios evolutivos se compararon con los resultados obtenidos antes del implante celular. En los primeros 30 casos, el estudio angiográfico se hizo mediante una arteriografía convencional y en los otros pacientes, por
angiotomografía computadorizada.12 Una gran parte de los enfermos no aceptaron el estudio angiográfico evolutivo. En los enfermos con claudicación intermitente también se practicó una gammagrafía con hematíes marcados in vivo con tecnecio-99m, para evaluar el estado de la perfusión sanguínea de los miembros inferiores antes y después del implante celular.
En los diabéticos con lesiones tróficas de los miembros inferiores, los criterios de respuesta estuvieron en función de la formación de tejido de granulación y epitelización. Se efectuaron mediciones semanales, fotos y biopsias de las lesiones, preimplante y después, a la segunda y sexta semanas.
En los casos con síndrome posflebítico, se hicieron medidas evolutivas de la circunferencia del miembro afectado y del área de la lesión. En los pacientes con linfedema también se midieron evolutivamente las circunferencias de los miembros inferiores.
Los enfermos con infarto agudo se evaluaron previamente al proceder y a los 6 meses, por la clínica y mediante electrocardiograma, ecocardiograma, ergometría y coronariografía. En los que tenían infarto previo e insuficiencia cardíaca, se hizo evaluación clínica y de laboratorio, ventriculografía radioisotópica y gammagrafía SPECT de perfusión miocárdica con tecnecio-99m metoxi-isobutil-isonitrilo (protocolo dipiridamol reposo), previamente, a los 3 meses y 4 años después del proceder.15
A los pacientes con periodontitis se les realizaron estudios radiográficos de las regiones óseas afectadas, pre y postrasplante; mientras que en los enfermos con necrosis aséptica de la cabeza del fémur, además de la radiografía ósea, se les indicó tomografía axial computadorizada o resonancia magnético nuclear de los sitios dañados, así como densitometría ósea, que se indicaron pre-trasplante y a los 6, 12 y 24 meses postratamiento.
En los enfermos con trastornos neurológicos crónicos secundarios a accidentes vasculares encefálicos se empleó una combinación de diferentes pruebas y determinaciones funcionales que se aplicaron pre y postratamiento, que incluyeron evaluaciones neurológicas, neuropsicológicas y neurofisiológicas.14
En los casos con psoriasis se determinaron, pre y posimplantación celular, el tamaño e intensidad de las lesiones y las regiones afectadas.
Aspectos éticos
El estudio se hizo de acuerdo con los principios establecidos en la Declaración de Helsinki y fue aprobado por los comités científicos y de ética de las instituciones participantes. Todos los pacientes suministraron por escrito su consentimiento para la participación en el ensayo clínico.
Análisis estadístico
En los grupos en que el procesamiento de las CMN-MO se hizo por un método automatizado o por uno manual, la comparación de los valores absolutos de CMN y de CD34+ se hizo mediante la t de Student.
Los resultados de las variables cuantitativas se analizaron mediante la t de Student para muestras independientes y los estudios evolutivos para muestras pareadas se compararon mediante la prueba t para muestras pareadas. En los casos en que utilizó la mediana para la comparación de los resultados evolutivos en los mismos pacientes, se usó la prueba de Wilcoxon Signed Rank. Se consideró estadísticamente significativa una p <0,05.
RESULTADOS
Métodos empleados
En los pacientes en que las CMN-MO se procesaron por el método automatizado o el manual, no se encontraron diferencias estadísticamente significativas entre los promedios de los conteos absolutos de CMN y de células CD34+. Tomando en cuenta estos resultados, ambos grupos se unificaron en uno solo, representativo de los casos en que se administraron CMN-MO.
En el grupo en que se usaron CMN-MO, el volumen final de la suspensión de células concentradas varió de 31 128 mL (mediana 90 mL). En ese volumen, la mediana del conteo absoluto de CMN fue 1,8 x 109 y la mediana del conteo absoluto de células madre CD 34+ fue 7,7 x 107 en el concentrado final de CMN-MO y 11,5 x 107 en el de CMN-SP.
La evaluación del método estandarizado en el IHI para la concentración de CMN-SP mostró que el volumen promedio de los concentrados de CMN obtenidos fue de 106 mL, con un contenido medio de leucocitos de 20,3 x 109; el porcentaje de CMN fue del 29 % con un número absoluto promedio de CMN del concentrado de 5,35 x 109. El porcentaje promedio de células CD34+ fue 2,4 % con un número absoluto promedio de 12,1 x 107. Estos datos reflejan la efectividad del FEC-G de producción nacional para la movilización celular.
En general, el conteo de leucocitos de los pacientes después de la movilización con FEC-G fue superior a 20 x 109 /L, que era la cifra mínima posmovilización fijada para proceder a la autodonación sanguínea. La viabilidad celular en los concentrados obtenidos por los diferentes métodos empleados se mantuvo en un rango entre el 95 y el 99 %. En todos los casos, los cultivos microbiológicos y la tinción de Gram fueron negativos.
Evolución de los pacientes
Del total de pacientes tratados, se habían evaluado evolutivamente en el momento de redactar este informe: 406 (72 %), todos adultos con un rango de edad de 22 a 88 años. De ellos, 165 con isquemia arterial crítica, 138 con claudicación intermitente invalidante, 20 diabéticos con lesiones tróficas en miembros inferiores, 10 con síndrome posflebítico, 16 con linfedema crónico de miembros inferiores, 16 con cardiopatía isquémica, 14 con lesiones óseas, 7 con periodontitis, 5 con lesiones cerebrales crónicas, y 15 con psoriasis.
A continuación se resumen los resultados obtenidos, que han sido previamente publicados o fueron expuestos en el II Simposio Internacional de Medicina Regenerativa efectuado durante el Hematología 2009, celebrado en el Palacio de las Convenciones.
Arteriosclerosis obliterante
Isquemia crítica (estadios III IV de la clasificación de Fontaine).
En estos criterios se incluyen los casos en estadio III, solo con dolor de reposo; o en estadio IV cuando presentan lesiones tróficas (úlcera, gangrena o ambas lesiones).
En el estudio inicial realizado en el IHI HGDEC, se incluyeron 30 pacientes con isquemia crítica de un miembro inferior que habían sido tratados previamente sin éxito con los métodos habituales y no existía ninguna posibilidad de revascularización por angioplastia o procederes quirúrgicos. En 13 pacientes, el trasplante celular autólogo se hizo con CMN-MO y en 17, con CMN-SP.
Veintiún pacientes (70 %) tenían indicación de una amputación supracondilea del miembro afectado. La mayoría de ellos tenía el miembro afectado en un estado sumamente crítico, principalmente los enfermos incluidos en el grupo en que se implantaron CMN-SP. En 14 (67 %) de los 21 casos que tenían indicación de amputación mayor, se logró evitar esta intervención quirúrgica. La amputación se evitó en 5 (83 %) de los 6 casos con esta indicación en el grupo en que se implantaron CMN-MO; y en 9 (60 %) de los 15 con criterio de amputación supracondílea que recibieron CMN-SP. En la mayor parte de los que salvaron la pierna, solo se hizo la amputación de los dedos con gangrena y en unos pocos pacientes con notables alteraciones tróficas y riesgo de extensión de las lesiones, se practicó una amputación transmetatarsiana.
De los 7 (33 %) pacientes restantes con indicación de amputación supracondilea, la amputación se practicó en 6, entre los que se incluyeron 2 de los enfermos que presentaban asociación de gangrena de los dedos con úlcera isquémica. En el paciente restante se hizo una amputación infracondílea.
En estos pacientes, tanto en los que se emplearon CMN-MO como en los que recibieron CMN-SP, el dolor de reposo había mejorado significativamente a las 4 semanas. A las 24 semanas había desaparecido en ambos grupos. La distancia de marcha sin claudicación también mejoró progresivamente en los 2 grupos de pacientes. En ambos grupos hubo mejoría significativa del ITB en el miembro en que se hizo la implantación celular, sin que se apreciaran cambios importantes de este índice en la extremidad no tratada, comparados con los valores que existían en condiciones basales.
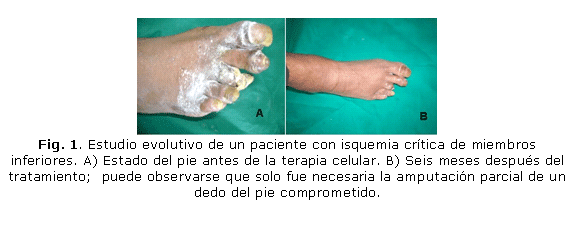
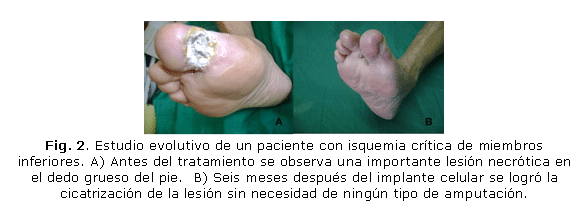
En el Hospital Docente Provincial "Abel Santamaría Cuadrado" de Pinar del Río (HDPASC), se trataron 70 pacientes con este grado de compromiso circulatorio, en los que solamente fue necesario realizar la amputación mayor en 23 casos (32,9 %). En los 47 (67,1 %) pacientes restantes, también en estado sumamente crítico, no fue necesaria la amputación mayor de la extremidad comprometida (figs. 1 y 2).
Por otra parte, en el Hospital Docente Provincial "Gustavo Aldereguía Lima", de Cienfuegos (HDPGAL), se trataron 24 enfermos en estos estadios y sin posibilidades de revascularización. La amputación mayor se pudo evitar en 14 (73,68 %) de los 19 casos con criterio para este proceder quirúrgico. Hubo mejoría del dolor de reposo, del índice ITB y de la DSC en todos los enfermos con respuesta favorable (79 %). Un comportamiento similar se observó en el Hospital Docente Provincial "Arnaldo Milián Castro", de Villa Clara, donde se atendieron 41 pacientes y solo se realizaron 6 (15 %) amputaciones mayores, con respuesta favorable en el resto de los casos (85 %).
Los pacientes atendidos en el Hospital Docente Provincial "Lucía Íñiguez", de Holguín, aún no tienen un tiempo de evolución suficiente para su evaluación.
Claudicación intermitente invalidante (Estadio II-B de la clasificación de Fontaine).
Se incluyen en este criterio los pacientes en que el dolor por isquemia aparece al caminar < 150 m en terreno llano.
En el HGDEC se trataron 18 enfermos. En todos las CMN se implantaron intramuscularmente en el miembro más afectado.
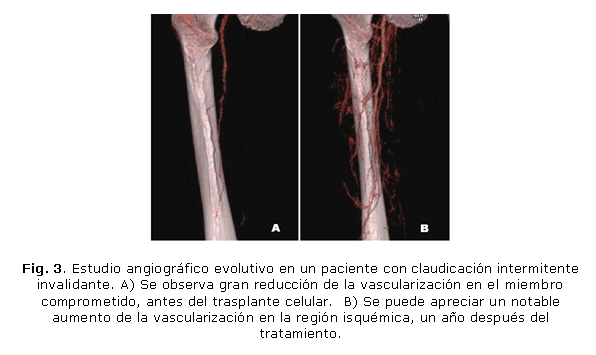
La evaluación integral de los pacientes mostró mejoría de la DSC y del índice de presiones tobillo-brazo (ITB). La mediana de la DSC basal fue de 60 m, mientras que a los 6 meses alcanzó 1 000 m, analizado el total de los enfermos (p=0,000), lo que representó el 100 % de efectividad. La mejoría obtenida se mantuvo a los 2 años en 10 pacientes evaluados en este tiempo (fig. 3). El ITB basal que era 0,27 en el miembro inyectado, a los 6 meses aumentó a 0,51 (p=0,001) en el análisis del total de los enfermos; y alcanzó 0,55 en los 10 enfermos evaluados a los 2 años (p=0,013). No se observaron efectos adversos secundarios a la implantación celular.
Por otra parte, en este mismo hospital, se atendieron 40 pacientes claudicantes comprendidos en esta categoría, en que la administración de las células se realizó por vía intraarterial a través de la arteria femoral. En 30 de estos enfermos el estudio evolutivo a los 6 meses mostró una mejoría en 29 (96,7 %), traducida por el incremento en la DSC y del ITB. Se demostró un aumento de la angiogénesis a través de la circulación colateral, que fue evidente en las angiografías; y de la circulación sanguínea en el miembro tratado, mediante su evaluación por gammagrafía radioisotópica (fig. 4).
Ochenta pacientes con arteriosclerosis obliterante de miembros inferiores incluidos en ese mismo estadio y tratados en el HDPASC, mostraron una mejoría en el 87,4 % de los casos, con un aumento significativo de los ITB y en la DSC, que era <de 150 m preimplante celular y como promedio, sobrepasó 1 km postratamiento.
Lesiones tróficas en diabéticos
En el HGDEC se incluyeron en el estudio 20 pacientes diabéticos con lesiones en miembros inferiores, que se distribuyeron en 2 grupos. En ambos grupos se apreció mejoría aunque esta fue más notable en el que recibió CMN-MO (fig. 5). En estos casos hubo como promedio 5 cm2 de reducción de las lesiones en la semana 2 y de 23 cm2 en la sexta, con respecto al área preimplante, con diferencias estadísticamente significativas. En el segundo grupo en que se inyectaron CMN-SP sin estimulación previa, se apreció una reducción de 9 cm2 en la semana 2 y 20 cm2 en la sexta, pero sin diferencias significativas entre estos resultados.
Histológicamente se observó tejido de granulación activo, abundantes vasos de neoformación, fibroblastos, zonas de fibrosis y cicatrización en el grupo I; mientras que en el grupo II hubo tejido de granulación poco activo, con fibrosis escasa a la segunda semana.
Síndrome posflebítico
En 10 pacientes con este síndrome tratados en el HPASC se comprobó respuesta clínica favorable posimplantación celular.
Linfedema
En el HGDEC en colaboración con el IHI, se trataron 6 pacientes con linfedema en ambos miembros inferiores, por linfangitis a repetición. En todos los casos se ha logrado una disminución progresiva del diámetro de la extremidad inyectada. Entre estos se destaca el primero en que se utilizó la terapia celular regenerativa. Este era un paciente con evolución prolongada que no había respondido a ningún tipo de tratamiento. Evolutivamente se apreció que después de la inyección celular se produjo una disminución progresiva del linfedema que se hizo evidente ya al primer mes y que continuó mejorando hasta su desaparición. Llamó la atención que esta mejoría se manifestó también en el miembro inferior en que no se había realizado implante celular.
Por otra parte, en el HDPASC se trataron 10 casos con linfedema en miembros inferiores y linfangitis a repetición. A los 3 meses, el 50 % de ellos había mejorado considerablemente y a los 6 meses todos habían mejorado, con disminución del fibroedema de la pierna inyectada, mejoría de los cambios tróficos, disminución de la frecuencia de las linfangitis, y desaparición del dolor en aquellos que lo presentaban.
Cardiopatías isquémicas
En el Centro de Investigaciones Médicoquirúrgicas (CIMEQ) se trataron 7 pacientes con un primer infarto Q de 1 a 7 días de evolución. Cinco enfermos rebasaban el año de seguimiento. La lesión culpable se localizó en la arteria descendente anterior en 4 pacientes, en la coronaria derecha en 2, y en la circunfleja en 1. Al ingreso, la mayoría estaba en un grado ≥ II según Killip-Kimbal. Se obtuvo una mejoría de la función ventricular demostrada por los métodos evaluados, sin eventos cardiovasculares mayores.
En el Instituto de Cardiología y Cirugía Cardiovascular (ICCCV) se estudiaron 9 pacientes con infarto del miocardio previo e insuficiencia cardíaca. En el 66 % de los casos, las células se implantaron en la pared posteroinferior. A los 3 meses se observó una mejoría clínica significativa en el 93 % de los casos. La fracción de eyección de ventrículo izquierdo basal fue del 32 ± 9%, la que aumentó a 44 ± 13 % a los 3 meses (p=0,03). A los 4 años fue del 39±12% (diferencia no significativa comparada con la hallada a los 3 meses). La velocidad máxima de llenado aumentó de 1,20 ± 11, a 1,96 ± 45 VTD/seg a los 3 meses (p=0,03). A los 4 años fue de 1,57±51 VTD/seg. En cuanto a la perfusión, el score sumado de dipiridamol disminuyó significativamente de 36 ± 4 a 16±2 (p=0,0003); el score sumado de la diferencia también se redujo de 14 ± 7 a 3 ± 5 (p=0,04). Esta mejoría se mantuvo a los 4 años y estuvo relacionada con el sitio del implante celular (territorio del infarto) en el 66 % de los casos.
Necrosis aséptica de la cabeza del fémur
Se trataron 14 pacientes con este tipo de lesión, atendidos en el IHI y el HGDEC. Los resultados preliminares han mostrado en todos los pacientes una rápida desaparición de las manifestaciones clínicas antes de los 3 meses después de la implantación celular. En la mayoría de los pacientes ocurrió en las primeras 4 semanas. Después de 4 meses de evolución, todos los casos podían caminar sin apoyo, excepto un enfermo que aún requería el uso de muletas para su deambulación. En 3 casos con una evolución de 18 meses, la densitometría ósea mostró un aumento de la masa ósea en las zonas implantadas.
Periodontitis
Se trataron 7 pacientes mediante una colaboración establecida entre el servicio de cirugía maxilofacial del Hospital Pediátrico Docente "William Soler"(HPDWS) y el IHI. La evolución posimplantación celular de estos casos, variaba entre 6 meses y un año. En todos, las encías presentaban una coloración normal a los 7 días después de la infusión celular. Además, a los 3 meses se observó radiográficamente neoformación ósea y a los 6 meses, la encía se mantenía sana. Se apreció una disminución de la movilidad dentaria en los sectores tratados y en las radiografías evolutivas se evidenció formación y aumento de la densidad ósea en todos los casos (fig. 6). No se presentaron efectos adversos posoperatorios.
Trastornos neurológicos crónicos como secuelas de infarto o hematoma cerebral
En 5 pacientes con secuelas de infarto o hematoma cerebral, tratados en el Centro Internacional de Restauración Neurológica (CIREN), mediante cirugía estereotáctica, se trasplantaron en el área perilesional, células madre autólogas derivadas de la médula ósea, para evaluar la seguridad del procedimiento y la tolerancia a las células transplantadas. No se observaron eventos adversos importantes derivados de la cirugía o trasplante durante el período de seguimiento por un año. Se produjeron algunas mejorías en relación con las condiciones clínicas que manifestaban los enfermos. Estos resultados demostraron que este tipo de terapia celular regenerativa puede hacerse intracerebral, con excelente tolerancia y sin complicaciones, mediante el uso de los procederes empleados.
Psoriasis
En 15 pacientes con esta enfermedad atendidos en el HDPASC, el 87 % mostró una respuesta favorable con atenuación o desaparición de las lesiones cutáneas (fig. 7). Sin embargo, parte de ellos tuvieron una recaída de la enfermedad antes del año posimplante celular, lo que generalmente se atribuyó a situaciones de estrés enfrentadas por los pacientes. Debe destacarse el primer caso con esta enfermedad que mostró respuesta favorable. Se trataba de un enfermo con isquemia crónica de miembros inferiores y que además tenía placas de psoriasis en estas extremidades. En uno de los miembros isquémicos el enfermo recibió terapia celular regenerativa indicada para la insuficiencia arterial y sorpresivamente se observó desaparición de las lesiones de psoriasis, que después de un año no habían reaparecido.
DISCUSIÓN
En nuestro estudio inicial se utilizaron 3 métodos para la separación de las CMN: 1 automatizado y 2 manuales; la separación celular mediante un gradiente de densidad con Ficoll y la separación por sedimentación mediante el empleo de hidroxietilalmidón al 6 %. Con estos métodos se obtuvo un número adecuado de células mononucleares comparable a los valores reportados por otros autores, muchos de ellos usando un proceder automatizado con alguno de los equipos de aféresis actualmente disponibles.16-18 En cuanto al número de células CD34+, el número absoluto obtenido también resultó adecuado y fue superior en las células provenientes de la sangre periférica movilizada. El método de sedimentación con HES al 6 % es muy práctico dada su mayor facilidad de ejecución y ha sido el utilizado últimamente en nuestra institución y en los hospitales de las otras provincias a las que se ha extendido el empleo de la terapia celular regenerativa. De acuerdo con la experiencia obtenida en el IHI, se pudo precisar que la cifra mínima de CMN de 1 x 109 en los concentrados celulares, resultaba efectiva para la aplicación clínica, y que ella se asociaba con un número apropiado de células CD34+. Este dato facilitó la transferencia tecnológica a otros hospitales del país en los que para la terapia celular regenerativa solo se tomó en cuenta el número absoluto de CMN, pues al no contar con equipamiento y técnicas complejas, no era posible determinar el número de células CD34+.
Con esta conducta, en esos hospitales se han obtenido resultados clínicos similares a los logrados en el IHI, donde sí se realiza la cuantificación de células CD34+. Esto evidenció que en el orden práctico la conducta terapéutica basada únicamente en el conteo de las CMN resulta efectiva, lo que indudablemente ha permitido beneficiarse a un número de pacientes que, de otra manera, no hubiesen tenido acceso a esta nueva terapéutica. Además, la aplicación del trasplante de CMN-SP ofrece una serie de ventajas sobre el de CMN-MO, como son: la frecuencia menor de efectos adversos, la no necesidad de salón de operaciones ni de anestesia, y una mayor comodidad para el donante que es el propio paciente.
En la actualidad, el método simplificado en el IHI se está utilizando ya en 6 de las 14 provincias de Cuba, y hasta el mes de abril del 2009 se habían tratado 563 casos con trasplante de células madre hematopoyéticas adultas antólogas, de los cuales el 81,7 % corresponde a pacientes con enfermedades vasculares periféricas, en las que se ha podido comprobar la efectividad y la seguridad de este proceder.
Por otra parte, los buenos resultados aportados por la implantación de CMN-SP movilizadas con el FEC-G coinciden, con lo informado por otros autores.18-21
Recientemente, se ha propuesto el empleo de la terapia celular regenerativa para la inducción de angiogénesis,22,23 y se ha podido apreciar el potencial terapéutico de las células madre adultas en el tratamiento no solo de las afecciones de las arterias periféricas, sino también de enfermedades de las coronarias.24,25
Una investigación reciente en que se comparó la aplicación de células madre de la médula ósea con la de células madre procedentes de la sangre periférica movilizada, comprobó la efectividad de ambas conductas en el tratamiento de la isquemia de miembros inferiores, y no se evidenciaron diferencias significativas entre los resultados de estos métodos.17,18
Se ha planteado que el objetivo terapéutico en la isquemia crónica de los miembros inferiores consiste en aliviar la sintomatología, particularmente el dolor, evitar la progresión de la enfermedad y disminuir el índice de amputaciones. Se ha señalado que la meta principal en la mayor parte de los pacientes con isquemia crítica, es la preservación de la extremidad afectada,12 aspectos estos que se lograron en nuestros pacientes,12,26-28 pues en ellos se evitó una amputación mayor, como promedio, en el 73 % de los individuos que tenían esta indicación.
Los resultados obtenidos nos permiten señalar que en los casos con isquemia crónica de miembros inferiores, la aplicación de la terapia celular regenerativa resulta más efectiva cuando los pacientes están en estadios menos avanzados de la enfermedad, así como en los estadios críticos cuando solo existe dolor de reposo, la desaparición del dolor es relativamente rápida y la mejoría del estado clínico y la calidad de vida del enfermo se hace manifiesta.12 Por otra parte, en los casos con claudicación intermitente invalidante, en que los tratamientos habituales o convencionales no detienen la progresión a etapas más avanzadas con alto riesgo de amputación, los resultados positivos que hemos obtenido en más del 85 % de los casos ejemplifican los beneficios de la aplicación precoz de la terapia celular regenerativa y de la efectividad del empleo de células madre hematopoyéticas adultas. Además, se observó que, tanto la administración intramuscular de las células como su inyección por vía intraarterial, fueron muy efectivas.26,29,30 Estos resultados coinciden con otros trabajos publicados en la literatura.19,20,31-33
La terapia celular angiogénica se ha considerado un método integral para enfrentar el estado isquémico, pues el suministro de células madre puede influir en la liberación de varios factores angiogénicos y citocinas, o bien aportar progenitores de células endoteliales capaces de actuar directamente en el mecanismo angiogénico,12
Los resultados positivos obtenidos en el tratamiento de las lesiones tróficas en diabéticos son notables.34,35 En los pacientes diabéticos en que se aplicaron CMN-MO, la respuesta terapéutica fue más efectiva en lograr tejido de granulación y epitelización útil para cicatrización por segunda intención; y las células promovieron más rápidamente la fibrosis y la cicatrización que en el grupo en que se usaron CMN-SP. En este último grupo, la respuesta observada puede estar en relación con la liberación por las células aplicadas de algunas sustancias solubles, pero en una cantidad menor a la que pudo ser aportada por las CMN-MO. Esta mayor efectividad de las CMN-MO en comparación con las de sangre periférica, sin movilización celular previa, ya había sido señalada en pacientes con isquemia de los miembros inferiores.16 En relación con el síndrome posflebítico, es necesario incrementar el número de pacientes y evaluar su evolución por tiempo más prolongado para poder llegar a conclusiones.
Los resultados favorables en los enfermos con linfedema crónico de miembros inferiores resultan muy alentadores, pues el tratamiento convencional de esta enfermedad no proporciona respuestas clínicas importantes en la mayoría de los pacientes, a pesar de los nuevos procederes terapéuticos introducidos. Hasta donde conocemos, nuestros casos son los primeros con linfedema crónico de los miembros inferiores tratados con terapia celular comunicados en la literatura. La respuesta terapéutica coincide con la señalada en una publicación reciente sobre los primeros casos de pacientes con linfedema crónico de miembros superiores tratados también con terapia celular regenerativa y por otra parte, apoyan el criterio de que algunas de las células derivadas de la médula ósea pueden intervenir en la linfangiogénesis.36,37
En las cardiopatías isquémicas, aunque los casos son pocos, se pudo observar una mejoría de la función ventricular de los enfermos tratados, demostrada por los métodos de estudio aplicados.38 En los pacientes con infarto del miocardio previo e insuficiencia cardíaca, la mejoría obtenida se mantenía a los 4 años después del implante celular, lo que evidenció la persistencia del resultados favorables a largo plazo.39 Estos datos concuerdan con algunos trabajos publicados que apoyan el uso de células madre hematopoyéticas para la regeneración cardíaca.40,41
La terapia celular regenerativa en cardiología es un tema muy discutido y que requiere para su definición, estudios aleatorizados y controlados con un número suficiente de pacientes con potencia estadística para poder darle valor significativo a los resultados. En nuestros casos se pudo comprobar que los procederes empleados fueron seguros y abren posibilidades para su aplicación en un mayor número de enfermos.
En los pacientes con necrosis aséptica de la cabeza del fémur, la terapia celular regenerativa también resultó segura con el proceder aplicado y muy prometedora, pues hubo una notable recuperación clínica en los pacientes tratados.42 Estudios recientes realizados en animales han comprobado que la descompresión de la zona necrótica más implantación de células mesenquimales produce mejores resultados que la simple descompresión.43 Por otra parte, un estudio reciente realizado en 342 pacientes (534 caderas tratadas) con osteonecrosis isquémica de la cadera, evidenció la efectividad de la terapia celular en el tratamiento de estos casos, principalmente en su etapa poco avanzada.44 Este nuevo conocimiento apoya la conducta seguida en nuestros enfermos. Este es un tópico de gran interés en la actualidad, en el que están trabajando distintas instituciones a nivel internacional, por las perspectivas que ofrece, no solo para el tipo de entidad que hemos analizado, sino también para otras lesiones óseas fundamentalmente las fracturas múltiples y las pseudoartrosis.5
Por otro lado, también resultan muy alentadores los resultados en los pacientes con periodontitis, en los que no solo se evidenció notable mejoría del estado de la encía, sino también disminuyó la movilidad dentaria y se incrementó la densidad ósea.45 Esta investigación se encuentra entre las primeras a nivel internacional en abordar esta importante cuestión, tanto por su repercusión sobre la salud bucal de los pacientes, como por la mejoría de la calidad de vida que aporta.
Recientemente se ha planteado la utilidad del trasplante de células madre hematopoyéticas en pacientes con accidentes cerebrovasculares agudos, y existen algunas comunicaciones en la literatura de su uso en enfermos con trastornos neurológicos crónicos. En experiencias previas en pacientes con infarto de ganglios basales, se implantaron en el cerebro, mediante cirugía estereotáctica, neuronas cultivadas, con lo que se produjo mejoría de los enfermo.46 Hasta donde tenemos conocimiento, los casos evaluados en Cuba están entre los primeros en que se han implantado satisfactoriamente en el cerebro células madre adultas autólogas provenientes de la médula ósea.14 Las mejorías apreciadas después de un año de evolución en relación con las condiciones clínicas y la ausencia de efectos adversos importantes, relacionados con la cirugía o el trasplante celular, abren nuevas perspectivas para el tratamiento de pacientes con este tipo de afección neurológica crónica.
La psoriasis es una enfermedad crónica compleja que se caracteriza por una dermatosis inflamatoria, habitualmente de evolución crónica, que ha sido vinculada con la liberación de citocinas pro-inflamatorias ocasionada por diferentes factores desencadenantes, entre ellos: inmunológicos, mecánicos, metabólicos, por fármacos o psicogénicos. Esta dolencia muestra una gran variabilidad clínica y evolutiva. En esta enfermedad, en ocasiones se han observado respuestas favorables transitorias con algunos tratamientos y que se han considerado producidas por un efecto placebo o psicológico.
En relación con los pacientes con psoriasis incluidos en nuestros estudios, se puede señalar que hasta donde conocemos, estos son los primeros casos reportados en que se ha aplicado la terapia celular regenerativa,35 aunque para explicar los efectos beneficiosos observados, se pudiera plantear la posible acción antiinflamatoria de varios de los factores que pueden liberar las CMN y quizás un posible efecto inmunomodulador de alguna de estas células. Estos resultados deben interpretarse con suma cautela teniendo en cuenta el componente psicológico atribuido a la enfermedad. No obstante, consideramos que las respuestas obtenidas, justifican ampliar la investigación a un mayor número de enfermos con un estudio aleatorizado y controlado.
Un dato general que podemos aportar es que en las diferentes enfermedades en que se ha aplicado la terapia celular regenerativa en Cuba y que se han seguido evolutivamente, al menos durante 2 años, no se han producido neoplasias que se puedan atribuir al tratamiento empleado. Esta observación coincide con otros trabajos en los que tampoco se ha comunicado actividad oncogénica relacionada con las células madre adultas, lo que hasta donde conocemos no se ha comprobado en ninguno de los ensayos clínicos comunicados en la literatura.
A pesar de los avances obtenidos, aún existen algunas interrogantes sobre las potencialidades de las células madre adultas y sus mecanismos de acción, aunque se ha ido extendiendo el criterio de que ellas pueden actuar mediante transdiferenciación y fusión celular y también a través de las secreción de diferentes factores solubles capaces de actuar sobre las células del tejido en que se implanten.7 Tampoco se conoce con precisión cuál es la mejor vía para su administración, aunque esta puede variar según el tipo de enfermedad. También existen interrogantes sobre cuál es el número óptimo de células para obtener la respuesta deseada y si la administración de un conjunto celular, como sucede con las células derivadas de la médula ósea, es mejor que la aplicación de subpoblaciones específicas. Igualmente se ha señalado la necesidad de continuar los estudios básicos y preclínicos que avalen la introducción de la terapia celular regenerativa en la práctica clínica. Además, se ha hecho énfasis en las mayores posibilidades terapéuticas que podrían ofrecer las células madre embrionarias y en particular las células madre embrionarias inducidas.
Sin desconocer la importancia de las investigaciones básicas, de los ensayos preclínicos, de las posibilidades futuras con las células madre embrionarias, y sin renunciar a la ética de la investigación, consideramos que mientras se definen todos los aspectos científicos en discusión y se comprueba la utilidad terapéutica sin riesgos, de las células madre embrionarias o de sus similares, lo que se piensa debe tomar aún varios años, existen suficientes evidencias para mantener la aplicación terapéutica de las células madre adultas derivadas de la médula ósea para el tratamiento de algunas enfermedades sin respuesta o muy poca respuesta a los tratamientos convencionales, que hasta el momento han resultado útiles y sin efectos adversos importantes,
Mediante una evaluación integral de todos los datos antes expuestos, podemos concluir que el uso de las células CMN-MO y de las CMN-SP movilizadas mediante el FEC-G, ha sido efectivo en las entidades en que las hemos utilizado. Un trabajo reciente en un pequeño número de casos con insuficiencia arterial crónica de los miembros inferiores, coincide con publicaciones previas y apoya nuestros criterios. Además, el método de obtención y separación de células mononucleares que hemos aplicado es relativamente simple, poco costoso y por lo tanto, más accesible a los centros con pocos recursos. Sobre la base de los resultados obtenidos hasta el momento, consideramos que estos procederes son una buena alternativa, con la que se podría beneficiar un buen número de enfermos que de otra forma no tendrían acceso a esta novedosa terapéutica.
Reconocimiento
Los autores deseamos expresar nuestro reconocimiento a todos los colaboradores que han participado en los trabajos resumidos en este artículo:
- Procedentes de instituciones radicadas en Ciudad de La Habana:
Ballester JM, Marsán V, Sánchez M, González D, Atencio E, García S, Vargas E, Sainz J, Pintado A, Peña Y, Aroche R, Figueredo Y, Luna C, Herrera AM, Vila E, Hidalgo J, Llerena L, Cabrera LO, Castillo A, Álvarez L, García I, de la Cuétara K, Castillo L, Bringas ML, Martínez G, Morales LM, Báez MM, Sánchez C, Rodríguez R, Carballo M, Gómez L, Alberti E, Bergado JA, Pérez E, Luaces L, Pérez E, García R, Domínguez L, Ilisástigui ZT.
-De la provincia de Pinar del Río:
Hernández NM, Meliáns S.
- De la provincia de Villa Clara:
Llópiz L, Fernández M, Silverio E, Ríos O, Feito T.
- De la provincia de Cienfuegos:
Marrero I, Ramírez N, Álvarez K, Guerra T, Boucunani D, Vera A, Villafuerte D, Medianeja O, Mustelier M, Pérez F.
- De la provincia de Holguín:
Ortiz E, Laguna L, Bosch LM.
REFERENCIAS BIBLIOGRÁFICAS
1. Mimeault M, Hauke R, Batra SK. Stem cells: A revolution in therapeutics-recent advances in stem cell biology and their therapeutic applications in regenerative medicine and cancer therapies. Clin Pharmacol Ther. 2007;82:252-64.
2. Hernández P, Dorticós E. Medicina regenerativa. Células madre embrionarias y adultas. Rev Cubana Hematol Inmunol Hemoter [serie en internet]. Disponible en: 2009;25(1): http://bvs.sld.cu/revistas/hih/vol25_1_09/hih02109.htm
3. Park IH, Zhao R, West JA, Yabuuchi A, Huo, H, Ince TA, et al. Reprogramming of human somatic cells to pluripotency with defined factors. Nature. 2008;451:141-6.
4. Lowry WE, Richter L, Yachechko R, Pyle AD, Tchieu J, Sridharan R, et al. Generation of human induced pluripotent stem cells from dermal fibroblast. Proc Natl Acad Sci USA. 2008;105:2883-8.
5. Hernández P. Medicina regenerativa II. Aplicaciones, realidad y perspectivas de la terapia celular. Rev Cubana Hematol Inmunol Hemoter [serie en internet]. 2006;(1): Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-02892006000100002&lng=es&nrm=iso&tlng=es
6. Ratajczac MZ, Zuba-Surma EK, Wysoczynski M, Ratajczak J, Kucia M. Very small embryonic-like stem cells: characterization, developmental origin, and biological significance. Exp Hematol. 2008;36:742-51.
7. Hernández P. Medicina regenerativa y células madre. Mecanismos de acción de las células madre adultas. Rev Cubana Hematol Inmunol Hemoter [serie en internet]. 2009;25(1): Disponible en:
http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-02892009000100002&lng=es&nrm=iso&tlng=es
8. Prosper F, Gavira JJ, Herreros J, Rábago G, Luquin R, Moreno J, et al. Trasplante celular y terapia regenerativa con células madre. An Sist Sanit Navar. 2006;29(Supl 3):219-34.
9. Hayden EC, Baker M. Virus-free pluripotency for human cells. Stemcell advance could bring tailored treatments closer. Nature. 2009;458:19.
10. Zhou Q, Brown J, Kanarek A, Rajagopal J, Melton DA. In vivo reprogramming of adult pancreatic exocrine cells to â -cells. Nature. 2008;455:627-33.
11. Boyum A, Lovhaug D, Tresland L, Nordlie EM. Separation of leukocytes: Improved cell purity by fine adjustments of gradient medium density and osmolality. Scand J Immunol. 1991;34:697-712.
12. Hernández P, Artaza H, Díaz AJ, Cortina LD, Lam RM, Pol N, et al. Autotrasplante de células madre adultas en miembros inferiores con isquemia crítica. Rev Esp Invest Quirur. 2007;10:204-11.
13. Cortina L, Hernández P, López De Roux MR, Artaza HM, Dorticós E, Macías C, et al. Aislamiento de células mononucleares de sangre periférica para trasplante de células madre: método simplificado. Rev Cubana Hematol Inmunol Hemoter [serie en internet]. 2008;24(3): Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-02892008000300004&lng=es&nrm=iso&tlng=es
14. Suárez-Monteagudo C, Hernández-Ramírez P, Álvarez-González L, García-Maeso I, de la Cuétara-Bernal K, Castillo-Díaz L, et al. Autologous bone marrow stem cell neurotransplantation in stroke patients. An open study. Restor Neurol Neurosc. 2009;27:15161.
15. Peix A, Hidalgo J, Dorticós E, Llerena L, Paredes A, Torres M, et al. Reparación del miocardio mediante la terapia con células madre. Article No AJ 32-1 Alasbimn J. 2006;8(32): [citado 10 julio 2009] Disponible en: http://www2.alasbimnjournal.cl/alasbimn/CDA/sec_b/0,1206,SCID%253D16340,00.html
16. Tateishi-Yuyama E, Matsubara H, Murohara T, Ikeda V, Shintani S, Masaki H, et al. Therapeutic angiogénesis for patients with limb ischaemia by autologous transplantation of bone marrow cells: A pilot study and a randomised controlled trial. Lancet. 2002;360:427-35.
17. Huang PP, Li SZ, Han MZ, Xiao ZJ, Yang RC, Qiu LG, et al. Autologous transplantation of peripheral blood stem cells as an effective therapeutic approach for severe arteriosclerosis obliterans of lower extremities. Thromb Haemost. 2004;91:606-9.
18. Huang PP, Li SZ, Han MZ, Xiao ZJ, Yang RC, Han ZC. Autologous transplantation of granulocyte colony-stimulating factor-mobilized peripheral blood mononuclear cells improves critical limb ischemia in diabetes. Diabetes Care. 2005;28:2155-60.
19. Yang XF, Wu YX, Wang HM, XU YF, Lü X, Zhang YB, et al. Autologous peripheral blood stem cells transplantation in treatment of 62 cases of lower extremity ischemic disorder. Zhonghua Nei Ke Za Zhi. 2005;44:95-8 (artículo en chino, resumen en inglés).
20. Lenk K, Adams V, Lurz P, Erbs S, Linke A, Gielen S, et al. Therapeutical potential of blood-derived progenitor cells in patients with peripheral arterial occlusive disease and critical limb ischaemia. Eur Heart J. 2005;26:1903-9.
21. Fam NP, Verma S, Kutryk K, Stewart DJ. Clinician guide to angiogenesis. Circulation. 2003;108:2613-8.
22. Yoon YS, Lee N, Scadova H. Myocardial regeneration with bone-marrow-derived stem cell. Biol Cell. 2005;97:253-63.
23. Fraser JK, Schreiber RE, Zuk PA, Hedrick MH. Adult stem cell therapy for the heart. Int J Biochem Cell Biol. 2004;36:658-66.
24. Hughes GC, Annex BH. Angiogenic therapy for coronary artery and peripheral arterial disease. Expert Rev Cardiovasc Ther. 2005;3:521-35.
25. Gu Y, Zhang J, Qi L. Comparative study on autologous implantation between bone marrow stem cell and peripheral blood stem cells for treatment of lower limb ischemia. Zhongguo Xiu Fu Chong Jian Wal Ke Za Zhi. 2007;21:675-8 (artículo en chino, resumen en inglés).
26. Díaz AJ, León L, Hernández NM. Experiencia con la terapia celular en el tratamiento de enfermedades vasculares periféricas. Rev Cubana Hematol Inmunol Hemoter [serie en internet]. 2009;25 (Supl. Resumen 3-3-9): [citado 1 marzo 2010] Disponible en: http://bvs.sld.cu/revistas/hih/vol25_04_09/hih02409.htm
27. Cabrera M, Fernández J, Marrero I, Ramírez N, Álvarez K, Guerra T, et al. Autotrasplante de células madre hematopoyéticas en miembros Inferiores isquémicos de pacientes con ateroesclerosis obliterante en los estadios III-IV de la clasificación de Fontaine. Experiencia en Cienfuegos. Rev Cubana Hematol Inmunol Hemoter [serie en internet]. 2009;25 (Supl. Resumen 3-3-10): [citado 1 marzo 2010] Disponible en: http://bvs.sld.cu/revistas/hih/vol25_04_09/hih02409.htm
28. Aparicio Suárez JL, Alfonso Simón A, Rivera Ramos O, Reyes C. Extensión de la medicina regenerativa en Cuba. Experiencias villaclareñas. Rev Cubana Hematol Inmunol Hemoter [serie en internet]. 2009;25 (Supl. Poster HM 060): [citado 1 marzo 2010] Disponible en: http://bvs.sld.cu/revistas/hih/vol25_04_09/hih02409.htm
29. Artaza HM, Hernández P, Del Valle L, Socarrás BB, González AI, Matamoros MA, et al. Implante de células madre autólogas en pacientes con insuficiencia arterial crónica de los miembros inferiores estadios IIb. Rev Cubana Hematol Inmunol Hemoter [serie en internet]. 2009;25 (Supl. Resumen 3-3-05): [citado 1 marzo 2010] Disponible en: http://bvs.sld.cu/revistas/hih/vol25_04_09/hih02409.htm
30. Pol N, Hernández P, Vargas E, González AI, del Valle L, Matamoros MA, et al. Evaluación del autotrasplante de células mononucleares hematopoyéticas por vía intraarterial en pacientes con insuficiencia arterial crónica de miembros inferiores estadio II. Rev Cubana Hematol Inmunol Hemoter [serie en internet]. 2009;25 (Supl Resumen 3-3-06): [citado 1 marzo 2010] Disponible en: http://bvs.sld.cu/revistas/hih/vol25_04_09 /hih02409.htm
31. Chochola M, Pytlík R, Kobylka P, Skalická L, Kideryová L, Beran S, et al. Autologous intra-arterial infusion of bone marrow mononuclear cells in patients with critical leg ischemia. Int Angiol. 2008;27:281-90.
32. Amann B, Luedermann C, Ratei R, Schmidt-Lucke JA. Autologous bone marrow cell transplantation increases leg perfusion and reduces amputaction in patients with advanced critical limb ischemia due to peripheral artery disease. Cell Transplant. 2009;18:371-80.
33. Bartsch T, Falke T, Brelum M, Zeus T, Kögler G, Wernet P, et al. Transplantation of autologous adult bone marrow stem cells in patients with severe peripheral arterial oclusion disease. Med Klin. 2006;101(Suppl 1):195-7.
34. Blanco AM, Artaza H, Goicoechea P, Sainz J, Hernández P, Lam RM. Autotrasplante de células mononucleares en pacientes diabéticos con lesiones en miembros inferiores. Rev Cubana Hematol Inmunol Hemoter [serie en internet]. 2009;25 (Supl. Resumen 3-3-11): [citado 1 marzo 2010] Disponible en: http://bvs.sld.cu/revistas/hih/vol25_04_09/hih02409.htm
35. León L, Díaz AJ, Hernández NM, Meliáns S. Obtención y procesamiento de células madre autólogas a partir de sangre periférica en diferentes enfermedades. Rev Cubana Hematol Inmunol Hemoter [serie en internet]. 2009;25 (Supl Resumen 3-3-22): [citado 1 marzo 2010] Disponible en: http://bvs.sld.cu/revistas/hih/vol25_04_09/hih02409.htm
36. Goicoechea P, Artaza HM, Blanco A, García S, Atencio E, Hernández P, et al. Implantación de células madre autólogas obtenidas de sangre periférica en pacientes con linfedema crónico de miembros Inferiores. Rev Cubana Hematol Inmunol Hemoter [serie en internet]. 2009;25 (Supl Resumen 3-3-17): [citado 1 marzo 2010] Disponible en: http://bvs.sld.cu/revistas/hih/vol25_04_09/hih02409.htm
37. Hou C, Wu X>, Jin X. Autologous bone marrow stromal cells transplantation for the treatment of secondary arm lymphedema: A prospective controlled study in patients with breast cancer related lymphedema. Jpn J Clin Oncol.2008;38:670-4.
38. Obregón A, Wilford M, Ysla R, Aroche R, Figueredo Y, Luna C. Seguridad y eficacia de la implantación por vía coronaria de células madre hematológicas de sangre periférica obtenidas por aféresis en el infarto agudo del miocardio. Rev Cubana Hematol Inmunol Hemoter [serie en internet]. 2009;25 (Supl. Resumen 3-3-13): [citado 1 marzo 2010] Disponible en: http://bvs.sld.cu/revistas/hih/vol25_04_09/hih02409.htm
39. Peix A, Hidalgo J, Dorticós E, Llerena L, Cabera LO, Hernández P, et al. Cardiología nuclear en la evaluación del trasplante de células madre derivadas de médula ósea en insuficiencia cardíaca crónica de etiología isquémica. Cuatro años de seguimiento. Rev Cubana Hematol Inmunol Hemoter[serie en internet]. 2009;25 (Supl Resumen 3-3-17): [citado 1 marzo 2010] Disponible en: http://bvs.sld.cu/revistas/hih/vol25_04_09 /hih02409.htm
40. Prockop DJ, Olson SD. Clinical trials with adult stem/progenitor cells for tissue repair: let´s not overlook some essential precautions. Blood. 2007;109:3147-51.
41. Collins JM, Russell B. Stem cell therapy for cardiac repair. J Cardiovasc Nurs. 2009;24:93-7.
42. Baganet A, Pérez E, Hernández P, Dorticós E, Luaces L, Del Valle L. Implante de células mononucleares hematopoyéticas en necrosis aséptica de la cadera. II Simposio Internacional de Medicina Regenerativa. Rev Cubana Hematol Inmunol Hemoter [serie en internet]. 2009;25 (Supl. Resumen 3-3-17): [citado 1 marzo 2010] Disponible en: http://bvs.sld.cu/revistas/hih/vol25_04_09/hih02409.htm
43. Cui DP, Zhao DW. Treatment of early osteonecrosis of femoral head by core decompression and autograft of mesenchymal stem cell cultured in vitro under arthroscopy: Experiment with rabbits. Zhonghua Yi Xue Za Zhi. 2009:89:338-41 (artículo en chino, resumen en inglés).
44. Hernigou P, Poignard A, Zilber S, Rouard H. Cell therapy of hip osteonecrosis with autologous bone marrow grafting. Indian J Orthop. 2009;43:405.
45. Pérez-Borrego A, Domínguez-Rodríguez L, Ilisástigui-Ortueta ZT, Hernández-Ramírez P. Utilización de células madre en el tratamiento de defectos óseos periodontales. Presentación de un caso. Rev Cubana Estomatol [serie en internet]. 2009;46(4): [citado 1 marzo 2010] Disponible en: http://bvs.sld.cu/revistas/est/vol_46_04_09/est12409.pdf
46. Kondziolka D, Wechsler L, Goldstein S, Meltzer C, Thulborn KRl, Gebel J, et al. Transplantation of cultured human neuronal cells for patients with stroke. Neurology. 2000;55:65-9.
Recibido: 12 de agosto del 2010.
Aprobado: 30 de agosto del 2010.
Prof. DrC. Porfirio Hernández-Ramírez. Instituto de Hematología e Inmunología. Apartado 8070, CP 10800. Ciudad de La Habana, Cuba. Tel (537) 643 8695, 8268, Fax (537) 644 2334. correo electrónico: ihidir@hemato.sld.cu; ihi@infomed.sld.cu
Website: http://www.sld.cu/sitios/ihi/index.php