My SciELO
Services on Demand
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Hematología, Inmunología y Hemoterapia
Print version ISSN 0864-0289
Rev Cubana Hematol Inmunol Hemoter vol.29 no.1 Ciudad de la Habana Jan.-Mar. 2013
ARTÍCULO DE REVISIÓN
Avances y aplicación clínica de la citometría hemática automatizada
Advances and clinical application of automated hematic cytometry
Lic. Láser Humberto Hernández-Reyes
Instituto de Hematología e Inmunología. La Habana, Cuba.
RESUMEN
Se revisan los antecedentes históricos del surgimiento de la automatización en la rama hematológica y los principios de detección utilizados por los contadores automáticos de células sanguíneas, con referencia a su acción combinada en la caracterización de las distintas poblaciones celulares hemáticas. Se describen los componentes básicos de los analizadores hematológicos. Se detalla la obtención, intervalo de referencia y utilidad clínica de las variables de uso común ofrecidas por estos equipos en el estudio de los eritrocitos y trombocitos, referidos a los parámetros más actualizados en el estudio de estas series celulares. En cuanto a los leucocitos, se mencionan los principales parámetros relacionados con el estudio automatizado de uso rutinario, la utilidad de los novedosos principios inmunológicos de detección en la caracterización de esta población celular, así como los logros y obstáculos manifiestos durante el conteo y estudio de las subpoblaciones leucocitarias inmaduras o anómalas. Por último, se exponen las ventajas del uso de los contadores hematológicos para el trabajo actual del laboratorio de hematología y la necesidad del conocimiento de sus potencialidades diagnósticas por parte de los médicos, especialmente los hematólogos e inmunólogos.
Palabras clave: citometría hemática, contadores hematológicos.
ABSTRACT
Historical background on the development of automation in hematology as well as the major detection principles used by automated blood cell counters are reviewed, referring to their combined action in the characterization of various hematic cell populations. The basic components of hematological analyzers are described. Obtention reference interval and clinical utility of commonly used variables provided by these equipments for the study of erythrocytes and thrombocytes are described referring to the most updated parameters for the study of these cell series. The main parameters of the everyday leukocyte automated study, the novel immunological detection principles used in its characterization, as well as the achievements and obstacles found during this process are mentioned. Finally, the advantages of blood cell counters for the current hematology laboratory work and the need of knowledge of its diagnostic potential by physicians, particularly hematologists and immunologists, are presented.
Key words: hematic cytometry, hematological counters.
INTRODUCCIÓN
El conocimiento sobre los cambios fisiopatológicos que acompañan al proceso salud-enfermedad alcanzado por las ciencias médicas durante la segunda mitad del siglo XX fue vertiginoso. Esto se tradujo para la rama de laboratorio clínico, en el surgimiento y puesta en manos de sus profesionales, de un número cada vez mayor de determinaciones destinadas a complementar el examen físico y el interrogatorio médico, para finalmente establecer un diagnóstico. La aplicación de la mecanización y posterior automatización del trabajo analítico, aumentó considerablemente las potencialidades de procesamiento del laboratorio clínico multidisciplinario y permitió la realización de un mayor número de determinaciones en menor tiempo, el incremento de los indicadores de calidad (precisión y exactitud) a cifras nunca antes alcanzadas mediante el trabajo manual, la disminución significativa de los costos y el acortamiento en los tiempos de entrega de los resultados al cliente (médicos y pacientes).1
La hematología, como una de las principales líneas de trabajo del laboratorio clínico, no permaneció ajena al desarrollo de la automatización e incrementó sus potencialidades diagnósticas con el surgimiento y perfeccionamiento de los contadores o analizadores hematológicos.
RESEÑA HISTÓRICA SOBRE EL PROCESO DE CONTEO DE CÉLULAS SANGUÍNEAS
El desarrollo del proceso de automatización en el laboratorio clínico fue discreto durante los siglos XVIII, XIX y primera mitad del XX. Los primeros reportes sobre el conteo de células hemáticas datan del año 1794, cuando utilizando un dispositivo de lentes rudimentarias se realizó la primera descripción precisa de los glóbulos rojos. Más tarde, en el siglo XIX, se pudieron observar las plaquetas y diferenciar las subpoblaciones leucocitarias mediante la tinción con anilinas. El primer método para el recuento electrónico de células sanguíneas fue publicado en 1934; en esta técnica el conteo se realizaba mediante la detección foteléctrica de la luz dispersada.2
Las potencialidades de estos procedimientos no encontraron en aquella época aplicación en la hematología. No fue hasta 1956, luego de la segunda guerra mundial, que ante la escasez de personal calificado, el aumento de la carga de trabajo y la necesidad en los laboratorios de hematología de ofrecer un recuento celular cada vez más fiable y rápido, se diseñó el primer contador automático de células utilizando los modelos creados en años anteriores. Esto representó el nacimiento del primer contador Coulter modelo A.1-4
Los primeros contadores celulares, aunque constituyeron un avance importante, solo eran capaces de realizar conteos electrónicos globales de eritrocitos y menos satisfactoriamente, de leucocitos; no obstante, marcaron la ruta para la innovación y perfeccionamiento de varias generaciones de estos equipos. El surgimiento y desarrollo de los programas informáticos, los ordenadores, la robotización, la mecanización y diversos métodos de detección, entre otras tecnologías, han contribuido al aumento de las potencialidades de estos equipos.
En la actualidad, los contadores hematológicos han incrementado significativamente la capacidad de análisis y presentan amplios menús de determinaciones, elevada complejidad electrónico-mecánica y mayor productividad en el procesamiento de muestras. De este modo, se han convertido en una poderosa herramienta en la orientación diagnóstica, pronóstica y terapéutica de los trastornos hematológicos.1-3
La influencia del desarrollo tecnológico sobre los contadores celulares ha posibilitado el surgimiento de una gran diversidad de modelos. No obstante, todos estos equipos exhiben un diseño mecánico y electrónico similar. En la figura 1 se muestra el esquema básico de un contador hematológico.
Componentes básicos de un contador hematológico2
- Diluidor: sistema que reduce la concentración de las células sanguíneas y las suspende en soluciones conductoras isotónicas para adecuarla a las capacidades de medida del dispositivo.
- Aspirador: sistema que toma la muestra diluida y la conduce hacia el dispositivo de medida.
- Sistema de fluidos: transporta las suspensiones celulares hacia el dispositivo de medida o la cámara de recuento.
- Cámara de recuento o dispositivo de medida: constituye la parte central o zona sensible del equipo, donde ocurren los fenómenos ópticos, eléctricos o ambos, medidos posteriormente.
- Transductor o detector: son los dispositivos que generan linealmente pulsos eléctricos cuando las células pasan la zona sensible, óptica o eléctrica, del equipo.
- Discriminador: discrimina los pulsos eléctricos generados por los transductores en correspondencia con el tipo celular medido.
- Amplificador: amplifica la señal eléctrica que sale del discriminador para su posterior procesamiento.
- Convertidor analógico-digital: convierte las señales eléctricas en digitales.
- Ordenador: procesa las señales digitales y las convierte en datos que serán mostrados en pantalla y que pueden ser impresos.
La parte electrónica del equipo está compuesta por el amplificador, el convertidor y el ordenador.
La mayoría de los analizadores hematológicos actuales disponen de la incorporación de ordenadores o microprocesadores que automáticamente o mediante una mínima interacción con el operador, dirigen y controlan el funcionamiento armónico entre todos los componentes del sistema, procesan las señales ofrecidas por los sistemas de detección, garantizan la rapidez de procesamiento, el control de calidad y la confección de listas de trabajo. Además, controlan el accionar de toda una serie de dispositivos destinados a indicar fallas o demandas del sistema, como pueden ser las necesidades de mantenimiento, el agotamiento o contaminación de los reactivos, la presentación de muestras no óptimas para su procesamiento, etc. Las fallas durante el procesamiento son generalmente indicadas mediante mensajes en pantalla o a través de una señal visual o sonora.1-4
PRINCIPIOS GENERALES DE DETECCIÓN UTILIZADOS POR LOS CONTADORES O ANALIZADORES HEMATOLÓGICOS
Medida de la variación de impedancia o resistencia eléctrica (principio Coulter)
Las células de una muestra de sangre total diluida en una solución electrolítica se hacen pasar, una detrás de la otra, a través de una abertura de determinado diámetro, por la que circula una corriente eléctrica de cierta intensidad inducida por 2 electrodos dispuestos a ambos lados de la abertura u orificio. Al pasar cada célula a través del orificio causa un cambio en la resistencia eléctrica que genera un pulso de voltaje cuya altura o amplitud será proporcional al tamaño o volumen la célula. El número de pulsos eléctricos generados se relaciona con la cantidad de células que atraviesan la abertura. Dentro de las ventajas de esta tecnología se citan su sencillez, bajo costo, la posibilidad de poderse aplicar aún en los instrumentos más pequeños y su marcada utilidad para la medición de los volúmenes celulares. En la actualidad, este principio se aplica como método de referencia para el recuento celular hemático y la medición de los volúmenes (tamaño) de cada población celular. Es utilizado por la mayoría de los fabricantes de contadores hematológicos debido a su marcada reproducibilidad, rapidez y disminución del error estadístico.2-5
Medición de la cantidad de luz dispersada (método óptico)
La medición de la intensidad de luz dispersada es utilizada frecuentemente por los contadores celulares en sus mediciones. Las células en suspensión se hacen pasar alineadamente una detrás de otra, a través de una pequeña zona sobre la que incide perpendicularmente un haz de luz halógena o láser, lo que provoca la interrupción y dispersión lumínica de la energía radiante en diversos ángulos. El número de interacciones del haz de luz se corresponde con la cantidad de células que pasan por la zona de sensible del aparato y la magnitud de su dispersión será una función de distintas propiedades o características celulares, dentro de las que pueden citarse el volumen celular, el tamaño, el contorno y el índice de refracción que constituye una función del contenido celular (presencia de granulaciones, coloración, lobularidad nuclear, entre otros).2,4-6
Para la detección de la luz dispersa se utilizan varios detectores colocados en diversos ángulos con respecto al haz incidente. La fracción luz dispersada en un ángulo cónico entre 0-10o, que casi coincide con la dirección del haz incidente, será proporcional al volumen celular. Por otro lado, la fracción de luz dispersada perpendicularmente con respecto al haz incidente, será una función de la complejidad de la estructura intracelular.2,4-6
La incorporación de una fuente de luz láser y la medición de su dispersión, de modo similar a la utilizada en las técnicas de citometría de flujo, ha conferido mayor calidad a las determinaciones y posibilitado la incorporación de nuevos índices hematimétricos a los ya existentes. Cabe destacar que actualmente no son todos los contadores los que cuentan con esta tecnología.4-6
El método óptico encuentra su principal aplicación en la realización automática del recuento diferencial de leucocitos y en el estudio de la composición interna de las células, aunque también se aplica en la realización de los conteos globales y medición de los volúmenes celulares.4,6
Técnicas inmunológicas mediante anticuerpos monoclonales (AcMo) acoplados a fluorocromos (citometría de flujo)
En los últimos años se han incorporado los métodos de detección inmunológica en los autoanalizadotes. Estas técnicas integran la dispersión de luz con la emisión de fluorescencia (488 nm láser-azul), de modo similar a los citómetros de flujo convencionales. La combinación de la tecnología óptica con la detección de fluorescencia mediante el uso de AcMo marcados con fluorocromos aplicada a los autoanalizadores hematológicos, ha supuesto un claro avance en la discriminación de las distintas subpoblaciones celulares hematológicas.2,4,5
En la técnica de citometría de flujo las células en suspensión se hacen pasar alineadamente una a una, por delante de un haz de luz láser monocromático, lo que causa su dispersión en diversos ángulos y la emisión de energía fluorescente, previo marcaje de las estructuras celulares con anticuerpos monoclonales acoplados a fluorocromos. La utilización de una fuente de luz láser, generalmente de argón, ofrece un rayo monocromático más intenso, más colimado y capaz de inducir la excitación de ciertos compuestos (fluorocromos) con la consecuente inducción de la señal fluorescente, lo que garantiza una medición fotométrica más exacta.4,7,8
La interacción de haz láser con cada célula marcada produce 2 tipos de señales: de dispersión y de fluorescencia. Para su detección, las señales de dispersión se dividen en 2 fracciones: fracción dispersa ángulo estrecho (0-100) hacia adelante en o Forward Scatter (FSC), y fracción dispersa en ángulo de 900 con respecto al haz incidente o Side Scatter (SSC), las que serán recogidas por 2 detectores de dispersión colocados al efecto (Fig. 2).4,7,8
Las señales de fluorescencia serán recogidas por 3 detectores de fluorescencia en equipos de un solo láser y por un cuarto detector en equipos de 2 láseres. La posibilidad de utilizar varios detectores para la recogida de las señales ofrecidas por la fuente de luz láser al interactuar con cada célula, proporciona al unísono 2 parámetros de dispersión y 3, e incluso 4, de fluorescencia (Fl1, Fl2 y Fl3) por cada célula analizada. Esta característica de la citometría de flujo la convierte en una poderosa técnica multiparamétrica al ofrecer simultáneamente varios parámetros sobre cada célula y la relación de estos parámetros con los de otra célula también analizada.4,7,8
Gracias a su elevada especificidad, mediante la citometría de flujo se pueden estudiar varias poblaciones celulares diferentes y detectar la presencia de una subpoblación dada en muestras donde predominen otras poblaciones celulares mayoritarias.2,9
En la práctica médica hematológica e inmunológica, este principio encuentra aplicación en el conteo e identificación de subpoblaciones linfocitarias (inmunofenotipo), estudios de función plaquetaria, determinación de reticulocitos inmaduros y en la caracterización de las leucemias agudas y síndromes mieloproliferativos, entre otras.2,8-10
Aunque se ha hecho referencia a los principios de medición que generalmente se ponen en práctica, es bueno destacar que en ocasiones estos se combinan en un mismo analizador con otros métodos de detección y caracterización celular, como son la citoquímica (tinción de peroxidasa, negro Sudán, etc.), la detección de la conductividad o radiofrecuencia y el análisis de núcleos, previa lisis leucocitaria.2,4
Por otra parte, estos equipos disponen de mecanismos para evitar los errores de coincidencia, que tienen lugar cuando 2 células atraviesan al mismo tiempo la zona de sensora o al pasar repetidas veces la misma célula por dicha zona. Para evitar los errores de coincidencia se aplican tecnologías como el diseño o enfoque hidrodinámico y el flujo de barrido.2,4,7
Con el diseño hidrodinámico se logra que las células disueltas en la corriente salina transportadora penetren en la cámara de medición de forma cónica estrechada hasta unos 20 mm. El flujo de barrido consiste en el flujo perpendicular de una corriente estacionaria de diluyente por detrás de las aberturas destinadas al recuento celular para evitar que dichas células sean removidas de la zona de detección una vez atravesada.2,4,7
A partir de las señales generadas por los detectores y procesadas automáticamente se presentan en pantalla las representaciones gráficas de las distintas poblaciones celulares mediante citogramas e histogramas. En estos gráficos, las poblaciones celulares son representadas sobre un eje de coordenadas X/Y mediante agrupaciones homogéneas de puntos de acuerdo con sus características físicas de dispersión, fluorescencia o ambas. Los histogramas o citogramas de un solo parámetro proporcionan información sobre el número de células que expresan un solo parámetro y la intensidad con que lo expresan. No obstante, la mayoría de los citogramas relacionan 2 e incluso 3 parámetros para una misma población celular.2,4,7,10
UTILIDAD CLÍNICA DE LOS PARÁMETROS ERITROCITARIOS DE LA CITOMETRÍA HEMÁTICA AUTOMATIZADA
La determinación del número de eritrocitos, la concentración de hemoglobina y la detección de las alteraciones morfológicas de la serie roja (eritrocitos), constituyen casi inevitablemente las primeras indicaciones cuando se desea evaluar la magnitud y causas de la anemia. Como parte de la citometría hemática automatizada, se realizan una serie de mediciones que ponen en manos del clínico un grupo de parámetros o índices eritrocitarios destinados a facilitar el adecuado diagnóstico, dentro de las que se citan:
- Medición de la concentración de hemoglobina (Hb): mediante el refinamiento del método de cianometahemoglobina, los analizadores hematológicos han exhibido estándares de confiabilidad muy superiores a los alcanzados por los métodos manuales, lo que le confiere superioridad a la determinación automatizada.2,5,6 Otro de los métodos descritos para la determinación de la concentración de hemoglobina se basa en la medición de la cantidad de de luz láser dispersada, técnica descrita en 1986 y aplicada en la actualidad.6
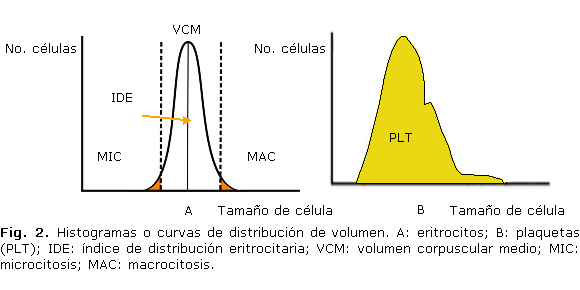
- Recuento de glóbulos rojos: generalmente se realiza aplicando el principio Coulter, aunque se puede determinar por dispersión de la luz o la combinación de ambos.2,6,11 A partir del número de células contadas por unidad de volumen se genera el histograma de distribución de eritrocitos, que se muestra gráficamente (Fig. 2).
- Hematócrito (HCT): puede ser calculado relacionando el volumen corpuscular medio (VCM) con el recuento de glóbulos rojos o medido como la sumatoria de los volúmenes celulares de una muestra fija.4,11
Las determinaciones antes descritas se conocen como índices eritrocitarios básicos o primarios y a aquellos que derivan de ellos se les conoce como parámetros derivados o secundarios; a continuación se exponen algunos de ellos:2,4,5,11
- Volumen corpuscular medio (VCM): en términos absolutos ofrece una información sobre el volumen promedio de los eritrocitos. Los valores de referencia son de 82-95 fl. El valor de este parámetro puede ser obtenido a partir del histograma de distribución de volumen de los eritrocitos (Fig. 2) o medido directamente mediante la técnica de dispersión de la luz láser, lo que ha significado un notable avance.4,6,11
Atendiendo a los resultados de esta variable se lleva a cabo la clasificación morfológica de la anemias, lo que ha permitido desarrollar estrategias en el diagnóstico de estas entidades.1,11,12 Debe aclararse que a pesar de su importancia, el VCM no informa sobre características morfológicas distintas al tamaño eritrocitario ni sobre la coexistencia en una misma muestra de poblaciones heterogéneas en cuanto a volumen celular. Por esta razón, a partir de la curva de distribución de frecuencias o histograma elaborado tomando como base las medidas repetidas de los volúmenes celulares individuales, se obtiene el coeficiente de variación alrededor de la media correspondiente. Este parámetro se conoce como ancho de distribución de los glóbulos rojos (RDW-CV) o amplitud de la curva de distribución de los eritrocitos (ADE) y sí es una medida fiel del grado de anisocitosis en la muestra. En algunos analizadores este parámetro se expresa en femtolitros, como la desviación estándar de la curva de distribución de eritrocitos (RDW-DS) que corresponde al 20 % por encima de la línea base del histograma. A esta altura es donde se encuentra el mayor grado de variación en el tamaño de las células.5,6,11
Los valores del VCM son útiles en la clasificación de las anemias microcíticas, macrocíticas y normocíticas.1,11,12 La relación entre los valores del VCM y el RDW resulta sumamente importante en el diagnóstico diferencial entre la anemia ferripriva y las talasemias (tabla 1).
De hecho, se han propuesto nuevas clasificaciones de las anemias basados en la utilización exclusiva del VCM y del RDW.6 La clasificación de las anemias propuesta por algunos autores sugiere que la ferropenia y la b-talasemia podían distinguirse en base al valor del RDW, siempre más elevado en la primera y normal en la talasemia. Estudios posteriores demostraron que mientras lo primero se cumplía prácticamente siempre, lo segundo solo en el 50 % de los casos (tabla 1).
También es conocido que el RDW está muy aumentado en la db-talasemia, siendo superior al de la anemia ferropénica. No obstante, una diferencia fundamental entre la ferropenia y la b-talasemia corresponde al porcentaje de hematíes microcíticos (MICRO %) e hipocrómicos (HIPO %). En la ferropenia existe siempre un aumento de hematíes hipocrómicos (30,7 %) que es menor en la talasemia (13-14 %), la que se caracteriza por un aumento de los hematíes microcíticos (31-33 %) no tan acusado en la ferropenia (17 %) (tabla 1).6,13,14
La a-talasemia homocigótica posee un VCM muy similar al de la ferropenia y un RDW aumentado, aunque con valores próximos a la normalidad. Las diferencias con la anemia ferropénica están en el número de hematíes hipocrómicos, que coincide con el resto de talasemias y con estas últimas, en que sus valores de microcitos son muy similares a los obtenidos en la ferropenia (tabla 1).6,13
Los valores de VCM aumentan en la anemia megaloblástica y en eritroenziomopatías como el déficit de glucosa 6 fosfato deshidrogenasa (G6PD) y de piruvato cinasa (PK). Por otro lado, disminuyen en la esferocitosis hereditaria y en la a-talasemia homocigótica (tabla 2).6,11
- Hemoglobina corpuscular media (HCM): es el valor promedio de la hemoglobina contenida en cada eritrocito. Sus valores de referencia son de 28-32 pg. Se calcula a partir del valor de hemoglobina y del recuento de eritrocitos. Valores menores a 27 pg se observan en anemias microcíticas, mientras que valores mayores a 35 pg son típicos de anemias macrocíticas.11,12
- Concentración de hemoglobina corpuscular media (CHCM): se refiere a la concentración promedio de hemoglobina por mililitro (mL) de eritrocitos. En adultos, los valores de referencia son 32-36 %. Puede ser calculada utilizando los valores de hemoglobina y de hematócrito o medida directamente mediante luz láser y su grado dispersión.6,11,15
A partir de su medición directa se obtiene el histograma de distribución de eritrocitos según su concentración de hemoglobina corpuscular media y la amplitud de distribución de los hematíes (ADH) según su concentración de hemoglobina, conocida por sus siglas en ingles como HDW (haemoglobin distribution width).6,11,15
La CHCM disminuye en la anemia ferropénica y en la a-talasemia homocigótica y aumenta en la esferocitosis hereditaria, eliptocitosis congénita y en la xerocitosis congénita. El aumento de la CHCM observado en la esferocitosis hereditaria y en la eliptocitosis, se acompaña de valores elevados del RDW y de la HDW.
La anemia megaloblástica cursa con valores de CHCM dentro del intervalo de referencia; no obstante, muestra cifras RDW y de HDW elevadas (tabla 2).6,12,15
Sobre la base de valores de CHCM, la sangre puede ser clasificada como nomocrómica, hipocrómica o hipercrómica.11
Otros parámetros relacionados con el diagnóstico diferencial de distintos tipos de anemias ofrecidos por estos equipos, son los porcentajes globales de hematíes macrocíticos, microcíticos, normocrómicos, hipercrómicos e hipocrómicos, así como el cociente de células microcíticas-hipocrómicas (M/H). Este último constituye un parámetro importante para la diferenciación entre rasgo talasémico y anemia por deficiencia de hierro, al mostrar valores menores que 0,9 en la anemia ferropénica y mayores en el rasgo talasémico (tabla 1). La relación entre estos parámetros permite conocer qué porcentaje de la población de hematíes clasificada como microcítica es hipocrómica, normocrómica e hipercrómica; y de la población de hematíes hipocrómicos, qué porcentaje existirá de macrocitos, microcitos y normocitos.6,11,13
- La medida del contenido de hemoglobina presente en los reticulocitos (CHr) es otro parámetro de reciente incorporación ofrecido por los analizadores hematológicos. Constituye un indicador precoz de eritropoyesis deficiente en hierro que es mucho más sensible a la suplementación con hierro que otros parámetros, tales como hematócrito, hemoglobina, VCM, RDW, HCM y ferritina (esta última puede presentar variaciones en un proceso inflamatorio).1,11
La evaluación de la efectividad de la actividad eritropoyética en diversas hemopatías y posterior al tratamiento, es caracterizada en los contadores a través de diversas variables relacionadas con el recuento y caracterización de los reticulocitos, dentro de las que se citan: recuentos absolutos y porcentuales de reticulocitos (RET# y RET%, respectivamente), reticulocitos con bajo contenido en ARN (RET L), medio (RET M) y alto (RET H); volumen medio reticulocitario (VRM), fracción de reticulocitos inmaduros (FRI) y el recuento de reticulocitos corregido (CRC).4,11,16
UTILIDAD CLÍNICA DE LOS PARÁMETROS PLAQUETARIOS DE LA CITOMETRÍA HEMÁTICA AUTOMATIZADA
- Plaquetas (PLT): se refiere al recuento global de plaquetas realizado de forma automatizada. Sus valores de referencia varían en relación con la técnica utilizada para su recuento, aunque generalmente fluctúan de 150 a 400 × 109/L.4
- Volumen medio plaquetario (VPM): es un indicador del tamaño de las plaquetas y muestra una relación inversa no lineal con el número de estas. Se deriva directamente del análisis de la curva de distribución de volumen de las plaquetas (Fig. 2).2,11,17
El VPM está aumentando en enfermedades mieloproliferativas, talasemias heterocigotas alfa y beta, coagulación intravascular diseminada, procesos microangiopáticos, trombocitopenia por destrucción periférica. Disminuye en pacientes con anemia aplástica, anemia megaloblástica, quimioterapia antitumoral, trombocitopenia por hipoplasia medular. El VPM es normal en pacientes ferropénicos; por ello, junto con el RDW y el MCV, se utiliza para diferenciar sideropenia de las talasemias (tabla 3).11,17
El VPM es un marcador indirecto de la activación y función plaquetaria, y se observa correlación entre el aumento del VPM y los estados de agregación plaquetaria, síntesis de tromboxano, función procoagulante y expresión de moléculas de adhesión.11,17
Se han observado incrementos del VPM en el infarto agudo del miocardio y cuando existen factores de riesgo de enfermedad vascular (hipercolesterolemia, diabetes mellitus), en la enfermedad inflamatoria intestinal activa y en pacientes en tratamiento con hormonoterapia estrogénica (tabla 3).11,17,18
Al comparar el VPM en la evolución normal del embarazo con el de pacientes con preeclampsia, en algunas series este índice se encuentra más alto en el segundo grupo, lo que podría ser un dato orientativo del riesgo de padecer la enfermedad.5,11,18
Este parámetro ofrece mejores resultados en las muestras anticoaguladas con citrato sódico. Su valor en sangre recogida en EDTA no es fiable, ya que el VPM aumenta al alargarse el tiempo desde la extracción hasta el análisis.11,17
- Plaquetocrito (PCT): se calcula relacionando el recuento de células con el volumen medio plaquetario. Ofrece un estimado sobre la fracción del volumen sanguíneo total ocupada por las plaquetas e incrementa sus valores en todos aquellos estados fisiológicos o patológicos que cursen con trombocitosis, aumentos del volumen medio plaquetario o ambos. Sus cifras de referencia oscilan para hombres y mujeres de 0,1 a 0,4 %.11,17
- Índice distribución plaquetario (IDP) o ancho de la distribución del volumen plaquetario. (PDW): se calcula a partir de la curva de distribución de volumen de las plaquetas (fig. 2) y refleja el grado de variación morfológica de las plaquetas. Sus valores de referencia para hombres y mujeres oscilan de 0 a 18.11,17
- Componente medio plaquetario o concentración media de plaquetas (CPM): es un indicador del grado de activación plaquetaria y una variable clínica útil en el estudio y seguimiento de pacientes con riesgo de trombosis (dialisados, diabéticos, fumadores, angina inestable, mujeres embarazadas), ya que la activación plaquetaria esta implicada en esta enfermedad (tabla 3).17,19,20
- Plaquetas reticuladas (PR): las PR son las más jóvenes de la sangre periférica con un contenido de ARN superior a las demás. Son detectadas mediante la aplicación del método inmunológico. Las plaquetas se tiñen con ARN fluorescente (auramina O) y la intensidad de fluorescencia determina el contenido del ARN de la plaqueta. El porcentaje normal de PR es de 0,98 ± 0,41 %, según autores.17,20,21
El recuento absoluto aumenta en pacientes con trombocitosis por hiperproducción (PTI) y en las trombocitosis autónomas no reactivas (trombocitemia esencial y leucemia mieloide crónica), y disminuye en las enfermedades que cursan con trombocitopenias secundarias a hipoproducción (causada por quimioterapia o en la anemia aplástica), lo que aporta información sobre la trombopoyesis medular (tabla 3).17,20,21
Se ha detectado un aumento de PR y de las plaquetas grandes en la trombocitopenia inmune crónica, lo que se correlaciona positivamente con los anticuerpos antiplaquetarios y también con la recuperación hematopoyética precoz postrasplante de progenitores hematopoyéticos (tabla 3).11,17,21
LOGROS Y OBSTÁCULOS EN EL RECUENTO DIFERENCIAL AUTOMATIZADO
Mediante la combinación de los principios de medición habituales (variación de la impedancia y dispersión de la luz) con la radiofrecuencia, la citoquímica y el análisis de núcleos previa lisis leucocitaria, los analizadores hematológicos actuales son capaces de realizar el conteo global de leucocitos y ofrecer cifras absolutas y porcentuales de las distintas variedades leucocitarias: linfocitos, neutrófilos, eosinófilos, monocitos y basófilos. También muestran gráficamente citogramas e histogramas de distribución de volumen relacionado con otras propiedades celulares como la actividad peroxidasa y el número de integrantes de cada subpoblación celular, respectivamente.
La incorporación de las técnicas inmunológicas y la citometría de flujo ha posibilitado, además, contar, clasificar y avisar sobre la existencia de células anormales e inmaduras en sangre periférica, médula ósea y otros líquidos biológicos.4,10,11
Para la cuantificación de granulocitos inmaduros (metamielocitos, mielocitos y promielocitos) se han utilizado diversos marcadores monoclonales como el CD16 (FcgRIII) que se expresa en los neutrófilos maduros, CD11b (CR3) expresado solo en neutrófilos inmaduros y el CD64 (FcgRI), expresado en neutrófilos estimulados. La expresión de estos marcadores no siempre se corresponde con los cambios morfológicos que se esperarían encontrar durante la observación microscópica del frotis teñido; además, existen diversas situaciones en las que los granulocitos muestran una expresión anómala de estos marcadores (síndromes mielodisplásicos). Esto dificulta su implantación en los analizadores y la solución parece pasar por la combinación de varios de ellos, lo que encarecería mucho su uso para utilizarlos de forma rutinaria.4,22,23
Algo similar ocurre con los blastos, en los que no existe un marcador único para su identificación, que hace necesaria la combinación de varios de ellos según la enfermedad de que se trate. Diversos trabajos demuestran la utilidad del CD45 para poder separar los blastos de los linfocitos en la zona de baja granularidad celular, debido a la alta expresión de este marcador en estos últimos, pero son necesarias diversas combinaciones de anticuerpos monoclonales para su correcta cuantificación.10,22
La cuantificación de poblaciones linfocitarias es una realidad. En la actualidad, es posible el recuento de CD3/CD4/CD8 en un analizador hematológico. Existen métodos de citometría de flujo que con la utilización de distintas combinaciones de anticuerpos monoclonales son capaces de identificar hasta 9 poblaciones linfocitarias y que, en teoría, podrían utilizarse en los analizadores hematológicos. Lo que parece claro es que la cuantificación de estas poblaciones patológicas requiere necesariamente de la combinación de la citometría de flujo con los principios de detección habituales y por esta razón, se debe trabajar para que en el futuro próximo todos los analizadores hematológicos incorporen este principio de detección.4,10,23
CONSIDERACIONES FINALES
La hematimetría automatizada llevada a cabo por los analizadores hematológicos contribuye de un de modo rápido, preciso y relativamente barato, a poner en manos de los médicos un número cada vez mayor de parámetros destinados a ofrecer una orientación diagnóstica y pronóstica más fiable y en el menor tiempo posible.
La combinación de las técnicas automáticas de impedancia, óptica e inmunológica aplicadas al hemograma, han posibilitado la incorporación de nuevos parámetros en la caracterización de las series celulares hematopoyéticas, lo que da lugar a toda una generación de hemogramas que incluye desde los más simples, hasta los que hoy ofrecen los más novedosos parámetros. El desarrollo tecnológico en el campo de la hematología, la inmunología y la terapia transfusional cobra hoy más fuerza que nunca y tendrá inevitablemente que ser enfrentado por todos los profesionales, quienes tienen la responsabilidad de prepararse para ello. En particular, los hematólogos e inmunólogos deberán conocer la contribución desde el punto de vista diagnóstico, pronóstico y terapéutico de las variables aportadas por los actuales contadores hematológicos, lo que contribuirá a eliminar muchas peticiones de análisis innecesarias, facilitará el diagnóstico diferencial, la orientación de pruebas diagnósticas realmente necesarias para el paciente y reducirá significativamente el costo económico.
REFERENCIAS BIBLIOGRÁFICAS
1. Cruz-Rodríguez C. Automatización del laboratorio clínico. En: Suardíaz JH, Cruz CL, Colina AJ. Laboratorio Clínico. La Habana: Ciencias Médicas; 2004. p. 56-9.
2. González de Buitrago JM. Tecnología y métodos de laboratorio clínico. 3a ed. Barcelona: Elsevier Masson; 2010.
3. Bentahar A, Izasa SA. Nuevas aplicaciones clínicas en los analizadores hematológicos de la serie LH. Haematologica (ed. española). 2006;91(Suppl 1):146-9.
4. Villlarrubia J. Avances en el diferencial leucocitario automatizado. Criterios para la revisión del hemograma y sistemas expertos de validación automática. Haematologica (edición española) 2002 Oct;87(supl 1):138-42.
5. Lewis SM, Bain J, Bates I ed. Dacie and lewis: Practical Haematology. 10th ed. Philadelphia: Churchill Livingston Elsevier; 2006.
6. Juo JM. Análisis automatizado de las poblaciones eritrocitarias: su aplicación en el diagnóstico de las anemias. Haematologica (ed. española). 2002 Oct;87(supl 1):120-34.
7. Orfao A, Ruiz A. Citometría de flujo y su aplicación en Hematología. En: López Borrasca A, ed. Enciclopedia Iberoamericana de Hematología I. Salamanca: Ediciones Universidad de Salamanca; 1992. p. 161-75.
8. Barrera-Ramírez LM, Drago-Serrano ME, Pérez-Ramos J, Zamora AC, Gómez-Arroyo F, Saínz-Espuñes TR, et al. Citometría de flujo: Vínculo entre la investigación básica y la aplicación clínica. Rev Inst Nac Enf Resp. 2004 Ene-Mar;17(1):42-55.
9. Kratz A. Flow cytometry based analysis in the routine haematology laboratory. Haematologica (ed. española). 2006;91(supl 1):144-6.
10. Lacombe F, Robert M, Vériac S, Lefevre D, Belloc F. Leukocyte differential staining using thiazole orange and flo cytometry analysis. Application to a new 5-population cell analyser. Haematologica (ed. española). 2006;91(supl 1):143-4.
11. Campuzano-Maya G. Del hemograma manual al hemograma de cuarta generación. Medicina & Laboratorio. 2007;13(11-12):511-50.
12. Almaguer-Gaona C. Interpretación clínica de la biometría hemática. Medicina Universitaria. 2003;5(18):35-40.
13. D'Onofrio G, Zini G, Ricerca BM. Automated measurement of red blood cell microcytosis and hypochromia in iron deficiency and b-thalasemia trait. Arch Pathol Lab Med. 1992 Jan;116(1):84-9.
14. Bessman JD, Gilmer PR, Gardner FH. Improved clasification of anemias by MCV and RDW. Am J Clin Pathol. 1983;80:322-9.
15. Mohandas N, Kim YR, Tycko DH, Wyatt J, Groner W. Accurate and independent measurement of volume and hemoglobin concentration of individual red cells by laser light scattering. Blood. 1986 Ago;68(2):506-13.
16. D'Onofrio G, Zini G. Clinical applications of new reticulocyte parameters. Haematologica (ed. española). 2002 Oct;87(supl 1):134-8.
17. Molero-Labarta T, Lemes-Castellano A, de la Iglesia-Iñigo S, Santana-Rodríguez A. Nuevos índices plaquetarios: valor en el diagnóstico y trascendencia en las decisiones terapéuticas. Haematologica (ed. española). 2002 Oct;87(supl 1):115-20.
18. O'Malley T, Ludlam CA, Fox KA, Elton RA. Measurement of platelet volume sing a variety of different anticoagulant and antiplatelet mixtures. Blood Coagul Fibrinolyisis. 1996 Jun;7(4):431-6.
19. Jaremo P, Sandberg-Gertzen H. Platelet density and size in inflammatory bowel disease. Thromb Haemost. 1996;77(1):218-9.
20. Hinzmann R. The clinical utility of the quantification of immature platelets. Haematologica (ed. española). 2006;91(supl 1):149-53.
21. Takubo T, Yamane T, Hino M, Ohta K, Koh KR, Tatsumi N. Clinical significance of simultaneous measurement of reticulated platelets and large platelets in idiopathic thrombocytopenic purpura. Haematologia. 2000;30(3):183-92.
22. Molero-Labarta T, Lemes-Castellano A, de la Iglesia-Iñigo S. Extensión de las aptitudes analíticas del Cell-DYN SAPPHIRE mediante el uso de marcadores linfoides. Haematologica (ed. española). 2006;91(supl 1):139-42.
23. Fujimoto H, Sakata T, Hamaguchi Y, Shiga S, Tohyama K, Ichiyama S, et al. Flow cytometric method for enumeration and classification of reactive immature granulocyte populations. Cytometry. 2000;42:371-8.
Recibido: 1 de noviembre de 2012.
Aprobado: 20 de noviembre de 2012.
Lic. Láser Humberto Hernández-Reyes. Instituto de Hematología e Inmunología. Apartado 8070, CP 10800. La Habana, Cuba. Tel (537) 643 8695, 8268, Fax (537) 644 2334. Correo electrónico: rchematologia@infomed.sld.cu
Website: http://www.sld.cu/sitios/ihi