Introducción
Los anticuerpos (Ac) irregulares son aquellos que aparecen como consecuencia de la exposición previa a antígenos (Ag) que son desconocidos por el sistema inmunológico de un individuo. Su importancia clínica radica en la capacidad de generar algún tipo de reacción adversa y se estima que más del 30 % de los pacientes que reciben múltiples transfusiones de sangre generan Ac clínicamente significativos, debido a que estos causan reacciones de tipo hemolítica;1
Según el informe Español de Hemovigilancia del año 2015, se notificaron 47 reacciones adversas, asociadas a la transfusión, de las cuales 44 fueron reacciones hemolíticas de tipo inmune.2
Los anticuerpos identificados con mayor frecuencia en pacientes transfundidos son los generados contra los Ag D y Kell, debido a su mayor grado de inmunogenicidad. En estudio realizado por Flórez y otros, en Colombia, se identificó que la prevalencia de Ac irregulares en donantes de un banco de sangre de Antioquia fue 0,03 %, obteniendo una mayor frecuencia de anti-D con 0,071 %.3 Igualmente la investigación de Zaman y otros, realizada en la India, reportó que los Ac asociados con mayor frecuencia a las aloinmunizaciones fueron anti-D con 16 % y anti-K con 4,5 %.4 Otro trabajo hecho en Asia Occidental por Ameen y otros, determinó que los Ac irregulares con mayor prevalencia en la población kuwaití son anti-D, seguido de anti-E y anti-K con un 27,3 %, 18,5 % y 15,6 %, respectivamente.5
Sin embargo, se han identificado otros Ac dirigidos contra Ag menos inmunogénicos como Kidd, Duffy, Lewis y MNS.1 Cabe mencionar además, que la incidencia de los aloanticuerpos por transfusión sanguínea se encuentra entre 1 y 1,5 %, siendo más alta en pacientes politransfundidos (8 - 76 %) y mujeres multíparas.4 En este contexto es importante realizar una descripción de la literatura acerca de los mecanismos por los cuales el sistema inmunológico genera los Ac o inmunoglobulinas para producir una respuesta inmunológica específica dependiendo de la estimulación por parte del antígeno. De igual manera, es significativo ampliar la información sobre la presencia de los Ac irregulares en los donantes, ya que esto depende de diferentes factores como el sexo, dado que las mujeres con múltiples gestaciones están más propensas a desarrollar Ac irregulares; al igual que la población de color de piel negra, pues se identificó que el sistema Duffy, se presenta más comúnmente en esta población.6 Por otro lado, esta revisión sirve como como referente para estudios posteriores y actualización del conocimiento para otros investigadores.
Este trabajo tiene como objetivo describir la genética, estructura y función de los anticuerpos irregulares en los donantes de sangre.
Métodos
La revisión bibliográfica se realizó a través de la búsqueda de información en bases de datos como Pubmed, ScienceDirect, NCBI, Redalyc, SciElo, Elsevier y Scopus. Se utilizaron palabras claves como: donantes, sanguíneos, diversidad, anticuerpos, inmunoglobulinas, transfusión, las cuales fueron validadas a través de DeCs (Descriptores en Ciencias de la Salud). Para la búsqueda de los artículos se realizó combinación de palabras claves utilizando los conectores “AND” y “OR”. Los criterios de selección de la literatura fueron: artículos publicados durante los últimos 10 años en los idiomas inglés y español. Se excluyeron artículos que no contaban con la información necesaria para formar parte de esta revisión.
Análisis y síntesis de la información
Anticuerpos
Los anticuerpos también conocidos como inmunoglobulinas (Ig) son proteínas producidas por las células plasmáticas (derivadas de linfocitos B activados) mediante la estimulación de un antígeno, es decir, el organismo genera un Ac diferente o específico para cada Ag. Cuando se produce la unión entre Ag-Ac, en el anticuerpo, se activan otras funciones biológicas como: la activación del sistema de complemento, en el proceso de opsonización, paso transplacentario y en la unión a las células fagocitarias, inflamatorias, etc.; esto como un mecanismo de defensa, que tiene como fin impedir que se genere algún tipo daño en el organismo.7
Existen cinco tipos de inmunoglobulinas la IgA, IgD, IgE, IgG e IgM,8 siendo las dos últimas, generalmente los tipos de Ac de los sistemas sanguíneos que se producen contra los Ag eritrocitarios; la IgM e IgG se produce contra los Ag eritrocitarios del sistema sanguíneo ABO y otros Ag no ABO que por su incompatibilidad generan su producción.9
Anticuerpos irregulares
Los anticuerpos irregulares son diferentes a los Ac naturales del sistema sanguíneo mayor ABO, que surgen como consecuencia de la exposición a Ag eritrocitarios en las transfusiones de sangre o durante el embarazo. Estos Ac son proteínas que reaccionan contra Ag específicos, son poco comunes y producen incompatibilidad sanguínea entre los donantes y receptores, debido a su capacidad de acortar la vida media de los eritrocitos, causando hemólisis o ayudando como opsoninas para la activación del sistema de complemento.3
Genética de los anticuerpos irregulares
Las inmunoglobulinas (Igs) están constituidas por cuatro cadenas polipeptídicas, un par de cadenas ligeras (L) y dos cadenas pesadas (H) de mayor tamaño; ambas constan de regiones tanto variables (V) como constantes (C) y son codificadas mediante tres genes localizados en distintos cromosomas. El gen de la cadena pesada ubicado en el cromosoma 14 (14q32) y los genes Kappa (k) y lambda (λ) de la cadena ligera situados en los cromosomas 2 (2p12) y 22 (22q11), respectivamente. Cada locus de Ig de la línea germinal está conformada como mínimo por tres tipos distintos de segmentos génicos: el variable (V), el constante (C) y de unión (J- joining) y adicional a estos, el locus de la cadena pesada de Inmunoglobulina (IgH) posee segmentos génicos de diversidad (D).10
La generación de diversidad de producción de Ac se lleva a cabo principalmente a través del reordenamiento somático que une varios genes V, (D) y J de la línea germinal para conformar genes funcionales responsables de la codificación de las Igs y mutaciones somáticas (región V). Una de las causas genéticas de la diversidad es la variación en el número y la composición de genes por la presencia o la ausencia de los mismos en los distintos haplotipos, pues se considera que estos en ninguna persona en la población humana tienen el mismo conjunto de genes IGHV.11 De igual forma, la introducción o eliminación nucleótidos P y N en las uniones V (D) J y el emparejamiento de las distintas cadenas pesadas y ligeras aumentan la diversidad.10
Reordenamiento de los segmentos génicos
A lo largo del proceso de maduración de los linfocitos B (LB), se genera un reagrupamiento de segmentos de genes para dar inicio a la síntesis de las cadenas H y L, que se conoce con el nombre de diversificación primaria de las Igs o recombinación intracromosómica. La información que codifica una Ig se encuentra distribuida de forma discontinua a lo largo de una cadena de ADN en las regiones llamados exones o codificadores separados por otros denominados intrones o no codificadores.12
La región variable (V) de la cadena L, es codificada por dos genes diferentes, el primero llamado gen VL y el segundo gen denominado JL, cuando se genera la unión entre VL-JL, este fragmento permanece separado de la región CL por un una secuencia no codificante (intrón), siendo esta configuración la que posteriormente se va a transcribir a RNAm, una vez se lleva a cabo la transcripción, el intrón es eliminado mediante un proceso de corte y unión del RNAm, para generar la cadena ligera completa. Por otra parte, el dominio V de la cadena H es expresado por tres genes diferentes denominados VH, DH y JH y el proceso de recombinación somática que produce el dominio VH consta de dos etapas, en la primera se genera la unión del gen DH con el JH y después la fracción DH-JH se asociará con el gen VH, para originar el exón completo que codifica el dominio VH, de igual manera que para la cadena L, la unión de la región VH con CH se genera por el corte y la unión del RNAm.13
A su vez, el proceso de recombinación somática es dirigido por secuencias conservadas de DNA no codificantes denominadas secuencias de señales de recombinación (SSR), que se encargan de asegurar el ensamblado correcto de los diferentes segmentos génicos, de tal manera que la unión del fragmento V sea con uno D o J, pero que nunca ocurra con otro V, por tal razón la recombinación solo se lleva a cabo entre segmentos de genes que se localizan en un mismo cromosoma. Es así, que la recombinación de los segmentos V (D) J es iniciada por dos proteínas denominadas recombinasas RAG1 y RAG2, que son específicas de los linfocitos y que tienen como función reconocer y cortar en doble cadena las SSR para señalar los segmentos génicos que participan en este proceso.14
Las secuencias de señales de recombinación están constituidas por una secuencia de siete nucleótidos conservados denominada heptámetro y luego otra de nueve nucleótidos llamados nonámero rico en A y T, entre las cuales se encuentran espaciadores (12-24 pb) que las separan. Para dar inicio al proceso de recombinación, como primer paso las RAG1/2 con la ayuda de la proteína HGM1/2, identifican y se unen a las SSR, cortando entre el heptámetro y la secuencia que es codificante, formando una estructura conocida como horquilla en el cromosoma a un lado de los extremos codificantes para proteger el DNA, luego la proteína cinasa dependiente de DNA (DNA-PK) identifica el corte de la doble cadena, se une al DNA y fosforila a la proteína Artemis, la cual abre la estructura de horquilla, para que posteriormente la proteína XRCC4 (de reparación de DNA) con ayuda de la ligasa IV de ADN, faciliten la unión de los segmentos que son codificantes y de los extremos de señalización y por último, la proteína deoxinucleotidiltransferasa terminal (TDT) incrementa la diversidad en los puntos de unión de estos segmentos V (D) J (Fig. 1).15
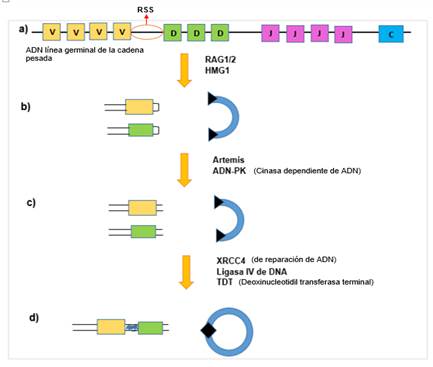 Fuente: Rendón M, Alagón A. Mecanismos Moleculares de Diversificación de Inmunoglobulinas. 2008.; 27(1):19-29
Fuente: Rendón M, Alagón A. Mecanismos Moleculares de Diversificación de Inmunoglobulinas. 2008.; 27(1):19-29Fig. 1 Recombinación V, D y J.
a) Organización de los segmentos génicos de línea germinal. b) Formación de los extremos con estructura de horquilla sellada en los segmentos codificantes. El DNA que separa los segmentos involucrados en la recombinación se separa del cromosoma, manteniendo las secuencias de señalización fosforiladas en los extremos (triángulos negros). c) Apertura de los extremos en horquilla de los segmentos codificantes. d) Unión de los segmentos codificantes y de los extremos de señalización.
Hipermutación somática
Es un proceso que solo ocurre en los genes variables de la Igs y genera una gran diversificación de las mismas; inicia con una enzima llamada desaminasa inducida por activación (AID) que causa la desaminación selectiva los residuos de desoxicitidina en la molécula de DNA para transformarlos en residuos de uracilo, estas modificaciones producidas por la AID son las que proporcionan una diversidad de cambios en las bases en el DNA de los dominios variables de sus cadenas pesadas (IGHV). Este proceso finalmente aumenta la afinidad y la especificidad del anticuerpo para unirse al antígeno.16
Estructura de los anticuerpos
Los anticuerpos tienen una unidad básica o común (monómero) esquematizada como una letra Y (Fig. 2) 7) que consta de cuatro cadenas polipeptídicas, un par de cadenas pesadas idénticas y dos cadenas ligeras iguales nombradas con las letras H (heavy) y L (light), respectivamente, unidas mediante enlaces disulfuro y otras uniones no covalentes. A su vez, las cadenas H se unen entre sí por al menos un enlace disulfuro, tal ensamblaje se ubica en una zona la denominada “bisagra”, que le confiere flexibilidad a la Ig o anticuerpo. Por otra parte, las cadenas L están compuestas por un dominio variable (VL) y uno constante (CL), en cambio las cadenas H están constituidas por una región variable (VH) y tres constantes (CH1, CH2, CH3). En las regiones variables el orden de los aminoácidos es diferentes de un Ig a otra, mientras que en los dominios constantes la secuencia aminoacídica se conserva entre las Igs.17 Las regiones variables y el primer dominio constante de las cadenas H (VH-CH1) se asociación con las cadenas L (VL- CL) confiriendo dos lugares idénticos conocidos como fragmentos Fab en los que se puede unir los antígenos, además posee regiones de complementariedad (CDR) lo que le proporciona la especificidad. Por otra parte, las regiones CH2 y CH3 constituyen la zona Fc, fragmento que realiza diferentes funciones, entre las cuales se encuentran opsonización, transporte placentario, etcétera.
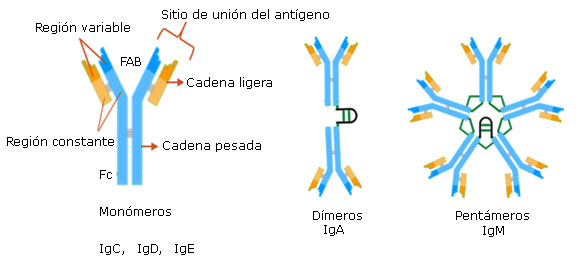 Fuente: Sinclair J. Inmunoglobulinas Lifeder. (acceso:13/05/2021). Disponible en: https://www.lifeder.com/inmunoglobulinas/
Fuente: Sinclair J. Inmunoglobulinas Lifeder. (acceso:13/05/2021). Disponible en: https://www.lifeder.com/inmunoglobulinas/
Fig. 2 Representación esquemática de la estructura de las inmunoglobulinas.
Funciones de los anticuerpos
Las funciones de los Ac están determinadas por la clase de Ig que actúa según la dinámica de la respuesta inmune como se aprecia en la tabla 1.
Tabla 1 Funciones de los anticuerpos
| INMUNOGLOBULINAS | FUNCIÓN |
| Representa el 15 % de las inmunoglobulinas séricas y su mayor concentración predomina en secreciones como la saliva, lagrimas, leche, mucosa del árbol bronquial y tracto digestivo en forma dimérica, no fija el complemento, ni es opsonina, pero es de gran importancia al impedir el ingreso de agentes patógenos al organismo;18 ejerce su acción protectora en los epitelios de barrera, evitando que los microorganismos se unan a los receptores de las células epiteliales para iniciar la invasión, dado que interactúa con las moléculas de la superficie de los microorganismos mediante la unión epítopo/anticuerpo.19 | |
| Inmunoglobulina D | Estos Ac son poco abundantes en sangre y se encuentra principalmente en la superficie de la membrana de los linfocitos B (LB) maduros.20 Esta molécula facilita el inicio de la respuesta inmunología induciendo la producción Ac y la diferenciación de los LB a células de memoria.21 |
| Inmunoglobulina E | Se encuentra en pequeñas cantidades en la circulación sanguínea y no tiene paso transplacentario, sin embargo, tiene un papel importante en los procesos de alergénicos. Además, su nivel en sangre aumenta cuando se presentan parasitosis, especialmente producidas por helmintos.18 La unión entre antígeno- IgE, genera la liberación de sustancias que participan en el proceso de la inflamación y alergia. Por otro lado, se puede unir a receptores presentes en las membranas eosinófilos y plaquetas, lo que le permite funcionar como receptor del antígeno (alérgeno).22 |
| Inmunoglobulina G | Esta molécula es la más abundante en circulación y es la que más aumenta durante una respuesta inmunológica secundaria,23activa el complemento, facilita la fagocitosis y neutraliza patógenos como virus, bacterias, parásitos y hongos; a su vez, se une a un gran número de células (macrófagos, plaquetas, entre otros) con el propósito de activarlas; así mismo, la IgG es la única que puede atravesar la placenta confiriendo protección al niño desde que nace hasta los primeros meses de vida.7 |
| Inmunoglobulina M | Es la primera inmunoglobulina que se expresada en la superficie del LB y que aparece en la respuesta inmunológica primaria, su nivel elevado en sangre es indicativo de infección activa.24 Es la Ig más grande, dado que su estructura es un pentámero, es decir, posee diez sitios mediante los cuales se puede unir al antígeno y es la principal activadora del sistema de complemento.25 |
Anticuerpos de los grupos sanguíneos
Sistema Rh
El sistema Rh debido a su polimorfismo y su capacidad inmunogénica se ubica en la segunda posición de relevancia clínica en procesos relacionados con la transfusión sanguínea y la enfermedad hemolítica perinatal (EHPN); está constituido por 61 antígenos,26 de las cuales lo más importantes son D, C, c, E y e; estos se sitúan en dos proteínas que se encuentran en la membrana eritrocitaria, la RhD (CD240D) que codifica para el antígeno D y la RhCE (CD240CE) que expresa los Ag C, c, E y e.27 Los Ac del sistema Rh son de clase IgG, primordialmente de la subclase IgG1 e IgG3 y su presencia se debe a la exposición previa a células incompatibles o durante la gestación.26 En estudio realizado en México por Terrazas y otros, se determinó que los Ac irregulares más comunes son anti-D y anti-E. En otro estudio realizado en Colombia, determinó una prevalencia de anti-D de 20,83 %.28,29
Sistema Kell
Este sistema sanguíneo está conformado por 36 antígenos, los de mayor importancia clínica son Kell (K) y cellano (k), se desarrollan totalmente antes del nacimiento y se ubican en la membrana de los hematíes; estos Ag son altamente inmunógenos, ocupando el tercer puesto de relevancia clínica después del antígeno D, por su capacidad para producir reacciones inmunes como postransfusionales y EHPN.30 En cuanto al antígeno K, se presenta en la población caucásica en un 9 % y en menor porcentaje en la afroamericana con 2 %.31 Respecto a los Ac de este sistema generalmente son de tipo IgG, lo que les permite atravesar la membrana placentaria y en menor frecuencia de clase IgM.32 En un estudio realizado en Turquía, se identificó que dentro de los aloanticuerpos con mayor prevalencia se encontró el anti-k con 21,9 %, en receptores de transfusiones sanguíneas.33
Sistema MNS
El sistema MNS está constituido por 46 antígenos, siendo los más frecuentes M, N, S y s, que se encuentran principalmente en los eritrocitos y en el endotelio del riñón; estos Ag son expresados por los genes GYPA y GYPB, localizados en el cromosoma 4.34 Los Ac del sistema MNS generalmente son de tipo IgM, pero pueden ser clase IgG. Gran parte de los Ac anti-M son de origen natural, no se unen al complemento y por tanto rara vez causa reacciones hemolíticas postransfusionales o EHPN; de igual manera, el Ac anti-N es mucho más raro encontrarlo (en comparación con anti-M).35 Sin embargo, en la literatura se han notificados casos de anti-M y anti-N inmunes, como resultado de transfusiones sanguíneas lo que genera reacciones transfusionales de tipo hemolíticas y enfermedad leve del feto y recién nacido.36 Asimismo, anti- S y anti-s son de clase IgG, que aparecen después una inmunización eritrocitaria por transfusiones o gestaciones previas y se asocian con EHPN y reacciones postransfusionales tardías. En investigación realizada en Córdoba, Colombia, en la cual se determinó que el anticuerpo irregular más común es anti-M con un 27,78 %.29
Sistema Kidd
La glicoproteína Kidd, es la responsable del transporte de la urea en los hematíes y el riñón, en este último promueve la concentración de la urea en la orina. Está conformado por dos antígenos: Jka o Jk y Jkb o Jk, estos Ag son heredados como los productos de alelos codominantes y su expresión se determina por un polimorfismo de un nucleótido dentro del gen SLC14A1 (Gen HUT 11 cromosoma 8) que le confiere una única diferencia de aminoácidos entre los alelos, es decir, Jkb tiene una adenina en el nucleótido 838 que produce el cambio del aminoácido asparaginina 280 y Jka un nucleótido de guanina genera el cambio a un aspartato en esa misma posición. Estos dos Ag son responsables de los 4 fenotipos: Jk (a+b-), Jk (a-b+), Jk (a+b+), Jk (a-b-).37 Los Ac anti-Jka y anti-Jkb son de tipo IgG que pueden generar reacciones hemolíticas tardías, ya que no son detectables por su tendencia a disminuir sus niveles en plasma, sin embargo, la memoria inmunológica se mantiene.38
Sistema Duffy
En este grupo sanguíneo hay dos Ag principales Fy (a) y Fy (b) expresados en las membrana eritrocitaria, células epiteliales de órganos como pulmón, bazo, corazón, riñón, entre otros, que determinan los tres fenotipos más frecuentes en la población caucásica que son Fy (a+b-), Fy (a-b+) y Fy (a+b+) y el fenotipo Fy (a-b-) más común en personas de población negra (hasta 75 %),39 en esta última población se tiene mayor probabilidad de aloinmunización, como resultado de una incompatibilidad con las unidades de glóbulos rojos en su totalidad, lo que puede incrementar el riesgo de que se presenten complicaciones. En cuanto a los anti-Fya y -Fyb se generan después de transfusiones y rara vez por embarazos, siendo considerados moderadamente inmunológicos, dado que pueden causar reacciones hemolíticas transfusionales (RHT) inmediatas o tardías, pese a que generalmente son leves, algunas han resultado fatales por ser generalmente tipo IgG. 40) En México de 71 anticuerpos irregulares identificados en 66 pacientes, se identificó una prevalencia de 9 % para anti-Fya4, siendo 20 veces más inmunogénico que anti-Fyb y mayormente detectado. 41) Asimismo, anti-Fy3 tiene relevancia clínica pues puede reaccionar con glóbulos rojos Fya y Fyb, razón por la cual se asocia con reacciones de tipo hemolíticas, surge en individuos con fenotipo Fy (a-b-).42
Sistema Lewis
Está constituido por dos alelos conocidos como Le, que generan la formación de los Ag Lea y Leb, que no se encuentran en la membrana de los glóbulos, sino que son absorbidos del plasma, dado que al ser estructuras de carbohidratos son transportadas por glicoproteínas; estos Ag que constituyen 4 fenotipos Le (a+b+), Le (a+b-), Le (a-b+) y Le (a-b-). Los Ac de este grupo sanguíneo, anti-Lea y Leb son Ac naturales de tipo IgM y están poco relacionados con reacciones hemolíticas postransfusionales, su presencia está asociada a gestantes con el fenotipo Le (a-b-) que producen Ac anti-Lea y anti-Leb, los cuales pueden causar hemolisis mediada por el sistema de complemento. 43) Radonjic y otros, realizaron estudio en 3310 gestantes, encontrando un frecuencia de 0,1 % de Ac anti-Lewis y la presencia del fenotipo Le(a-b-) en 260 mujeres embarazadas, lo que concuerda con lo anteriormente mencionado.44
Anticuerpos irregulares en donantes
Los anticuerpos de glóbulos rojos anti-A y anti-B, son denominados Ac naturales, debido a que se encuentran en el suero humano sin causar reacciones inmunológicas por ser producidos contra Ag diferentes a los presente en los glóbulos rojos del individuo que los produce; mientras que los todos los demás Ac se conocen como “aloanticuerpos eritrocitarios irregulares” y se distinguen dos tipos: aloanticuerpos y autoanticuerpos,45 dado que aparecen cuando hay una respuesta inmunológica en individuos que han tenido una exposición previa a Ag eritrocitarios externos o diferentes al sistema ABO, por su parte los autoanticuerpos reaccionan de manera anormal a los Ag propios del individuo, especialmente en patología de tipo autoinmune como la anemia hemolítica autoinmune.46
Desde el año 1980, la Sociedad Internacional de la Transfusión, mediante diferentes acuerdos internacionales, ha agrupado los distintos Ag eritrocitarios en sistemas, de los cuales actualmente se conocen 36 sistemas y todos poseen alguna importancia tanto en las funciones del glóbulo rojo como en las transfusiones de sangre.47 Los Ac de los grupos de los sistemas sanguíneos con importancia clínica generalmente son de clase IgM e IgG, debido a que pueden generar dos tipos de reacciones adversas a la transfusión: la hemólisis intravascular y extravascular, que a su vez, se pueden clasificar en agudas o inmediatas y tardías, aunque no necesariamente son fatales pueden causar una morbilidad importante, dado que comprometer la estabilidad del paciente.48
Según diversas investigaciones realizadas, como se observa en la tabla 2, existe una heterogeneidad en las prevalencias de los aloanticuerpos, debido a ciertas condiciones como el estado inmunológico o enfermedad de base del receptor, factores relacionados con el donante como los tipos de Ag y su inmunogenicidad, o factores relacionados con la unidad, tiempo desde la captación hasta la trasfusión, impidiendo así la extrapolación de otros estudios a ámbitos locales; evidenciando así la necesidad de conocer acerca de la demanda de donaciones propias y la variación poblacional de los Acs irregulares.49
Tabla 2 Estudios de prevalencia de anticuerpos (Ac) eritrocitarios irregulares
| Año | Referencia | País | Número de Donantes | Ac más prevalentes (%) |
|---|---|---|---|---|
| 2015 | Peralta y otros50 | Nicaragua | 85 |
- Anti-D (42,4) - Anti-E (15,2) - Anti-K (10,5) - Anti- C (6) - Anti- M (5) |
| 2018 | Makroo y otros45 | India | 227 |
- Anti-M (56,57) - Anti- D (27,63) - Anti-Jka(3,94) - Anti-P1 (2,63) - Anti-Leb(1,31) |
| 2019 | Ulloa y otros51 | Ecuador | 587 |
- Anti- D - Anti-E - Anti- Fy - Anti- Jk - Anti-K |
| 2019 | Rolon y otros29 | Colombia | 71 |
- Anti-M (27,78) - Anti-Lea (20,83) - Anti-D (9,72) - Anti-E (8,33) |
| 2019 | Flórez y otros3 | Colombia | 75 |
- Anti-D (28) - Anti-E (9,33) - Anti-K (8) - Anti-M (5,3) |
La investigación realizada por Kahar y Patel en el año 2014, con el propósito de identificar las frecuencias fenotípicas de los sistemas sanguíneos Rh, Kell, Kidd, Duffy, MNS, P, Lewis y Lutheran en donantes de la India, mostró que para el sistema Rh los fenotipos más frecuentes son: antígeno e (100 % de los donantes), seguido por D (84,35 %) y C (81,74 %), c (56,32 %) y E (21,74 %); con DCe como el fenotipo más común. Para el sistema Kell, el antígeno k resultó positivo para el 100 % de la población en estudio y no se encontró ningún fenotipo K+k-, que aporte datos de frecuencia y prevalencia en la población estudiada. Para los grupos sanguíneos Kidd y Duffy, Jk (a+b+) y Fy (a-b-) fueron los fenotipos más frecuentes con 52,17 % y 48,69 %, respectivamente. Respecto al sistema sanguíneo MNS, se determinaron los fenotipos M+N+ (39,13 %), M+N- (37,39 %) y S-s+ (66,96 %) y para el grupo Lutheran, se encontró el fenotipo Lu (a-b-) poco común en el 2,61 % de los donantes. .(52)
Pruebas para identificación de anticuerpos irregulares
La mayoría de los anticuerpos irregulares son tipo IgG, por lo que para su identificación existen diferentes métodos, entre los que encontramos, la prueba de antiglobulina o Coombs que aunque es considerada “estándar de oro” y tener buena sensibilidad, un resultado negativo no descarta la presencia de anticuerpos, pues se han notificado casos de aloinmunizaciones en los que los Ac no se detectaron en el momento de la transfusión sanguínea, 53) debido a errores durante el procedimiento de esta prueba como lo son, un lavado inadecuado de los glóbulos rojos o un retraso en la adición de los reactivos y en la realización de la misma, puede dar como resultado falsos negativos.54
La otra técnica utilizada con frecuencia es la de aglutinación en tarjeta de gel que contiene un anticuerpo específico, NaCl o suero antiglobulina humana, en donde los glóbulos rojos sensibilizados reaccionan con el antisuero especifico, formando aglutinación en el gel que se puede observar macroscópicamente.55 Esta última técnica es más fácil, sensible y reproducible que la prueba de Coombs. Una de sus ventajas es que se puede utilizar para la determinación del grupo sanguíneo, identificación de Ac irregulares y pruebas de compatibilidad sanguíneas pretransfusionales, pues la reacción en gel puede mantenerse estable hasta las 24 horas.56
Los anticuerpos irregulares en donantes, siguen siendo un aspecto de importancia clínica, debido a su asociación con las reacciones postransfusionales que se pueden generar por la capacidad inmunogénica de los Ag de los diferentes sistemas de los grupos sanguíneos existentes en la actualidad, dando como resultado la estimulación del sistema inmunológico para la producción de Ac por la estimulación de estos antígenos. Es importante resaltar, que el sistema inmune produce de manera específica un anticuerpo para cada antígeno, esto se logra por la recombinación somática, a lo largo del proceso de maduración de células B y en cual interviene algunas enzimas que permiten llevar a cabo la recombinación de los segmentos génicos V (D) J para generar la diversidad de los anticuerpos. De igual manera, se determinó que los Ac irregulares más frecuentes a nivel mundial son anti- D, anti-E y anti-K, ocupando estos el segundo y tercer lugar de inmunogenicidad por ser de tipo IgG, capaces de producir reaccione hemolíticas postransfusionales y la EHPN; seguidos por el anticuerpo anti-M que aunque no está muy asociado con las reacciones adversas a la transfusión, en la literatura se han reportado reacciones de tipo hemolíticas y EHPN causadas por este anticuerpo, además es importante extender la tipificación de Ag poco comunes como Jka y Fy para evitar las aloinmunizaciones, dado que estos pueden aparecer meses después de las transfusiones sanguíneas.














