Introducción
El linfoma difuso de células B grandes (LDCGB) es un linfoma agresivo que representa del 25 al 30 % de los linfomas no Hodgkin a nivel mundial.1 En el Perú, representa la cuarta neoplasia más frecuente, con una incidencia de 35,8 % similar a la literatura mundial.2,3,4
El gen humano CD5 (CD5, abreviatura del inglés cluster of differentiation type 5) se encuentra en la región 1 del brazo largo del cromosoma 11 expresada en células T y B vírgenes normales.5
Las mutaciones somáticas en el gen CD5 son las encargadas de promover la tolerancia de células B a los antígenos autorreactivos y la regulación negativa de señalización del receptor de células B.5,6 Otro mecanismo es la sobrexpresión de interleuquinas 10, Bcl-2 (Bcl-2, abreviatura del inglés antiapoptotic B-cell leukemia/lymphoma 2), ciclina D2, y CXCR4 (C-X-C, abreviatura del inglés chemokine receptor type 4) que contribuirían a la inmortalización de las células tumorales. 6)
La mutación del gen CD5 es frecuente en neoplasias de células B maduras, como leucemia linfocítica crónica/linfoma linfocitico pequeño (LLC/LLP), linfoma de células del manto (LCM), síndrome de Richter (SR) y con menor frecuencia el linfoma de células B intravascular (LCBIV).5 Sin embargo, solo del 5 a 20 % de casos de LDCGB expresan CD5.6
El LDCGB CD5 positivo (LDCGB CD5+) se caracteriza por presentar un pronóstico adverso comparado con otros subtipos de LDCGB.6 Además, la recaída en glándula prostática es infrecuente (0.1 %), por lo que hace difícil su sospecha clínica y el diagnóstico diferencial.7
El objetivo de esta presentación de caso es describir el comportamiento clínico del LDCGB CD5+ con recurrencia inusual en próstata en un paciente peruano.
Presentación del caso
Paciente masculino de 61 años que presentó sintomatología de dolor abdominal, síntomas B (baja de peso, sudoración nocturna y fiebre) y estado funcional ECOG (Eastern Cooperative Oncology Group) de 2.8 Asociado a hemoglobina 9,6 g/dL (normal: 14-18 g/dL), lactato deshidrogenasa sérica (LDH) en 448 U/L (normal: 120-246 U/L), β2-microglobulina sérica en 2,78 mg/L (normal: 0,61-2,16 mg/L) y pruebas virales negativas.
Los exámenes de imágenes mostraron adenopatías infradiafragmáticas: precural (2,8 cm), periaórtica (4,5 cm), ilíaca primitiva izquierda (3,0 cm) e ilíaca externa izquierda (2,0 cm). El informe patológico mostró proliferación difusa de células linfoides atípicas (Fig, 1).
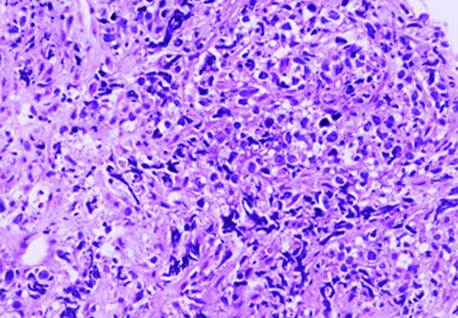
Fig. 1 Infiltración de células grandes de patrón centroblástico con focos de necrosis (hematoxifilina-eosina,20 X).
Las células atípicas expresaron positividad a CD20, MUM-1, CD5 y Ki67 alto (Fig. 2) y negatividad para CD3, ciclina D1, CD23 y pan-citoqueratina. Estos hallazgos concluyeron en el diagnóstico de LDCGB CD5+ estadio IIB con escala IPI (índice pronostico internacional) y NCCN-IPI (índice pronostico internacional de la NCNN, abreviatura del inglés National Comprehensive Cancer Network) de riesgo alto-intermedio.9,10
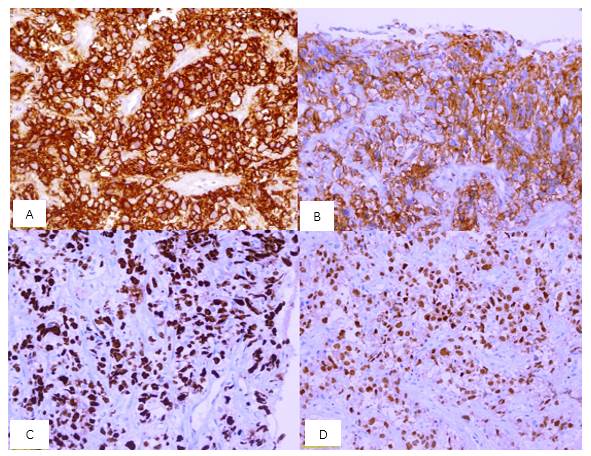
Fig. 2 Estudio inmunohistoquímico. A: CD20 difusamente positivo (20X); B: CD5 positivo en 50 % de células tumorales (20 X); C: Índice proliferativo (Ki 67) alto de hasta 90 % ; D: MUM positivo demostrando inmunofenotipo no centro germinal.
Inició tratamiento con esquema R-CHOP (rituximab, ciclofosfamida, doxorrubicina, vincristina y prednisona) cada 21 días por seis cciclos con remisión completa de enfermedad. Cuatro meses después, presento hematuria y anemia moderada (Hb: 10,6 g/dL). Las imágenes mostraron una lesión en región prostática y dos adenopatías ilíacas bilaterales cada una de 3 cm) y adenopatía paraórtica izquierda de 1.5 cm.
La biopsia transuretral de próstata confirmó una recidiva temprana (menor de 6 meses), por lo que inició terapia de rescate con R-ICE (rituximab, ifosfamida, carboplatino y etopósido) cada 21 días con intención de trasplante autólogo de progenitores hematopoyéticos. Luego de 3 ciclos de tratamiento la enfermedad progresó con deterioro clínico, por lo que no fue tributario de terapia sistémica y solo de tratamiento de radioterapia a título paliativo a dosis de 30 Gy por 10 sesiones. Posterior a ello, el paciente falleció por la progresión de la enfermedad.
Discusión
El LDCGB CD5 + tiene un curso agresivo y heterogéneo, con predilección del sexo femenino y adultos mayores. Se caracteriza por síntomas B, LDH elevada, IPI alto, compromiso extraganglionar, pobre estado funcional, infiltración al sistema nervioso central (SNC), infiltración de médula ósea y estadio avanzado.5,11,12,13,14
Es infrecuente el compromiso prostático primario o secundario, siendo esta última la más atípica como en nuestro caso. 15) El diagnóstico mediante técnicas de imagen estándar y biopsia prostática tienen una sensibilidad 22 %, siendo, el estudio de inmunohistoquímica esencial para diferenciarla de otras entidades no hematológicas prostáticas.16
Otra característica es la expresión de CD5, CD20 y BCL2 y negatividad para CD10, CD21 y CD23.5,11,17 La mayoría muestra expresión para MUM-1, ubicándolo como fenotipo no centro germinal (No-CG). Aquellos con expresión CD5+ y fenotipo No-CG tienen peor sobrevida global (SG) comparado con el fenotipo centro germinal (CG) o CD5 negativo.5,11,17,18,19
La sobreexpresión de ciclina D2, encontrado en 98 % de los pacientes con CD5+ le confiere peor pronóstico, así como la alta expresión de KI67.14,20 También la coexpresión de p53/CD5 está asociado a peor SG y sobrevida libre de progresión (SLP). 21) Otros estudios, revelaron que la coexpresión CD5/CD43 y BCL2/ MYC estuvieron relacionados con peor pronóstico y SLP respectivamente (p = 0,003).22,23
La patogénesis es desconocida, pero un estudio demostró que la expresión de CD5 induce la producción de IL-10 en las células B, contribuyendo a la expansión de células B malignas.24 Otra hipótesis, es el aumento de marcadores pro-angiogénicos como: el factor 1α inducible de hipoxia, CD34 y el factor de von Willebrand; quienes promueven la progresión neoplásica.25 Además, se postula que la coexpresión de BCL 2/ MYC podría desencadenar su desarrollo.23
Dada la expresión CD5+ en diversos linfomas no Hodgkin, hace necesaria su diferenciación histológica. El LCM, entidad poco común, que afecta principalmente a ancianos, con compromiso del tracto gastrointestinal (95 %) y está asociado a la translocación t (11; 14) (q13; q32) o expresión de ciclina D1 y en ciertos casos, cuando la ciclina D1 es negativa, el biomarcador SOX 11 (93 %) es altamente específico. 26,27) El SR, es la transformación de LLC a un linfoma agresivo (principalmente LDCGB) caracterizado por positividad de CD20, expresión de CD5 (30 %), CD23 (15 %) y fenotipo No-CG (90%-95 %).28
El linfoma de células B intravascular, es un tipo raro de linfoma extraganglionar microvascular caracterizado por fiebre de origen desconocido y deterioro del estado funcional (50 %), así como compromiso cutáneo (40 %) y SNC (35 %). La expresión de CD20 es característica, sumado al fenotipo No-CG (75 % - 80 %) y expresión de CD5 (22 % - 38 %).29 Finalmente, la LLC se caracteriza por la presencia de ≥ 5000 linfocitos B/μL en sangre periférica y la LLP por adenopatías, ausencia de citopenias, recuento de linfocitos B no superior a 5000 /Μl y positividad de CD5, CD19, CD20 y CD23 con poca frecuencia .(30)
El tratamiento es un desafío. La quimioinmunoterapia con R-CHOP ha tenido pobres resultados en la gran mayoría de estudios.5,11,17,31 Así, un estudio japonés demostró que la expresión CD5+ tenían peor SG con R-CHOP (45 % vs 91 %, p = 0,001).32 Otro estudio demostró que el uso de R-CHOP en el grupo CD5+ con respecto al CD5-, tuvo una mediana de SG de 25.3 meses versus no alcanzado (p < 0,01), respectivamente.12 Hallazgos confirmados en otros estudios. 31,33) Por otro lado, dos estudios revelaron que la adición de rituximab a CHOP no mejoró la SG y SLP. 33,34) Sin embargo, estudio indicó que su adición aumenta la PFS pero no la SG.35
Otro esquema estudiado, fue el R-EPOCH (Rituximab-Etopósido-Prednisona-Vincristina-Ciclofosfamida y Doxorrubicina). Un estudio retrospectivo encontró una peor SG en el grupo CD5+ que en el grupo CD5-(28 meses versus no alcanzado, p =0,006).14 Otro estudio demostró que el uso de R-EPOCH fue mejor en SLP que R-CHOP en pacientes CD5+ (85,7 % versus 23,0 %, p = 0,029), pero sin diferencia en SG (87,7 % versus 34,4 %, p = 0,064).36 Sin embargo, en estudio reciente con la cohorte más grande de LDCGB CD5+ no mostró diferencias entre los regímenes descritos.21 Por otro lado, la adición de metotrexato a dosis alta al R-EPOCH, mostró SG a 2 años del 89 %.37
El escenario de recaída es más sombrío. Por un lado, el trasplante de células madre ha mostrado resultados decepcionantes. En un estudio retrospectivo el uso de trasplante autólogo y alogénico mostró recaída temprana (4,9 meses). 38) Por otro lado, el uso de lenalidomida ha mostrado cierta actividad en las células tumorales.39
En conclusión, el caso reportado fue un paciente varón con diagnóstico de LDCGB CD5+ y recurrencia temprana prostática, pobre respuesta al tratamiento estándar, con una SLP de 4 meses y SG de 11 meses. Por lo tanto, si se considera que este tipo histológico de LDCGB tiene resultados al tratamiento poco favorables, sería necesario el desarrollo de estudios que permitan comprender mejor su biología molecular para establecer estrategias terapéuticas más eficaces.















